Математическая обработка экспериментальных данных
Пусть зависимость a = f(t) для различных температур имеет вид, представленный на рисунке 30.
 |
Рисунок 30 – Зависимость a от t при температурах Т1 и Т2
Первоначально для выбора режима реагирования первоначально находят оценочное значение энергии активации Еа данного процесса. Оценку Еа процесса гидрирования проводят по величине коэффициентов трансформации графической зависимости a =f(t) по формуле:
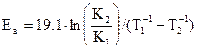 , (41)
, (41)
где К1 и К2 – коэффициенты трансформации экспериментально найденых кинетических кривых.
Коэффициенты трансформации можно рассчитать как отношение времен, необходимых для достижения одной и той же степени гидрирования при температурах Т1 и Т2.
Уравнение (41) получено из уравнения Аррениуса:
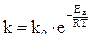 , (42)
, (42)
где k - константа скорости реакции, с-1;
k0 - предэкспоненциальный множитель;
Еа - кажущаяся энергия активации процесса, Дж/моль;
R - универсальная газовая постоянная, Дж/(моль×К).
Пусть найденная таким образом Еа находится в пределах 100-160 кДж/моль. Такая величина энергии активации позволяет сделать вывод о внешнекинетическом режиме реагирования, описывающим начальный период топохимической реакции: лимитирующей стадией является распространение реакционного фронта по поверхности зерна ( рисунок 29).
|
|
|
Для выбора математической модели, адекватно описывающей данный процесс, следует провести расчет кинетических параметров (порядка реакции, константы скорости, энергии активации) по различным уравнениям. Так, например, при использовании уравнения Казеева-Ерофеева, которое чаще всего применяется для описания кинетики реакции в начальный период реагирования:
 , (42)
, (42)
расчет кинетических параметров процесса осуществляли в следующем порядке:
- проводили двойное логарифмирование этого уравнения
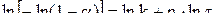 ; (43)
; (43)
 |
- строили зависимость в координатах ln[-ln×(1-a)] = f (lnt), (рисунок 31);
Рисунок 31 – Зависимость ln[-ln(1-a)] = f(lnt) для температур Т1 и Т2
- определяли порядок реакции. Он будет равен среднему значению тангенса угла наклона прямых в координатах ln[-ln(1-a)] = f(lnt) для различных температур;
- для каждой температуры рассчитывали логарифм константы скорости реакции lnk. Эта величина будет равна отрезку, отсекаемому прямой на оси ординат;
 |
- строили зависимость в координатах lnk = f(1/Т), (рисунок 32);
Рисунок 32 – Зависимость lnk = f(1/Т)
|
|
|
- рассчитывали кажущуюся энергию активации процесса Еа по тангенсу угла наклона прямой линии, построенной в координатах lnk = f(1/Т), и величину lnК как отрезок, отсекаемый прямой на оси ординат:
Еа = R×êtg(a)ï×V, (44)
где a - угол наклона прямой в координатах lnK =f(1/Т);
V - масштаб осей абсцисс и ординат.
- найденные значения n и k подставляются в уравнение Казеева – Ерофеева и по полученному кинетическому уравнению строили зависимость α = f(τ), которую сравнивали, применяя методы математической статистики, с экспериментально полученными зависимостями по коэффициентам корелляции. Если найденные значения коэффициентов корелляции близки к единице, следовательно, данное уравнение адекватно описывает формальную кинетику процесса и может быть использовано для дальнейших расчётов.
Дата добавления: 2020-01-07; просмотров: 265; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
