ИНДИКАЦИЯ И КОЛИЧЕСТВЕННЫЙ УЧЕТ ДРОЖЖЕЙ
При установлении причин порчи продукта необходимо поставить вопрос, являются ли наблюдаемые изменения следствием размножения микроорганизмов, изменений в рецептуре или условий хранения. При высокой степени порчи продукта микроорганизмы, ее вызвавшие, могут быть обнаружены обычной микроскопией при 400-500-кратном увеличении. Дрожжи при микроскопии окрашивают кристаллическим фиолетовым. Для этого маленькую каплю 0,5%-ного кристаллического фиолетового вносят в продукт непосредственно на предметном стекле или смешивают с небольшим количеством продукта, разбавленным дистиллированной водой (1 : 10). Микроскопическое исследование позволяет идентифицировать микроорганизм, вызвавший его порчу.
Индикацию дрожжей из испорченных пищевых продуктов осуществляют методом посева на разные питательные среды. Рекомендуется использовать среду па основе дихлорана бенгальского розового агара с хлорамфениколом (DBRC) как длявыделения плесеней, так и дрожжей. Среда ограничивает рост колоний плесеней, позволяя произвести более точный подсчет колоний. ДВПП обычно хорошо размножаются при +25 °С на стандартном солодово-дрожжевом агаре (3 г дрожжевого экстракта, 3 г солодового экстракта, 5 г пептона, 10 г глюкозы, 20 г агара, 1 л воды, рН 5-7). Эту среду используют как для обнаружения, так и количественного определения стандартным методом чашечного подсчета. Необходимо растворить образец в 0,1%-пом пептопном бульоне.Значение рН солодово-дрожжевого агара близко к нейтральному, поэтому рН среды доводят до 4,5 с помощью раствора соляной кислоты.
|
|
|
При анализе пищевых продуктов микробиологи широко используют МЕА (агар на солодовом экстракте) и TGY (агар на триптонотлюкозном дрожжевом экстракте), причем последний более предпочтителен. Ускоренное обнаружение дрожжей, стойких к консервантам (Z. bailii и Z. bisporus), проводят на подкисленной МЕА (например, МАА, уксуснокислый солодовый агар) или подкисленной TGY(TGYA). В основную питательную среду (МЕА или TGY) добавляют 0,5% уксусной кислоты. Колонии дрожжей обычно становятся различимыми через 3-7 сут. Колонии могут быть представлены более чем одним видом дрожжей (из-за сходства внешнего вида колоний это может быть сначала незаметно). При попытке индикации Zygosaccharomyces (например, Z. bailii) и других видов дрожжей время, необходимое для их обнаружения в продукте, можно сократить путем инкубирования чашек с агаром при 30 °С вместо 25 °С. Следует учитывать, что некоторые виды дрожжей осмофильны (в частности, Z. bailii, Z. bisporus, Z. rouxii), поэтому для посева можно использовать высокоосмотические питательные среды на основе YM или TGYe добавлением 40% глюкозы. Разведенный образец окажется также высокоосмотичным (например, 0,1%-ный пептонный бульон с 40% глюкозы).
|
|
|
Для обнаружения отдельных видов Zygosaccharomyces и других дрожжей разработан ряд специальных культуральных сред с различной эффективностью. К ним относится, в частности, лизиноный агар, применяемый для различения видов дрожжей-несахромицетов в тех случаях, когда они встречаются вместе с Saccharomyces cerevisiae, поскольку последние не утилизируют лизин как источник азота. Из охлажденных приправ были случайно выделены психрофильные виды Mrakia и Rhodosporidium, в связи с чем возможна порчапищевых продуктов при низких температурах. Для выделения указанных видов дрожжей может понадобиться инкубация образцов таких пищевых продуктов при температуре 5-10 °С.
Таким образом, основным способом обнаружения ДВПП является посев проб и ожидание проявления видимых признаков размножения микроорганизмов.
Метод не лишен недостатков, главный из которых–затраты времени. Метод измерения импеданса основан на свойстве микроорганизмов при размножении изменять электропроводность питательной среды. Этот метод был использован для обнаружения дрожжей, вызывающих порчу вина. В качестве метода оценки концентрации микроорганизмов в пищевых продуктах и напитках применяется также измерение АТФ-биолюминесценции, так как АТФ содержится во всех живых клетках. С его помощью невозможно идентифицировать отдельные их виды. При анализе напитков имеется другая возможность – продукт пропускают через мембранный фильтр. После чего проводится окрашивание клеток и их подсчет под микроскопом. Разработано несколько методов, основанных па анализе ДНК и позволяющих проводить ускоренное обнаружение и количественную оценку микроорганизмов, вызывающих порчу пищевых продуктов.
|
|
|
ИДЕНТИФИКАЦИЯ ДРОЖЖЕЙ
К методам идентификации дрожжей относят выявление морфологии клетки, определение способов формирования плодовых образований, способов сбраживания углеводов и утилизации азот- и углеродсодержащих соединений. Постоянно встает вопрос, насколько точны традиционные методы идентификации видов. Кстати, виды дрожжей, описанные до 1980 г., были идентифицированы традиционными фенотипическими методами. При сравнении с результатами идентификации на молекулярном уровне правильными оказались более половины из них. В ходе недавних исследований в области идентификации дрожжей около 75% ранее «неизвестных» видов было определено традиционными методами. На основании изложенного можно утверждать, что фенотипические методы до сих пор себя не изжили, хотя они требуют больших затрат труда и времени.
|
|
|
Фенотипическое описание дрожжей включает следующие этапы:
• деление клеток. Выявление способов размножения (почкованием или делением клеток), определение морфологии клеток (рис.8.1.);
• выявление наличия или отсутствия гифов и псевдогифов;
• выявление наличия или отсутствия половых образований;
• выявление способности сбраживать углеводы;
• определение способности к размножению на определенных углерод- и азотсодержащих, а также на других специфических культуральиых средах.
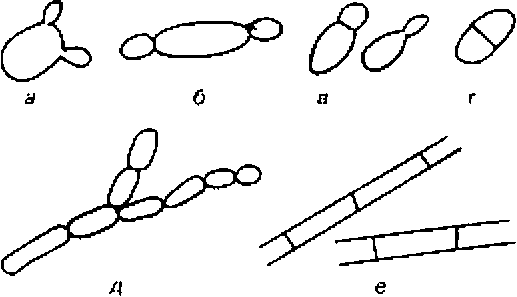
Рис. 8.1.Вегетативное размножение: а — мультилатеральное почкование; б — биполярное почкование; в — полярное почкование на широком (слева) и узком (справа) участках; г — деление клетки; д — псевдогифы; е — истинные гифы.
Вегетативное размножение. Виды дрожжей родовSaccharomyces, Zygosaccharomyces делятся путем мультилатерального почкования(рис.8.1,а),тогда какНатетаsроrа–путем биполярного почкования(рис.8.1,б). Базидиомицетам также свойственны разные типы почкования. Большинство из них размножается путем полярного почкования(рис.8.1,в)–либо на узком основании, либо вблизи полюсов. Некоторым базидиомицетам свойственно типичное мультилатеральное почкование, тогда как другим свойственно и почкование, и деление (рис.8.1,г). При исследовании молодой (24-48 ч) быстро развивающиеся культуры почкующиеся клетки легко распознаются. Клетки же, размножающиеся делением, вскоре образуют концентрическую колонию вокруг исходной, так что способ размножения в данном случае не очевиден.
Дрожжи рода Candida (синоним Torulopsis) идентифицируют по критерию образования псевдогифов, причем признается, что хотя некоторые виды, классифицируемые как Torulopsis, образуют псевдогифы (рис.8.1,д), мицелий такого типа образуют не все штаммы дрожжей рода Candida. Образование истинных гифов также может служить признаком для различения штаммов (рис.8.1,е).
Половые образования.Половые образования нередко формируются перед конъюгацией,которая происходит или между отдельными клетками, или между клеткой и ее почкой (рис. 8.2). Если в качестве конъюгата выступает почка, то место соединения зачастую слегка удлиняется и стенка почки под микроскопом может выглядеть тоньше. Виды, для которых характерна конъюгация между клеткой и ее почкой, почти всегда гомоталломные.
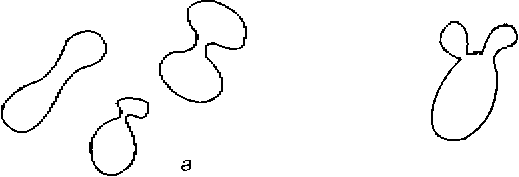
Рис.8 .2.Типы конъюгации клеток:
а — конъюгация между отдельными клетками;
б — конъюгация между клеткой и ее почкой, слегка удлиненной.
Неконъюгированные аски образуются как гомо-, так и гетероталломными диплоидными штаммами. Неспособность штаммов формировать половые образования может свидетельствовать об отсутствии необходимых условии или о принадлежности данной культуры к родственному типу.
Большинство микробиологических лабораторий идентифицируют ДВПП фенотипическими методами. Они очень трудоемки, требуют продолжительного времени и зачастую дают неопределенный результат. Повысить надежность идентификации позволяет способ с использованием микроттровальных кювет, включающая в себя сравнительно большое количество тестов, основанных на процессах культивирования. Вместе с тем, если при использовании стандартных тестов существует определенная вероятность ошибочности идентификации, то не следует ожидать большей точности и от ускоренных методов идентификации.
Методы анализа на молекулярном уровне предоставляют быстрое и точное средство идентификации видов микроорганизмов. Их можно использовать в том числе и обнаружения новых видов ДВПП. Потребность в количественной оценке генетического сходства штаммов и видов на молекулярном уровне была удовлетворена, в частности, благодаря методике реассоциации или гибридизации ядерной ДНК. ДНК из двух представляющих интерес видов разделяют, смешивают и выделяют однонитевую последовательность, после чего степень сходства определяют по уровню реассоциации. Для измерения применяют различные способы: как спектрофотометрические, так с помощью радиоизотопов или других маркеров. Результат измерения комплементарности ДНК обычно выражают процентом связанности, но оно может вводить в заблуждение, так как цепочки ДНК перед дуплексированием должны иметь подобие базовых сегментов не менее 75-80%, а результаты должны соотноситься со шкалой сходства. Существенное влияние на образование двойной спирали ДНК оказывают условия эксперимента, однако при проведении измерений в оптимальных условиях различные методы оценки сходства ДНК дают практически одинаковый результат. Процент сходства ДНК позволяет примерно оценить общее подобие геномов двух микроорганизмов, однако данным методом невозможно обнаружить различия в одном гене или безошибочно определить плоидность, хотя в некоторых случаях может быть выявлена анеуплоидия.
Основной вопрос – как интерпретировать данные о реассоциации ДНК. Считается, что по общему фенотипу штаммы с 80%-ным и более сходством ядерной ДНК относятся к одному виду дрожжей. Данное положение было проверено на основании концепции биологического вида – насколько способность к воспроизведению отдельных штаммов связана с разной степенью сходства ДНК. Было показано, что виды с 25%-ным сходством ДНК дают огромное чисто способов межвидового спаривания, но при этом образование асков ограничено, а аскоспоры вообще не образуются. Поскольку видовые барьеры очень сложны и определяются разными факторами, индикатором принадлежности микроорганизмов к одному виду должно считаться сходство ДНК в 70- 100%.
Наиболее надежным молекулярным методом сегодня представляется определение последовательностей ядерно- и митохондриально-кодированных генов, однако собственно процесс секвенирования гена можно провести далеко не в каждой лаборатории. Следовательно, необходима разработка ускоренных и простых в применении методов идентификации на молекулярном уровне. Благодаря методам, основанным на полимеразной цепной реакции (снятие «отпечатков пальцев» ПЦР-микросателлитов, типирование) в настоящее время существует возможность дифференциации отдельных штаммов ДВПП, принадлежащих как к одному виду, так и к разным видам, а также установления источника их происхождения. Тем не менее эти методы типирования, скорее всего, вскоре будут вытеснены методами с использованием зондов, чипов и т. п.
8.3. ИНДИКАЦИЯ, ИДЕНТИФИКАЦИИ И КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ПЛЕСЕНЕЙ, ВЫЗЫВАЮЩИХ ПОРЧУ ПИЩЕВЫХ ПРОДУКТОВ
В процессах порчи пищевых продуктов и их ферментации участвуют плесени, представляющие собой гифовые грибы, некоторые виды которых продуцируют микотоксииы. Меры контроля роста плесеней в пищевых продуктах путем предотвращения попадания их спор в пищевые продукты, путем регулирования температуры, влажности и содержания кислорода в условиях хранения изделий, с помощью консервантов и других пищевых добавок полностью не исключают возможности воздействия плесеней на качество и безопасность пищевых продуктов.Поэтому необходимо уметь их обнаруживать в готовых изделиях, а также в ходе процессов переработки, упаковки и хранения пищевых продуктов.
До п середины ХХ века плесени идентифицировали методом культивирования на питательных средах в чашках Петри с последующим микроскопированием. В дальнейшем для подавления размножения бактерий питательные среды начали подкислять, что способствовало размножению дрожжей и плесеней, однако особо специфической среды подобрать не удалось. Впоследствии подкисленные питательные среды были заменены средами с антибиотиками, биохимическими реагентами или красителями, замедляющими рост бактерий и позволяющими развиваться дрожжам и плесеням.
Дата добавления: 2019-09-13; просмотров: 472; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
