Опыт 1. Получение этоксида натрия и его гидролиз.
В сухую пробирку поместите 3 капли абсолютного этанола и внесите кусочек металлического натрия, размером с рисовое зернышко. Соберите выделяющийся водород, прикрыв пробирку пробкой. Затем уберите пробку и поднесите пробирку отверстием к пламени горелки. Смесь водорода с воздухом сгорает с характерным «лающим» звуком. Белый осадок этилата натрия растворите в 2-4 каплях этанола и добавьте 1 каплю 1% раствора фенолфталеина. После этого внесите в пробирку 1-2 капли воды. Объясните появление малиновой окраски.
Схемы реакций:
 С2Н5ОН + Na C2H5O–Na+ + ½ H2
С2Н5ОН + Na C2H5O–Na+ + ½ H2
 C2H5O–Na+ + H2O С2Н5ОН + NaOH
C2H5O–Na+ + H2O С2Н5ОН + NaOH
Вопросы:
1. Какие свойства спиртов проявляются в реакции с металлическим натрием?
2. Почему в реакции используется абсолютный этанол?
3. Почему в воде этоксид натрия легко разлагается?
Опыт 2. Реакция глицерина с гидроксидом меди ( II ) в щелочной среде.
Поместите в пробирку 3 капли 0,2н CuSO4, 3 капли 2н NaOH и взболтайте. Появляется студенистый голубой осадок гидроксида меди (II). При нагревании в щелочной среде до кипения, полученный гидроксид меди (II) разлагается с выделением CuO черного цвета. Повторите опыт, но перед кипячением гидроксида меди II, добавьте в пробирку 1 каплю глицерина, перемешайте. Нагрейте до кипения полученный раствор и убедитесь в том, что раствор глицерата меди при кипячении не разлагается. Щелочной раствор глицерата меди под названием реактива Гайнеса применяется в клинических лабораториях для обнаружения глюкозы в моче.
|
|
|
Схемы реакций:
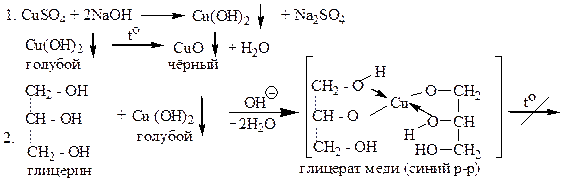
Вопросы:
1. Какие свойства глицерин проявляет в реакции с гидроксидом меди (II)?
2. Сравните силу кислотных центров глицерина и этанола.
3. Для каких целей может быть использована данная реакция в качественном анализе?
Опыт №3. Образование фенолята натрия и разложение его кислотой.
В пробирку с 3 каплями воды поместите 2 капли жидкого фенола и встряхните. К возникшей мутной эмульсии добавляйте по каплям 2н NaОН до образования прозрачного раствора. Подкислите этот раствор несколькими каплями 2н раствора хлороводородной кислоты.
Схемы реакций:
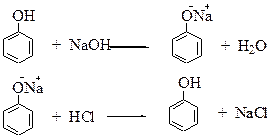
Вопросы:
1. Сравните силу кислотных центров этанола и фенола.
2. Сравните способность к гидролизу фенолята натрия и этоксида натрия.
Опыт 4. Основность аминов.
Нанесите 1 каплю раствора диэтиламина на красную лакмусовую бумагу. Что вы наблюдаете? Приготовьте в пробирке эмульсию из 1 капли анилина и 3 капель воды. Нанесите 1 каплю полученной эмульсии на полоску универсальной индикаторной бумаги. Изменения окраски не наблюдается. Докажите основность анилина реакцией образования солей с сильными кислотами. Разделите оставшуюся эмульсию анилина на 2 пробирки. В одну пробирку добавьте 1 каплю 2н HСl. Эмульсия исчезает (образуется хорошо растворимая солянокислая соль анилина). В другую пробирку добавьте 1 каплю 2н H2SO4. При встряхивании выпадает кристаллический осадок труднорастворимой соли анилина.
|
|
|
Схемы реакций:

Вопросы:
1. Качественно оцените силу основных центров метиламина и анилина.
2. Почему эмульсия анилина в воде не изменяет окраску индикатора?
Дата добавления: 2019-09-13; просмотров: 925; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
