Генетические и биохимические механизмы антибиотикорезистентности. Основные принципы рациональной антибиотикотерапии.
Антибиотикорезистентность – устойчивость микроорганизмов к антимикробным химиопрепаратам.
Различают природную резистентность и приобретённую.
Природная устойчивость связана с генетическими особенностями данного вида микроорганизмов, выражающимися в отсутствии той или иной мишени. Так, микоплазмы лишены клеточной стенки, поэтому на них не действуют β-лактамы и гликопептиды.
Приобретённая устойчивость – чрезвычайно острая проблема, встающая сейчас перед врачами. Она по существу отражает эволюционные перспективы микроорганизмов.
При действии достаточных концентраций антибиотика многие микроорганизмы погибают, однако всегда есть несколько микробных клеток, оказывающихся к веществу устойчивым. Далее они могут дать начало штамму (штаммам), которые чрезвычайно устойчивы к действию одного или нескольких противомикробных препаратов.
Проблема остро встаёт отчасти потому, что антибиотики применяются уже достаточно давно (с 40-х годов прошлого столетия), при этом возникло уже большое количество таких штаммов. Те микроорганизмы, на которых ранее действовали разные антибиотики, в настоящее время могут вызывать очень тяжёлые формы соответствующих заболеваний при отсутствии благоприятного прогноза.
Особенно важно формирование антибиотикорезистентных штаммов в аспекте формирования внутрибольничных инфекций (ВБИ). Естественно, что их возникновению препятствует очень строгое соблюдение лечебного-охранительного и санитарно-эпидемиологического режима, однако в ЛПУ встаёт проблема замкнутой циркуляции микроорганизмов, при этом носителями, как правило, являются медицинские работники.
Существуют варианты генетической и биохимической приобретённой устойчивости, однако они не только не противоречат друг другу, но и взаимодополняют, поскольку биохимическая устойчивость – выражение генетической.
Генетическая устойчивость реализуется в результате:
- мутаций в геноме, при этом идёт селективный отбор мутантов, устойчивых к антибиотику;
- перенос трансмиссивных плазмид резистентности;
- мигрирующие генетические элементы – IS-последовательности или транспозоны – могут являться источниками генов, определяющих устойчивость к антибиотикам;
- экспрессия генных кассет интегронами. Принцип этого явления уже оговаривался, но следует вспомнить, что генные кассеты – мелкие фрагменты ДНК, как раз и несущие гены устойчивости, однако данные гены не экспрессируются, поскольку не имеют промотора. Интегроны – протяжённые последовательности ДНК бактерий (они стабильны, к миграции не способны), причём имеют в своём составе промотор P (помимо гена интегразы и сайта рекомбинации att), за счёт которого и происходит экспрессия соответствующих генов кассет, включаемых в интегрон.
Биохимические аспекты приобретённой устойчивости:
- выработка ферментов, которые разрушают антибиотик;
- нарушение проницаемости бактериальной клетки для антибиотика;
- эффлюкс, или механизм активного выброса. При таком варианте устойчивости антибиотик в клетку попадает, но не может подействовать, поскольку с помощью специальной помпы выбрасывается из клетки (см. рисунок ниже)

- модификация мишени, когда антибиотик, проникая в клетку, не может ни на что подействовать, потому что молекулярно «заточен» под определённые структуры;
- «биохимический шунт», когда происходит смена основного метаболического пути на иной, но на которой антибиотик уже подействовать не может.
Принципы рациональной антибиотикотерапии.
1. Назначение соответствующего антибиотика. Препарат назначается, исходя из клинической картины, однако требуется документальное подтверждение в виде микробиологического исследования, когда был выделен соответствующий возбудитель. При бактериологическом исследовании составляется так называемая антибиотикограмма (то есть определяется чувствительность к антибиотикам данного микроорганизма, причём используются минимальные ингибирующие концентрации). Последнее обстоятельство позволяет назначить антибиотик «прицельно», т.е. сузить спектр действия до того препарата, который эффективно уничтожает именного этого микроорганизма, просто концентрацию повышают в 2-3 раза. Однако порою ждать результатов нельзя, и врач должен действовать. В таком случае назначаются антибиотики широко спектра до получения заключения.
Использовать антибиотики с целью профилактики можно только в очень ограниченных случаях. Это хирургическая обработка ран, это профилактика медицинского персонала, если он контактирует с человеком, у которого высококонтагиозная инфекция (например, дифтерия);
2. Подобрать соответствующую дозу (учесть фармакодинамику и фармакокинетику препарата) и на адекватный промежуток времени;
3. Объективно оценивать эффективность препарата только через 48-72 часа после начала приёма антибиотиков;
4. Разъяснение пациенту, что нужно использовать антибиотики только в соответствии с рекомендациями врача (соблюдать режим дозирования, время использования препарата);
5. Рекомендуется через 10-15 дней антибиотикотерапии сменить один класс антибиотика на другой. Недопустимо использовать подряд два различных ингибитора синтеза клеточной стенки. Это диктуется тем, что при первом использовании такого ингибитора могли возникнуть устойчивые L-формы без клеточной стенки, на которые эти препараты действовать уже не будут.
21. β-лактамные антибиотики. Классы, механизмы действия. Защищенные β-лактамы.
Эти антибиотики объединены на основании того, что они имеют так называемое β-лактамное кольцо. В эту группу входят пенициллины, цефалоспорины, карбапенемы и монобактамы.
Пенициллины.
Пенициллины содержат β-лактамное кольцо, соединённое с пятичленным циклом.
Различают природные и полусинтетические пенициллины.
Природные пенициллины выделены из соответствующих источников. Различают: бензилпенициллин (в виде натриевой или калиевой соли), новокаиновая соль бензилпенициллина + бензатина бензилпенициллин (так называмое депо препарата), феноксиметилпенициллин (является кислотоустойчивым).
Полусинтетические пенициллины делятся на несколько групп:
- антистафилококковые (оксациллин) – эффективны в отношении S. pyogenes;
- расширенного спектра (ампициллин, амоксициллин);
- антисинегнойные, которые делятся на 2 группы:
а) карбоксипенициллины (тикарциллин);
б) уреидопенициллины (азлоциллин, пиперациллин);
- ингибиторозащищённые пенициллины– комбинация какого-либо пенициллина с ингибитором β-лактамаз. Классическим примером является комбинация амоксициллина и клавулановой кислоты.
Механизм действия: пенициллины, как и все β-лактамные антибиотики, нарушают синтез клеточной стенки.
В синтезе клеточной стенки участвует фермент, состоящий из 2-х доменов, соединённых линкером: транспептидаза, которая строит пептидные фрагменты пептидогликана, и гликозилтрансфераза, которая соединяет N-ацетилглюкозамин и N-ацетилмурамовую кислоту. Именно данный фермент ингибируют пенициллины. Таким образом, пенициллины оказывают бактерицидное действие.
Спектр действия: по спектру действия распределим все пенициллины на 3 группы (спектр действия увеличивается сверху вниз):
I. Узкого спектра действия:
- антистафилококковые пенициллины – устойчивы к действию стафилококовых β-лактамаз;
- антисинегнойные – активны в отношении Pseudomonasaeruginosa;
II. Природные пенициллины активны в отношении следующих микроорганизмов: грамположительные кокки (стрептококки, стафилококки), грамотрицательные кокки (нейссерии), палочки (дифтерийная, сибирская язва), спорообразующие анаэробы (клостридии), неспорообразующие анаэробы (пептострептококки) и спирохеты (бледная трепонема, боррелии);
III. Пенициллины расширенного спектра. Активны в отношении гемофильной палочки, представителей сем. Enterobacteriaceae (E. coli, Ptoteusspp., Shigellaspp., Salmonellaspp.) + те микроорганизмы, которые были перечислены для природных пенициллинов. Кроме того, амоксициллин активен в отношении Helicobacterpylori и используется для её эрадикации.
Цефалоспорины.
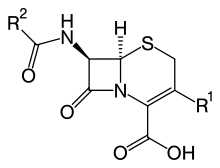
Это β-лактамные антибиотики, которые очень похожи по структуре на пенициллины, но само β-лактамное кольцо соединено с 6-членным циклом.
Ниже приведены структурные формы этих двух классов. Соответственно, слева изображена общая структурная формула пенициллинов, а справа – цефалоспоринов.

Классификация цефалоспоринов опирается на их поколение или способ введения, что обычно комбинируется в единой схеме.
| Способ введения препарата | I поколение | II поколение | III поколение | IV поколение | V поколение |
| Парентеральный | Цефазолин | Цефуроксим | Цефтриаксон, цефотаксим, цефтазидим, цефоперазон | Цефепим | Цефтобипрол |
| Пероральный | Цефалексин | Цефуроксим, цефаклор | Цефиксим |
Механизм действия цефалоспоринов ничем не отличается от действия пенициллинов.
Касательно спектра действует очень простое правило: чем больше поколение, тем шире спектр:
- 1-е поколение – антибиотики активны в основном в отношении грамположительных кокков;
- 2-е поколение – антибиотики практически похожи на цефалоспорины первого поколения, однако активны также в отношении представителей семейства Enterobacteriaceae (клебсиеллы, кишечная палочки, протеи, шигеллы, сальмонеллы и т.д.);
- 3-е поколение – к спектру действия добавляется гемофильная палочка, а также два препарата – цефтазидим и цефоперазон – активны в отношении синегной палочки. Устойчивы к действию β-лактамаз;
- 4-е поколение – эти антибиотики прекрасно проходят через ГЭБ, легко проникают через клеточную стенку грамотрицательных бактерий (активны в отношении синегнойной палочки), выше активность в отношении кокков. Очень устойчивы к действию β-лактамаз, поэтому часто используются при лечении внутрибольничных инфекций;
- 5-е поколение – антибиотики показали хорошее действие против MRSA-штаммов (метициллиноустойчивых золотистых стафилококков) и VRSA-штаммов (ванкомицинустойчивых золотистых стафилококков).
Карбапенемы.
Наиболее важные препараты этой группы – имипенем, меропенем.
Из всех β-лактамов имеют самый широкий спектр:
- активны в отношении большинства грамположительных бактерий (кроме MRSA и MRSE);
- анаэробы (кроме Clostridiumdifficile);
- большинство грамотрицательный бактерий
Очень устойчивы к действию β-лактамаз.
Монобактамы.
Наиболее важным препаратом является азтреонам. Узкий спектр действия (активность в отношении грамотрицательных бактерий).
Устойчивы к действию β-лактамаз.
Дата добавления: 2019-09-13; просмотров: 1042; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
