ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 21, 7
Основные положения электрохимической теории строения шлаков.
Согласно ЭХТ, компоненты шлакового расплава диссоциированы на ионы, поэтому закономерности, характерные для растворов электролитов свойственны и шлаковым расплавам.
В жидких шлаках присутствуют катионы Ca, Mg, Fe, Zn, Al (2+) и прочие, а также анионы S и O (2-).
Структурной единицей шлакового расплава является комплекс (SiO4)4-, имеющий вид тетраэдра в центре которого находится катион Si4+, а в вершинах анион O2-.
В общем виде в оксидных расплавах кремнекислородные тетраэдры разделены катионами. С повышением концентрации SiO2 тетраэдры объединяются вершинами, образуя цепочки, кольца и другие структуры. Образование длинных цепочек является причиной высокой вязкости силикатных шлаков. Добавка в шлак оксидов двухвалентных Me приводит к «разрыву» цепочки и, соответственно, к снижению вязкости шлака.
При повышении температуры возрастает электропроводность шлаков.
На основе ЭХТ выделяют ЭХ форму (обратимость реакции (Cu2O) + [FeS] -> [Cu2S] + (FeO)) потерь металлов и механические потери, связанные с некачественным разделением шлака и штейна в процессе отстаивания.
Анализ диаграммы состояния Fe - Cu - S , вывод правила Мостовича.
Растворимость меди в оксидной и сульфидной формах в шлаке зависит от ее содержания в штейне. При увеличении содержания меди в штейне увеличивается ее концетрация в шлаке. Для оценки доли меди в шлаке, можно использовать зависимость (правило Мостовича В.Я.):
|
|
|
(Cu)шл.=[Cu]шт /100
Механизм восстановления оксидов металлов твердым углеродом.
Углетермическое восстановление применяется в металлургии свинца (шахтная плавка агломерата), агломерации, восстановительно-сульфидирующей шахтной плавке окисленных никелевых руд.
На данный момент выделяют несколько схем протекания данного процесса:
1) Двухступенчатая схема
Ее основу составляют следующие реакции:
MeO + C -> Me + CO (1) – реакция прямого восстановления
MeO + CO -> Me + CO2 (2) – реакция косвенного восстановления
C + CO2 -> 2CO (3) – газификация углерода
В начальный момент времени допускается взаимодействие твердого углерода с оксидом металла, сопровождаемое образованием CO, вместе с тем, основным источником CO является реакция (3) и ей принадлежит важная роль – поставщик CO. Важное значение и основой данной схемы Байкова являются реакции (2) и (3). Двухступенчатая схема должна обеспечивать отсутствие кинетических затруднений для протекания стадии (2) и (3).
Непосредственное взаимодействие MeO с C доступно для легковосстанавливаемых оксидов. Для трудновосстанавливаемых восстановление происходит по косвенному механизму. Косвенный механизм развивается преимущественно для восстановления MexOy металлов, имеющих сравнительно низкое сродство к кислороду.
|
|
|
Исследования кинетики свидетельствуют о том, что лимитирующей является стадия (3). Для ускорения процессов восстановления оксидов необходимо использовать более реакционноспособные виды восстановителей.
2) Диссоциативная схема
Основные реакции:
MexOy -> MexOy-1 + ½ O2 (1)
С + ½ O2 -> CO (2)
MexOy + CO -> MexOy-1 + CO2 (3)
Данная схема реализуется для оксидов металлов с высокой степенью диссоциации, т.е. которые склонны к диссоциации (PO2 > 1 Па).
Данный механизм подтверждается тем, что восстановление наступает при таких температурах, когда реакция газификации углерода еще не развивается, поэтому нет источника CO.
К интенсификации процесса приводит интенсивное совместное измельчение (с нарушением кристаллической решетки).
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 24, 10
Кинетический и смешанный режимы. Характерные признаки процесса в кинетической области. Вид типичной кинетической кривой для топохимических реакций, ее анализ.
|
|
|
Факел, который образуется при истечении топлива в среду окислителя (или окислителя в среду топлива, горючего). Его называют - диффузионным факелом - (диффузионное горение, диффузионное пламя).
Факел, который образуется при истечение заранее подготовленной смеси топлива и окислителя в окружающую среду (она может быть тоже окислительной). Такой тип называют - кинетическим факелом - (кинетическое горение, кинетическое пламя).
Для первого типа главную роль играет явление диффузии, смешения (молекулярной, турбулентной).
Для второго типа главную роль играет кинетика химических реакций (тепловой и цепной механизмы распространения пламени).
Горение – это процесс преобразования смеси одних химических соединений в смесь других химических соединений (продуктов горения), текущий в режиме самоорганизации и сопровождающийся (обычно) выделением тепла и света.
tпреобр = tсмеш + tнагрева + tхим.р.,
где tсмеш – время, необходимое для подвода окислителя к топливу (время смешения); tнагрева– время нагрева компонентов горения до температуры воспламенения; tхим.р. – время протекания химической реакции горения;
• tсмеш >> tхим.р.: диффузионный режим горения (tпреобр≈tсмеш)
|
|
|
• tсмеш = 0 << tхим.р.: кинетический режим горения (tпреобр≈tхим.р.)
• tсмеш≈ tхим.р.: смешанный диффузионно-кинетический режим горения.
При кинетическом режиме горения интенсивность горения (tпреобр) определяется концентрацией горючего (составом смеси), родом горючего и окислителя, температурой и давлением смеси, т.е. зависит от того же, чем определяется скорость химических реакций, – зависит только от кинетики самих химических реакций. Поэтому такой вид горения и называется - кинетическим.
При диффузионном режиме горения tпреобр определяется гидродинамикой геометрической области преобразования, т.е. определяется интенсивностью процесса смешения, а также родом горючего и окислителя.
Кинетическая область протекания процессов
При протекании процессов в кинетической области стадия химической реакции является лимитирующей, и её скорость определяет скорость процесса в целом. Диффузионные торможения в этом случае отсутствуют, и скорость процесса рассчитывают, используя методы истинной или формальной кинетики, по кинетическим уравнениям.
Основные признаки протекания процессов в кинетической области: а) сильная зависимость скорости процесса от температуры, описываемая уравнением Аррениуса. При этом энергия активации, как правило, велика и при уменьшении температуры в большинстве случаев практически не изменяется; б) независимость скорости процесса от линейной скорости газа или жидкости (при сохранении неизменным времени контакта) и интенсивности перемешивания (при проведении процесса в замкнутом объеме), а для высокопористых материалов – от размера частиц.
На топохимических реакциях основано восстановление металлов из руд, промышленное получение строительных и полупроводниковых материалов.
Вероятно, к классу топохимических реакций могут быть отнесены некоторые процессы самораспространяющегося высокотемпературного синтеза.
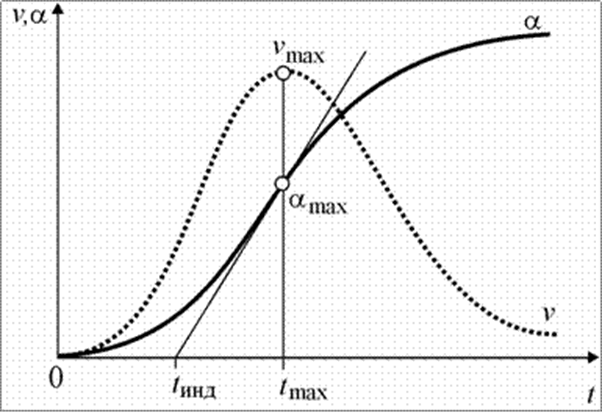
Характерной особенностью топохимических реакций является S-образный вид зависимости степени превращения a от времени
Типичные кинетические кривые топохимических реакций:
a - степень превращения; v - скорость реакции; t - время от начала реакции; tинд - время индукции; vmax, amax, tmax - максимальная скорость, соответствующие ей степень превращения и время от начала реакции
В случае, когда реакция протекает чисто в кинетической области, топохимическую реакцию можно представить, как последовательность следующих стадий:
– образование отдельных молекул или элементарных ячеек продукта реакции на поверхности исходного вещества;
– возникновение отдельных зародышей (ядер) фазы продукта реакции;
– рост ядер вплоть до смыкания их, образование на поверхности исходного вещества сплошного продукта реакции;
– рост сплошного слоя продукта реакции за счет сокращения объема и поверхности еще не прореагировавшего вещества.
Чтобы получить уравнение кинетики топохимической реакции, нужно знать или предположить, по крайней мере, следующие основные параметры:
– закон образования ядер новой фазы;
– закон роста ядер;
– форму ядер.
Модель массопередачи кислорода из объема газового потока к реакционной поверхности MeS . Особенности кинетики окисления при образовании твердой пленки оксидов металла на поверхности MeS .
Перемещение О2 в этих системах неравноценно по интенсивности и зависит от растворимости газа в жидкой фазе, от мощности барботажа, размера пузырьков, скорости вращения вала и формы мешалки, химического состава питательной среды, температуры, толщины невозмущаемых слоев жидкости вокруг газового пузырька и клетки, от наличия и химического состава капсул, толщины и особенностей клеточной стенки и клеточной мембраны биообъекта, и некоторых других причин. Зона невозмущенного слоя жидкости вокруг клетки может не формироваться в случаях образования ее вокруг пузырька и клетки одновременно. Тогда и путь перемещения кислорода от газового пузырька в клетку сокращается. Следует иметь ввиду, что при избытке растворенного кислорода проявляется его токсическое действие на биообъект. Вот почему желателен автоматический контроль за поддержанием оптимальных концентраций кислорода в среде для соответствующих культур. Теперь известны РО-статы (приборы для поддержания необходимого уровня растворимого О2), обеспечивающие подобный контроль.
Если молекула кислорода приобретает дополнительный электрон, то образуются свободные кислородные радикалы: супероксидный (О2), гидроксильный (ОН-) и синглетный кислород ('О2). Эти радикалы – потенциальные деструкторы липидов, белков, нуклеиновых кислот. В частности, к ним чувствительны клеточные мембраны, в которых первичной мишенью выступают липиды, протоны которых взаимодействуют с радикалами и наступает так называемая «липидная пероксидация» с образованием пероксидов.
Известно, что с возрастанием температуры окружающей среды растворимость кислорода в воде уменьшается. Таким образом, для переноса кислорода из одной фазы в другую необходимо добиться разницы его концентрации в разных фазах с преобладанием в направлении от газового пузырька к клетке. Но поскольку растворимость кислорода в воде и водных растворах мала, необходимо подавать его в биореактор в несколько повышенных количествах, добиваясь указанной разницы в фазовых системах. При этом достигается некая критическая концентрация кислорода в культуральной среде, когда все аэробные клетки насыщаются кислородом. Для клеток микроорганизмов показатели таких концентраций приходятся на диапазон 0,003 - 0,05 ммоль/л (примерно 0,1 - 10% наибольшей растворимости кислорода в воде) или, применительно к воздуху, от 0,5 до 50%-го насыщения. Так, для клеток кишечной палочки критическая концентрация растворенного кислорода составляет 0,0082 ммоль/л при 38°С, для пеницилла – продуцента пенициллина при 24°С – около 0,022 ммоль/л, для Saccharomyces cerevisiae при 20°С - 0,0037 ммоль/л. Для некоторых мицелиальных грибов, например, Myxothecium verrucaria, удельная потребность в кислороде становится наивысшей в начале лаг-фазы размножения клеток, хотя плотность клеточной биомассы продолжает нарастать. В тоже время общая потребность в кислороде достигает максимума в конце лаг-фазы и начале стационарной фазы, то есть удельная скорость размножения клеток достигается своего пика раньше, чем скорость использования кислорода.
Скорость переноса кислорода рассчитывают на единицу объема биореактора, исходя из отношения произведения плотности потока и площади поверхности раздела фаз (газ - жидкость) к объему жидкой фазы в реакторе:
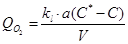
где kl – коэффициент массопередачи; С* - концентрация растворенного вещества в жидкой фазе, находящейся в равновесии с газовой фазой; а – площадь поверхности раздела фаз «газ – жидкость»; V – объем жидкой фазы. Если весь кислород, поступающий в жидкую среду, быстро усваивается клетками, тогда С = 0 и массообмен кислорода здесь максимален.
Средняя объемная скорость поглощения кислорода (Q*02 моль×с/л) в объеме V выражается уравнением:
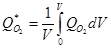
Когда гидродинамические условия в биореакторе, концентрация кислорода и отношение площади поверхности раздела фаз к объему одинаковы, тогда QО2 равна Q*О2. Обычно при вполне благоприятном аэрировании среды концентрация клеток в биореакторе может достигать величины 108/мл . Исходя из усредненных размеров клеток бактерий по диаметру 1 мкм, дрожжей – 7 мкм, нитчатых грибов – 20 мкм объемы их в процентах к объему среды составят около 0,005, 1,8 и 2 соответственно, то есть бактериальная масса будет примерно в 400 раз меньше грибной массы. Удельная поверхность раздела всех клеток будет 3 см2/см3 – для бактерий, 154 см2/см3 – для дрожжей и 30 см2/см3 – для нитчатых грибов. Следовательно, эффективная поверхность в данных примерах будет больше у дрожжей. Поэтому адекватная доставка кислорода – как лимитирующего фактора зависит от морфофункциональных особенностей культивируемого биообъекта и условий его выращивания.
На скорость потребления кислорода биообъектом влияют:
- Возраст культуры (делящиеся, или размножающиеся клетки потребляют кислорода больше, чем неделящиеся);
- Межклеточная адгезия. Когда при выраженной адгезии образуются агломераты, или комочки клеток, и, напротив, при малой или совсем не проявляющейся адгезии клетки находятся в изолированном состоянии друг от друга;
- От быстроты динамических изменений в среде выращивания биообъекта (например, в производстве экзополисахаридов, продуцируемых аэробными микроорганизмами, заметно возрастающая вязкость среды снижает поступление О2 к клеткам);
- Скорость накопления биомассы клеток – чем больше биомасса, тем скорость поглощения кислорода быстрее снижается, то есть зависимость здесь обратно пропорциональная;
- Качество источников питания, подлежащих окислению. Для сравнения можно назвать такие источники углерода, как глюкоза и предельные углеводороды из нефти. Молекулы глюкозы в питательной среде и в клетках одинаковы, так как степень восстановленности атомов углерода в данных молекулах одинаковы. Поэтому и отношение потребленного кислорода к количеству превращенной глюкозы меньше, чем это имеет место в случае использования углеводородов;
- Пеногасители, добавляемые к вспенивающимся культуральным жидкостям в процессе выращивания некоторых биообъектов. Так, например, натрия лаурилсульфат в концентрации 10 млн-1 снижает коэффициент массопередачи кислорода на 56% (в сравнении с водой);
- Продукты метаболизма, например, секретируемые белки, также снижают массопередачу кислорода.
Действие всех перечисленных факторов проявляется во времени и сказывается не только на показателях массообмена, но и теплообмена – ферментации протекают в растворах неньютоновских псевдопластичных жидкостей. В биотехнологических процессах теплообмен – постоянно учитываемый и контролируемый фактор – либо требуется подача тепла, например, в случаях стерилизации питательных сред или при культивировании анаэробов при 55 - 56°С (биологическая обработка отходов в безкислородных условиях), либо, напротив, необходим отвод тепла, образующегося в биореакторах, в которых выращивают аэробные клетки. В этих целях пользуются рубашками аппаратов, в которые подается горячая или холодная вода, змеевиками, в монтированными внутри аппаратов, «выносными» теплообменниками и др. Взаимосвязь скоростей отвода и образования теплоты описывается уравнением:
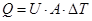
где Q – теплота; U – общий коэффициент теплообмена; А – площадь поверхности теплообмена; DT – характерная межфазная разность температур между культуральной жидкостью и нагревающей (охлаждающей) жидкостью.
Под общим коэффициентом теплообмена (U) понимают количество теплоты, передаваемое в единицу времени через единичную поверхность при разности температур в 1°С. Поэтому и теплообмен в общем виде можно определить, как перераспределение тепловой энергии между взаимодействующими фазами в биореакторе. Теплообмен зависит отряда факторов:
Ламинарного или турбулентного движения теплоносителя;
- Толщины и качества материала стенок биореактора;
- Вязкости среды;
- Скорости потока при полунепрерывном и непрерывном способах культивирования биообъектов;
- Характера охлаждения биореактора.
В атмосферных условиях поверхности металлов покрыты оксидами. При комнатной температуре окисление металла сначала идет достаточно быстро, но при достижении определенной толщины оксидной пленки процесс окисления резко замедляется. Так, при окислении меди после двухчасовой выдержки толщина оксидной пленки достигает 24Ǻ и затем почти не изменяется (1Ǻ=10-10м).
Процесс окисления при низких температурах начинается с физической адсорбциикислорода, переходящей в стадиюхемосорбциии окисления. Если выделяемая при физической адсорбции энергия мала и имеет порядок единиц килокалорий на моль (ккал/моль), то энергия хемосорбции и образования стабильных оксидов составляет десятки и сотни килокалорий на моль (таблица 1).
Таблица 1
| Металл | Стойкий оксид | Энергия, ккал/моль | |
| Образования оксида | Хемосорбции О2 | ||
| Al | Al2O3 | 266(89) | 211(105) |
| Ti | TiO2 | 235(118) | 236(118) |
| Cr | Cr2O3 | 183(61) | 174(87) |
| Mn | Mn2O3 | 153(51) | 150(75) |
| Fe | Fe3O4 | 134(36) | 136(68) |
| Co | Co3O4 | 102(25) | 100(50) |
| Ni | NiO | 116(116) | – |
| Mo | MoO2 | 131(65) | 172(86) |
| Ta | Ta2O5 | 193(39) | 212(106) |
| W | WO2 | 134(67) | 194(97) |
В таблице приведены значения энергий хемосорбции и энергии образования некоторых оксидов металлов. В скобках указана энергия связи, приходящаяся на каждый атом кислорода в оксиде и хемосорбированном слое.
Отметим, что для большого числа металлов энергия связи, приходящаяся на каждый хемосорбированный атом кислорода, близка к энергии связи, приходящейся на каждый атом в оксиде. Следовательно, хемосорбция кислорода является начальной стадией окисления металлов (образование первого слоя, рис. 10).
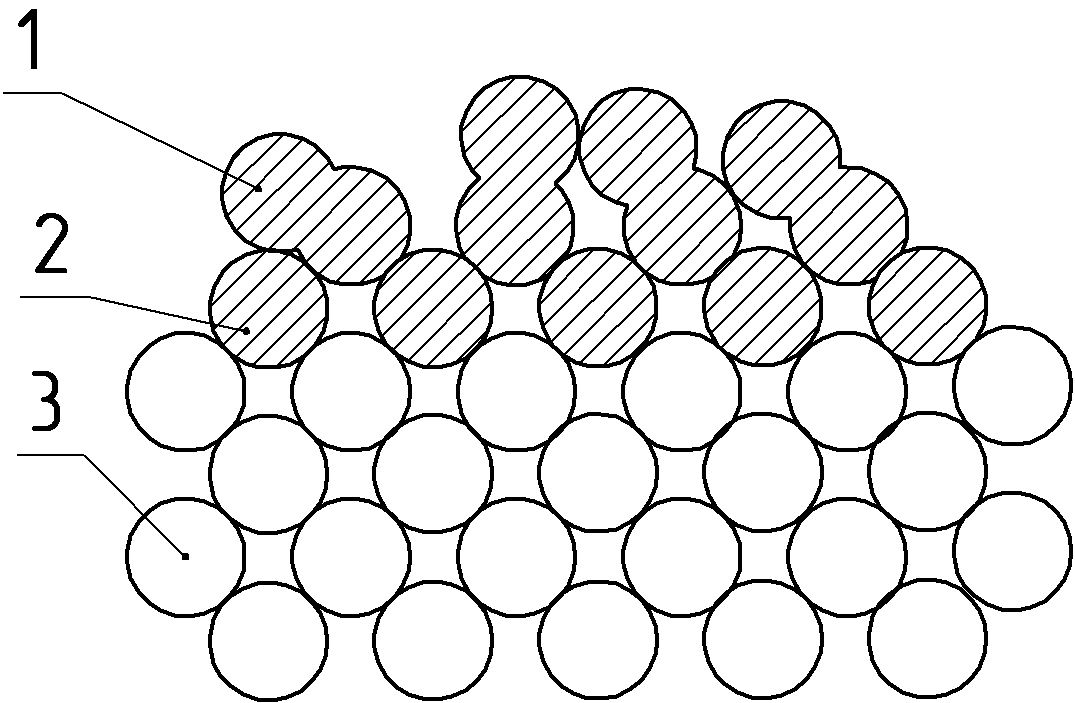

| а | в | с |
Рисунок 10. Схема последовательности образования (а) и строения слоя хемисорбированного кислорода на металле (в) и строения оксида (с)
1 – адсорбированные молекулы кислорода; 2 – хемосорбированные атомы кислорода; 3 – атомы металла.
Результатом взаимодействия кислорода с металлами является образование оксидной пленки, которая снижает их химическую активность. При окислении металлам свойственна тенденция к сохранению в окисных пленках своей собственной атомной структуры. Чем меньше толщина оксидной пленки, тем больше ориентационное воздействие металла на ее структуру. С увеличением толщины пленки в ее структуре происходят превращения, в результате которых образуются оксиды с присущими им типом и параметрами кристаллической решетки и плотностью.
В зависимости от толщины, оксидные пленки принято подразделять на:
• тонкие (невидимые) толщиной от мономолекулярного слоя до 40 нм (400Ǻ);
• средние (видимые как цвета побежалости), имеющие толщину 40-500 нм (400-5000Ǻ);
• толстые (видимые), толщиной свыше 500 нм (>5000Ǻ), например, окалина на стали.
После образования на поверхности металла первичной пленки дальнейший рост ее толщины определяется диффузией через нее металла и кислорода (рис. 11).
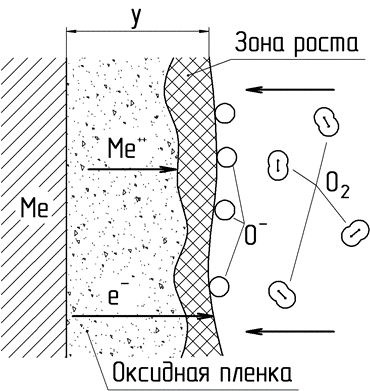
Рисунок 11. Схема механизма роста оксидной пленки при соизмеримых скоростях встречной диффузии металла и кислорода
Так как оксидные пленки на металлах имеют ионную кристаллическую структуру, обладающую ионной и электронной проводимостью, то в диффузионных процессах через пленку участвуют не атомы, а ионы металла и свободные электроны (рис. 11). Возможно также образование ионов кислорода на внешней поверхности пленки за счет ионизации проходящими со стороны металла электронами. Образующиеся ионы кислорода диффундируют в сторону металла. В силу того, что радиусы ионов металла значительно меньше радиуса иона кислорода, скорость диффузии первых несколько выше. Поэтому образование оксида, а, следовательно, и рост толщины пленки, происходит в зоне близкой к ее внешней поверхности. При этом изменяется соотношение компонентов, участвующих в образовании оксида, что, как следствие, может приводить к образованию на поверхности металлов «сложных» пленок, состоящих из нескольких оксидов (рис. 12).
 а
а
|  б
б
|
| Рисунок 12. Микроструктура сечения оксида, образовавшегося: а – после 100-ч окисления кобальта в атмосфере воздуха при 800°С; б – после 24-ч окисления железа в атмосфере воздуха при 620°С. | |
Кинетика роста толщины оксидных пленок определяется их структурой и, в частности, сплошностью. Условие сплошности состоит в том, что молекулярный объем оксида должен быть больше объема металла, ушедшего на его образование, чтобы покрыть поверхность металла сплошным слоем. Следовательно, обозначив молекулярный объем оксида VОК, а объем металла, из которого он образуется –VМе, можно записать:
при 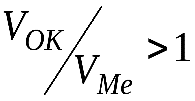 – образуется сплошная оксидная пленка;
– образуется сплошная оксидная пленка;
при 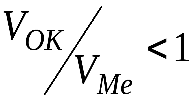 – оксидная пленка не получается сплошной.
– оксидная пленка не получается сплошной.
Указанные соотношения для некоторых металлов таковы: MgO– 0,85; CaO– 0,63; Al2O3– 1,31; CuO– 1,71; CoO– 1,78; FeO– 1,71; Fe3O4– 2,09; Fe2O3– 2,14; Cr2O3– 2,02; WO– 3,36; MoO3– 3,45.
В тех случаях, когда 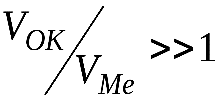 могут возникать такие напряжения, которые приводят к вспучиванию и отслаиванию оксидной пленки, что приводит к снижению ее защитных свойств.
могут возникать такие напряжения, которые приводят к вспучиванию и отслаиванию оксидной пленки, что приводит к снижению ее защитных свойств.
Наиболее плотные и прочно сцепленные с поверхностью оксидные пленки образуются при соотношении 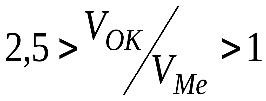 .
.
Для несплошных оксидных пленок скорость роста их толщины определяется кинетикой химического взаимодействия (кинетический режим) и подчиняется линейному закону:
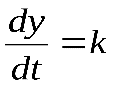 (4)
(4)
где y– толщина пленки; t– время окисления; k– константа, зависящая от парциального давления окислительного компонента и температуры.
После интегрирования получим: y=kt+A, где А– постоянная интегрирования, характеризующая начальную толщину оксидной пленки. На рисунке 13 приведена зависимость, характеризующая процесс окисления магния в кислороде.
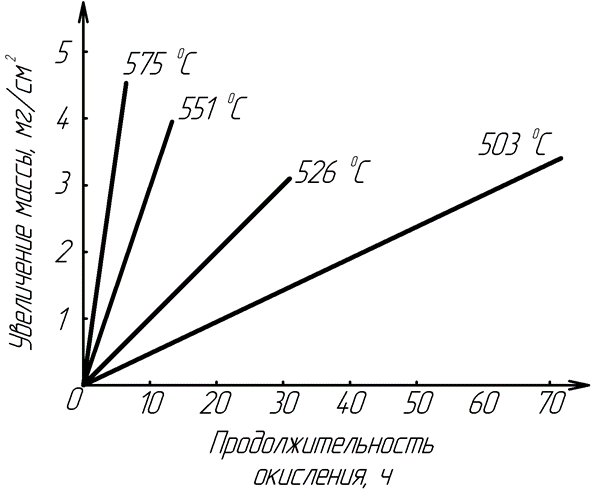
Рис. 13 Линейный закон роста оксидной пленки при окислении магния в кислороде при различных температурах
Для сплошных оксидных пленок, с ростом ее толщины, процесс диффузионного переноса будет замедляться (диффузионный режим) и скорость роста оксидной пленки будет подчиняться параболическому закону: y2=kt+А (рисунок 14). Для некоторых металлов и условий окисления скорость роста оксидной пленки может описываться более сложной параболической: yn=kt+А (медь при Т>300ºC, железо при Т>500ºC, никель), или логарифмической зависимостями: y=ln(kt) (алюминий при Т<300ºC, цинк, хром, медь при Т<300ºC, железо при Т<500ºC, никель, см. рис. 15).
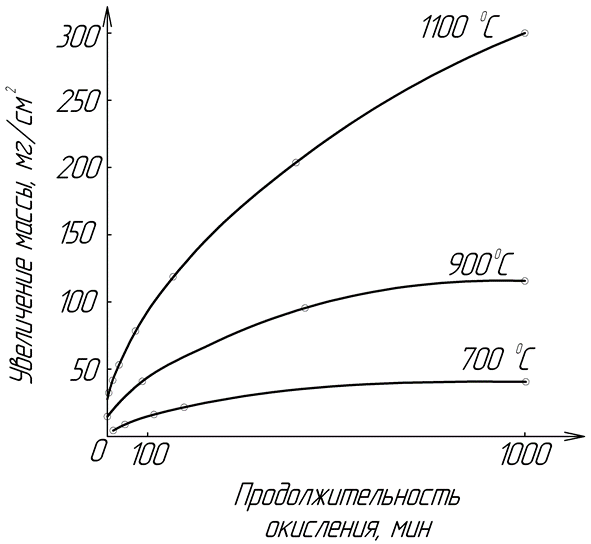
Рисунок 14. Параболические кривые роста окисной пленки при окислении железа (при Т>500ºC)
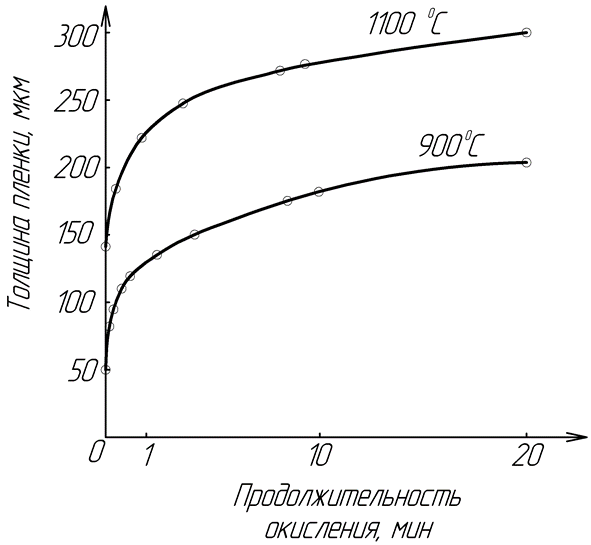
Рис. 15 Логарифмические кривые роста оксидной пленки при окислении железа (при Т<500ºC)
Следует отметить, что указанные закономерности действительны только для чистых металлов. Наличие легирующих компонентов в сплавах или даже примесей в металлах может существенно изменять свойства поверхности и характер взаимодействия с кислородом.
В процессах пайки металлов большое значение имеют не только толщина, но и свойства оксидных пленок. Сплошные, прочно связанные с металлами оксидные пленки труднее удалять с паяемой поверхности, что осложняет процесс пайки. Чем менее компактна оксидная пленка, чем слабее ее связь с металлом, тем меньше ее устойчивость при нагреве, тем меньше трудностей с ее удалением при пайке.
На поверхности металлов, кроме оксидов, могут находиться и другие вещества с неметаллической связью, препятствующие образованию физического контакта припоя с паяемым материалом, например, масла, жиры, пыль, краски, охлаждающие жидкости и адсорбированные газы. Подобные загрязнения удаляются с паяемых поверхностей в процессе подготовки путем общего или местного обезжиривания в различных растворителях.
Удаление оксидных пленок и других продуктов химического взаимодействия поверхностного слоя металла с внешней средой и предотвращение их образования может быть произведено механическими, физическими, химическими и физико-химическими методами.
Особенности макромеханизма окислительных процессов с участием кислорода газовой фазы (г.ф.) и шлака, протекающих в сульфидных и оксисульфидных расплавах. Характеристика этапов окисления FeS в штейно-шлаковой эмульсии печи Ванюкова.
В зависимости от температурных условий и парциального давления кислорода образующийся металл будет накапливаться на реакционной поверхности или переходить в оксид. Более сложный характер процесса будет иметь место при образовании на сульфиде слоя оксида (рис. 12.16). В этом случае в слое оксида протекают диффузионные явления, характер которых предопределяется наличием дефектов в решетке оксида, т.е. будет ли это оксид, относящийся к n- полупроводникам с избытком катионов или анионными дырками, или кp-полупроводникам с избытком кислорода, т.е. катионными дырками.
Механизм процесса в этом случае имеет много общего с окислением металлов в диффузионном режиме при наличии слоя оксида, но вместе с тем и собственные характерные особенности.
На границе CD, т.е. MeO–O2, в зависимости от полупроводниковых свойств оксида могут иметь место следующие явления:
1) хемосорбция кислорода, сопровождающаяся связыванием электронов проводимости;
2) достройка решетки MeO и связанное с этим образование катионных вакансий или уничтожение катионов, находящихся в междоузлиях;
3) заполнение анионных вакансий кислородом;
4) десорбция сернистого газа и образование новых анионных вакансий.
На границе AB, т.е. MeS–MeO, с учетом полупроводниковой природы сульфидов возможны следующие явления:
1) переход катионов металла из решетки сульфида или в междоузлия решетки оксида (n-полупроводника) или в катионные вакансии(p-полупроводника);
2) переход анионов серы из решетки сульфида в решетку оксида с заполнением анионных вакансий;
3) достройка решетки оксида катионами сульфида с образованием анионных вакансий и генерацией электронов;
4) возможна также замена в решетке сульфида анионов серы на ионы кислорода, сопровождающаяся ростом слоя оксида и выделением SO2.
Особое значение в процессе взаимодействия сульфидов с кислородом играют физические свойства образующегося оксидного слоя, в частности его равномерность и плотность. Необходимо также учитывать различие удельных объемов оксида и сульфида. При большом их различии возникают термические напряжения на границе MeS–MeO, что приводит к отслаиванию оксида. Этому же способствует образование SO2 на границе раздела. Эти процессы отражаются на кинетических закономерностях взаимодействия твердых сульфидов с газовой кислородсодержащей фазой в реальных условиях.
В зависимости от температуры, парциального давления кислорода и физико-химических свойств сульфидов и образующихся оксидов процесс может протекать в кинетической, диффузионной или переходной области реагирования. Для кинетической области реагирования, которая характерна для сравнительно невысоких температур и пористых частиц сульфида малой величины, скорость процесса описывается уравнением:
кин Aexp( Ea / RT) pO2 , (12.77)
где Ea – кажущаяся энергия активации; A – предэкспонента, зависящая от состава газовой фазы, величины и состояния поверхности частиц сульфида.
Как следует из уравнения (12.77), при постоянной температуре скорость процесса пропорциональна парциальному давлению кислорода в газовой фазе pO2.
Для кинетической области реагирования скорости процесса сравнительно невелики и на кинетических кривых можно выделить три периода: индукционный, автокаталитический и усредненного фронта. Индукционный период характеризуется малой скоростью, и он связан с трудностями зарождения новой (оксидной) фазы. Период автокатализа характеризуется сильным ростом скорости процесса, что обусловлено каталитическим воздействием реакционной поверхности и соответственно ее расширением. Для периода усредненного фронта отмечается снижение скорости за счет слияния отдельных поверхностей реагирования, а, следовательно, и сужения общей поверхности реагирования.
Следует отметить, что скорость окисления сульфидов в кинетической области реагирования зависит от строения кристаллической решетки и физического состояния поверхности сульфидов. Это, в свою очередь, сказывается на величине кажущейся энергии активации. Так, например, для окисления ZnS величина энергии активации оказалась зависящей от модификации сульфида. Наименьшие значения (~152 кДж/моль при 500–700°C) свойственны аморфному ZnS, большие значения (200 кДж/моль при 650–970°C) ZnS с гексагональной решеткой, а наибольшие (227 кДж/моль при 710–870°C) – природному ZnS (матраиту). Существенное различие значений энергии активации обусловлено особенностями строения кристаллических решеток различных модификаций ZnS, наличием поверхностных и точечных дефектов, различием сил связи между ионами, составляющими решетку, наличием примесей, а также каталитическим воздействием реакционной поверхности. Аморфный сульфид ZnS вследствие высокой дисперсности и разупорядоченности строения имеет большое количество поверхностных и точечных дефектов, что облегчает зарождение новой фазы, т.е. укорачивает индукционный период и ускоряет хемосорбцию кислорода. Это снижает энергию активации процесса. Высокие значения энергии активации, характерные природному ZnS, связаны с затруднениями кристаллохимических превращений, блокированием активных центров примесями, обычно присутствующими в матраите.
Химический режим реагирования также характерен для тех сульфидов, на поверхности которых образуется слой оксида, неплотно прилегающий к сульфиду и имеющий меньший удельный объем. Наличие трещин и отслаивание оксидной пленки в этом случае обеспечивает непрерывный доступ кислорода к реакционной поверхности.
При повышенных температурах вступают в силу диффузионные затруднения, обусловленные в основном наличием оксидного слоя, который оказывает тормозящее воздействие на доставку кислорода к реакционной зоне. Внешняя диффузия, т.е. массоперенос кислорода к поверхности сульфида из ядра газового потока, определяется газодинамическими условиями взаимодействия твердой и газовой фаз.
В простейшем случае при учете только диффузии кислорода через оксидный слой, покрывающий поверхность сульфида, скорость процесса обратно пропорциональна толщине оксидного слоя X (рис. 12.16). В свою очередь, толщина оксидного слоя зависит от величины парциального давления кислорода, коэффициента его диффузии через оксидный слой (D) и реакционной поверхности S:
| X2 2DSp | O | exp( E / RT) . | (12.78) |
Следует, однако, иметь в виду, что скорость процесса в диффузионной области реагирования определяется не только диффузией частиц кислорода, но также зависит от встречной диффузии катионов через оксидный слой, а также от переноса ионов в сульфиде. Поэтому конкретная форма кинетического уравнения окисления сульфидов должна отражать физические свойства образующегося оксидного слоя, природу и физические свойства окисляемого сульфида (плотность, пористость, степень измельчения и др.), характер и скорость газового потока, и содержание в нем кислорода.
Переходная область реагирования отвечает температуре воспламенения сульфидов. Температура воспламенения не является физической константой и зависит от целого ряда факторов: от природы, физических и теплофизических свойств сульфида, размеров его частиц, характера (ламинарный или турбулентный) и состава газового потока, от теплоемкости, теплопроводности и плотности образующейся оксидной пленки и др.
Дата добавления: 2019-09-13; просмотров: 381; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
