ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 10, 24
Кинетический и смешанный режимы. Характерные признаки процесса в кинетической области. Вид типичной кинетической кривой для топохимических реакций, ее анализ.
Кинетический и диффузионный режимы
Если масса перенесенного диффузией компонента будет больше, чем может быть израсходовано в химической реакции, то общая скорость процесса будет определяться кинетикой, т. е. скоростью химической реакции (кинетический режим). Если в химической реакции за единицу времени может быть поглощено больше компонента, чем может его поступить путем диффузии, то общая скорость процесса будет определяться скоростью диффузии (диффузионный режим). Лимитирующим будет самое медленное звено.
Режим одного и того же процесса гетерогенной реакции, например окисления металла кислородом, может меняться в зависимости от температуры.
Энергия активации диффузии Q обычно всегда ниже, чем энергия активации химической реакции А, и при высоких температурах наиболее вероятен диффузионный режим. В самом деле:
A>Q, KT=KQe-AIRT; DT=DQe~Q/RT-,
d(lnKT) _ A d(lnDT) _ Q
dT RT2 dT RT2
Следовательно, константа скорости химической реакции растет с температурой быстрее, чем коэффициент диффузии, и начиная с некоторой температуры скорость диффузии будет лимитировать процесс окисления. При гетерогенной химической реакции продукты могут закрывать поверхность контакта некоторым непрерывным слоем, например, твердого вещества, диффузионные процессы в котором развиваются медленно. В этом случае процесс окисления металла будет протекать в диффузионном режиме.
|
|
|
Характерные признаки процесса в кинетической области
При протекании процессов в кинетической области стадия химической реакции является лимитирующей, и её скорость определяет скорость процесса в целом. Диффузионные торможения в этом случае отсутствуют, и скорость процесса рассчитывают, используя методы истинной или формальной кинетики, по кинетическим уравнениям.
Основные признаки протекания процессов в кинетической области: а) сильная зависимость скорости процесса от температуры, описываемая уравнением Аррениуса. При этом энергия активации, как правило, велика и при уменьшении температуры в большинстве случаев практически не изменяется; б) независимость скорости процесса от линейной скорости газа или жидкости (при сохранении неизменным времени контакта) и интенсивности перемешивания (при проведении процесса в замкнутом объеме), а для высокопористых материалов – от размера частиц.
Вид типичной кинетической кривой для топохимических реакций, ее анализ.
Топохимические реакции – химические реакции, протекающие на поверхности раздела фаз исходного твердого реагента и образующегося твердого продукта. В них могут участвовать и жидкие, и газообразные фазы. Для таких реакций характерно возникновение границы раздела твердых фаз в результате самой реакции. Типичными топохимическими реакциями являются: разложение солей с образованием твердых оксидов, окисление металлов, дегидратация кристаллогидратов.
|
|
|
Основные черты топохимической реакции определяются тем, что реагирующие молекулы, атомы или ионы, образующие кристаллическое вещество, жестко закреплены в кристаллических решетках и лишены той подвижности, которой они обладают в газовой или жидкой фазах. Реакционная способность атомов или ионов в значительной степени зависит от того, в каком месте кристалла они находятся – в объеме, на поверхности грани, на ребре кристалла или на вершине. Кроме того, для топохимической реакции большое значение имеет реальная структура твердого тела, и особенно, наличие дефектов решетки. Очень часто при топохимической реакции продукт реакции сохраняет внешнюю форму кристаллов исходного вещества, вследствие того, что при топохимической реакции возможно лишь минимальное перемещение реагирующих частиц.
|
|
|
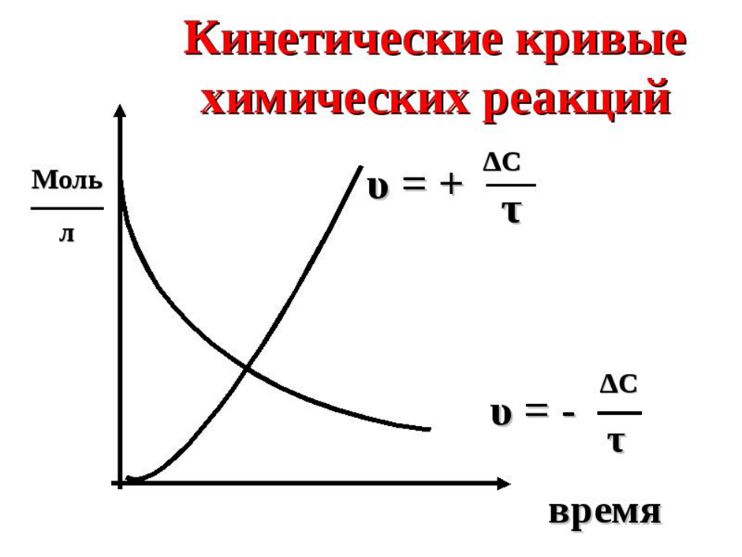
Топохимическая реакция характеризуется специфическими кинетическими закономерностями. Прежде всего, надо отметить своеобразный характер изменения скорости реакции во времени. В начале реакции ее скорость мала (индукционный период), затем скорость возрастает, достигает максимума и снижается либо до нуля, либо до сравнительно малых значений, и слабо зависит от времени. Интегральная кривая, зависимость степени превращения от времени, представляет собой S-образную (сигмоидную) кривую (рис. 1). Скорость реакции находят как тангенс угла наклона касательной к интегральной кривой при заданном времени(d/d), в результате получают дифференциальную кривую топохимической реакции, зависимость скорости реакции от времени (рис. 2). Используют также понятие эмпирической скорости реакции, которая представляет собой максимальную скорость, соответствующую точке перегиба сигмоидной кривой. Отрезок, отсекаемый на оси времени касательной в точке перегиба интегральной кривой называется периодом индукции.
Механизм топохимической реакции включает в себя несколько стадий:
1) образование ядер (зародышей) фазы твердого продукта реакции (период индукции);
|
|
|
2) рост ядер, их перекрывание друг с другом и образование слоя продукта (отрезок после периода индукции до точки перегиба на сигмоидной кривой);
3) увеличение толщины продукта за счет сокращения объема (поверхности) не прореагировавшего вещества (отрезок после точки перегиба).
Реакционная поверхность представляет собой поверхность раздела фаз исходного вещества и продукта и называется реакционной зоной или фронтом реакции, ее толщина составляет одну молекулу.
Таким образом, ходу кривой скорость-время можно дать следующее объяснение. По мере образования новой фазы твердого продукта в реакции появляется поверхность раздела фаз. Размеры ядер растут, повышается и наблюдаемая скорость реакции. Далее растущие ядра фазы нового продукта начинают сливаться, и наблюдаемая скорость реакции проходит через максимум. Продолжающееся слияние отдельных ядер приводит к уменьшению поверхности раздела твердых фаз и скорости реакции. После того, как образуется сплошной слой твердого продукта скорость реакции и по мере уменьшения доли непрреагировавшего вещества реакция прекращается.
Модель массопередачи кислорода из объема газового потока к реакционной поверхности MeS . Особенности кинетики окисления при образовании твердой пленки оксидов металла на поверхности MeS .
Массопередача - массообмен через поверхность раздела или проницаемую стенку между двумя веществами или фазами.
Чем выше парциальное давление кислорода, тем интенсивнее протекает этот процесс, а, следовательно, больше возникает дополнительных вакансий в реакционной зоне. Этот процесс вызывает направленную диффузию в сульфиде; к хемосорбированному кислороду будут перемещаться катионы Me2+ (в рассматриваемом примере Sn2+) и при одновременном потоке электронов. На поверхности сульфида будет происходить накапливание анионов кислорода, что приведет к растворению кислорода в сульфиде (т.е. SnO в SnS), а затем после превышения предельной растворимости кислорода в сульфиде происходит распад твердого раствора с выделением самостоятельной оксидной фазы на реакционной поверхности
Вполне вероятно и взаимодействие сульфида с оксидом с образованием металла
В зависимости от температурных условий и парциального давления кислорода образующийся металл будет накапливаться на реакционной поверхности или переходить в оксид. Более сложный характер процесса будет иметь место при образовании на сульфиде слоя оксида. В этом случае в слое оксида протекают диффузионные явления, характер которых предопределяется наличием дефектов в решетке оксида, т.е. будет ли это оксид, относящийся к n- полупроводникам с избытком катионов или анионными дырками, или кp-полупроводникам с избытком кислорода, т.е. катионными дырками.
Особенности кинетики окисления при образовании твердой пленки оксидов металла на поверхности MeS.
Окисление, как и диссоциация, относится к гетерогенным процессам с участием газообразных и твердых фаз. Продукт реакции — оксид, растворим в металле ограниченно и выделяется в самостоятельную фазу, разделяющую металл и газ. Кислород переносится к поверхности металла диффузией через оксид либо через поры и трещины в нем. Металл также может диффундировать через оксид, и тогда реакция идет и на внешней поверхности оксида. Плотная пленка окалины, защищающая металл, может образовываться, только если металл имеет меньший объем, чем оксид, иначе оксид не покроет всю поверхность и возникновение пор в нем неизбежно. Подвод по ним кислорода осуществляется легко, и такая пленка не защищает металл от окисления (калий, натрий, кальций, барий, магний). К металлам, имеющим сплошную пленку, относятся Fe, Cd, Al, Sb, Sn, Ni, Cr и др. Даже в простейшем случае окисления чистого металла (не сплава) и образования одного оксида процесс окисления является весьма сложным и включает несколько стадий: 1) диффузия кислорода в газе к поверхности оксидной пленки; 2) переход кислорода через межфазную границу газ — оксид (адсорбционно-химический акт); 3) диффузия металла через оксидный слой к поверхности оксид — газ; 4) диффузия кислорода в оксидном слое к поверхности металла; 5) кристаллохимический акт взаимодействия металла с кислородом и образование оксида на внутренней и внешней поверхностях окалины.
При нарастании окалины на плоской поверхности металла, отсутствии диффузионных ограничений и пренебрежении инкубационным периодом образования первого слоя оксида удельная скорость превращения (моль/(м2 • с)) определяется скоростью химических реакций на поверхностях металл — оксид и оксид — газ:
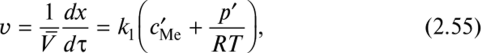
где с^е — равновесная концентрация растворенного в оксиде металла.
Обратной реакцией здесь пренебрегаем, что вполне допустимо для многих металлов при р' » р, т.е. в условиях металлургических процессов, когда давление близко к атмосферному. Интегрируя (2.55), получаем линейную зависимость толщины оксида от времени:
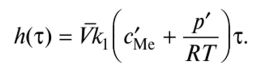
Однако такая зависимость наблюдается только в начале процесса. При образовании заметного слоя оксида процесс начинает лимитироваться доставкой реагентов к поверхностям реакций и переходит из кинетического в смешанный или диффузионный режим.
Если металл образует не один, а несколько оксидов, как, например, железо, то они располагаются слоями: низшие оксиды ближе к металлу, так как концентрация кислорода там меньше, а высшие — ближе к внешней поверхности.
Особенности макромеханизма окислительных процессов с участием кислорода газовой фазы (г.ф.) и шлака, протекающих в сульфидных и оксисульфидных расплавах. Характеристика этапов окисления FeS в штейно-шлаковой эмульсии печи Ванюкова.
Дата добавления: 2019-09-13; просмотров: 434; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
