ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 8, 22
Штейновые расплавы. Структура штейновых расплавов. Физико-химические свойства штейновых расплавов (активность компонентов, плотность и мольные объемы, поверхностное натяжение, электропроводность и полупроводниковые свойства). Теплофизические свойства штейнов.
Условия равновесия реакции восстановления магнетита сульфидом железа в присутствии кремнезема флюса. Особенности образования и разрушения магнетита в печах Ванюкова.
Модель хемсорбции кислорода г.ф. жидким MeS в кинетическом режиме; режиме поверхностной реакции; внутреннем реакционном режиме.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 9, 23
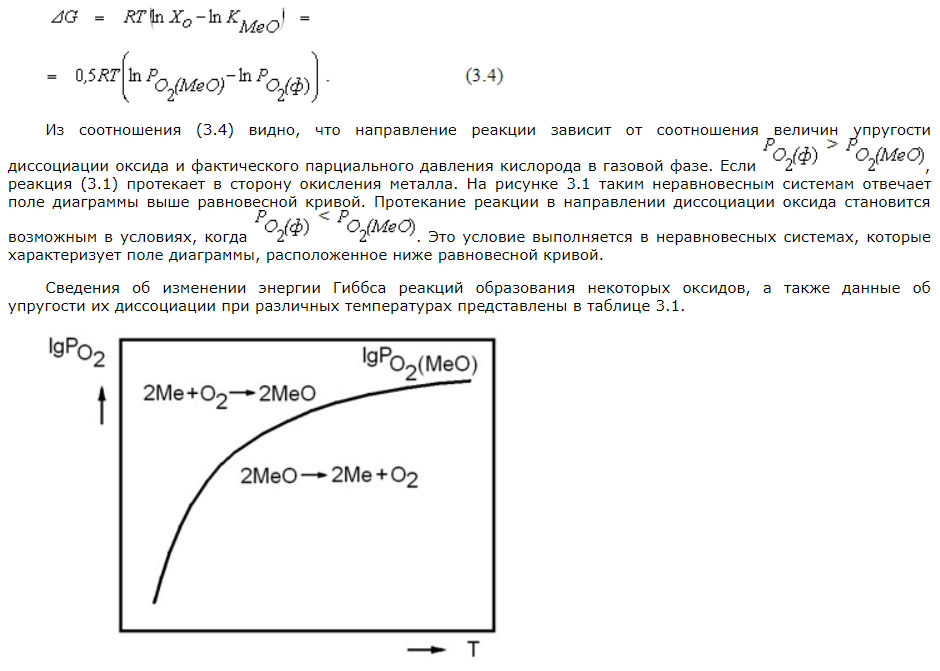
Окисление металлов. Упругость диссоциации оксидов. Термодинамические характеристики оксидов. Диссоциация химического соединения оксида. Распределение кислорода между металлами.

Окисление металлов — Процесс взаимодействия твердого или жидкого металла (сплава) с кислородом, сопровождаемый образованием оксидов.

Анализ причин нахождения цветных металлов в шлаках классических (ОП, ЭП, ШП, конвертирование) и автогенных процессах. Пути снижения потерь цветных металлов со шлаками. Теоретические положения процессов обеднения шлаков.
В традиционных процессах доминируют механические потери. В автогенных наоборот растворённые.
Это объясняется тем, что в барботажных технологиях создаются благоприятные условия для коалесценции (укрупнения мелкодисперсной взвеси капель, что происходит при их столкновении и осуществляется их выпадение в донную штейновую фазу), тем самым изменяется L (распределение) и уменьшается извлечение меди в штейн.
|
|
|
Медь в шлаках определяется полнотой разделения фаз и качеством отстаивания.
При конвертировании также основные потери электрохимические.
Увеличивает общие потери меди со шлаками повышенное содержание магнетита. Механическая форма нахождения меди в шлаках возрастает вследствие повышения плотности и вязкости оксидного расплава, особенно в случае выпадения гетерогенного магнетита, накопленного в шлаках сверх пределов растворимости инаходящегося в твердом состоянии. При этом ухудшаются условия разделения фаз в процесее отстаивания, т.к. растет вязкость шлака. Кроме того, трехвалентное железо уменьшает межфазное натяжение между шлаком и штейном, что также снижает полноту разделения фаз. Электрохимические потери увеличивается за счет увеличения активности FeO и обратимости электрохимической реакции, записанной в молекулярной форме как
(Cu2O)шл+[FeS]шт←[Сu2S]шт+(FeO)шл (3.21)
Поэтому в медеплавильных процесссах необходимо создание условий, препятствующих образованию магнетита или способствующих его разрушению.
|
|
|
Электрохимичесакие потери.
Контакт двух жидких фаз меди (штейна) и шлака при наличии Men+и анионов (О2-, S2-), приводит к образованию на границе раздела двойного электрического слоя. Пока на внешней стороне слоя не накоплен соответствующий по величине заряд, катионы металлов способны преодолевать энергергетический барьер и происходит межфазный переход ионов.
Таким образом, со стороны штейна (металла) на границе раздела фаз адсорбируются положительные катионы [Me]n+, а со стороны шлака - отрицательные анионы (О2-). Учитывая высокое содержание в шлаке оксидов Fe2+ и Fe3+, последние являются основными переносчиками электронов в расплавах Cu-Me-Fe-S-O. В системе «металл-шлак» расстояние между слоями зависит от радиуса катионов. В металле избыточный заряд сосредоточен в слое толщиной около 10-8 cм.
При оценке растворимых потерь меди в рассмотренной выше металлсодержащей системе фиксируют температуру и парциальное давление кислорода. (правило Мостовича В.Я.):
(Cu)шл.=[Cu]шт /100.
При увеличении температуры растворимые потери меди в шлаке несколько возрастают, а при замене в шлаке FeO на CaO уменьшаются.
|
|
|
Механические потери меди со шлаком
1. Низкая концентрация и мелкая вкрапленность оксидных и сульфидных минералов в исходном сырье. Отсутствие оптимальных условий для коалесценции частиц такого рода не позволяет им укрупниться при плавлении, поэтому часть из них остается в шлаке в мелкодисперсном состоянии.
2. Чередование по времени или на разных участках металлургического агрегата процессов окисления или сульфидирования расплавов. Анализируя данный фактор, например, в процессах плавки сульфидных концентратов, заметим, что окислительный потенциал шлака, определяется концентрацией в расплаве свободных анионов кислорода, которая зависит от содержания в шлаке сильных катионов-модификаторов (Fe3+, SiO2). От величины  зависит растворимость меди в шлаках, которая при снижении окислительного потенциала резко уменьшается, что и является непосредственной причиной возникновения взвеси.
зависит растворимость меди в шлаках, которая при снижении окислительного потенциала резко уменьшается, что и является непосредственной причиной возникновения взвеси.
При добавках к шлаку восстановителя содержание в нем магнетита уменьшается, что приводит к снижению растворимости меди и образованию взвеси, которая представлена борнит-халькозиновыми и халькозин-борнитовыми частицами округлой формы размером 0.005-0.04 мм.
|
|
|
При насыщении жидкости кремнеземом взаимная растворимость оксидов и сульфидов заметно снижается, что и приводит к образованию взвеси.
3. Полнота растекания жидких сульфидов по поверхности твердых минералов пустой породы.
При этом происходить капиллярная пропитка пор твердых оксидов сульфидными расплавами, поскольку легкоплавкие сульфидные эвтектики плавятся в первую очередь по сравнению с тугоплавкими оксидами. После полного расплавления шихты сульфидная пленка разрывается и более крупные ее частицы дробяться на мелкие, что приводит к образованию в шлаке сульфидной мелкодисперсной взвеси с каплями различных размеров. Крупные частицы успевают осесть в донную фазу, а мелкие остаются во взвешенном состоянии. Смачивание и полнота пропитки твердого шлака расплавами сульфидов и штейна зависят от состава пустой породы и вида сульфида. Хорошо смачивают оксиды расплавы сульфида железа и свинца. В меньшей степени это относится к жидким штейнам и полусернистой меди.
4. Наличие летучих компонентов, имеющих высокую упругость паров (Zn, Pb, Sb и пр.). В зоне высоких температур происходит возгонка летучих металлов, а на участках печи с более низкой температурой - их конденсация. Данный процесс сопровождается обширным рассеиванием летучих компонентов шихты в атмосфере печи с последующим их оседанием на значительной поверхности ванны расплава.
5. Флотация газовыми пузырьками. Образование газообразных продуктов, в частности SO2, происходит за счет гетерофазных реакций. В этом отношении особое значение имеет взаимодействие магнетита с сульфидами, протекающее на границе раздела штейн-шлак. К пузырькам за счет поверхностных сил прилипают и выносятся на поверхность расплава капли штейна.
Из уравнения (3.22) следует, что скорость расслаивания фаз прямо пропорциональна квадрату размера включений и разности плотностей взвешенных капель и среды и обратно пропорциональна вязкости среды.
3. Анализ потенциальных диаграмм вида  системы Zn - S - O применительно к твердофазным процессам окислительного, сульфатизирующего и окислительно - сульфатизирующего обжига сульфидных концентратов. Фазовые превращения в системе.
системы Zn - S - O применительно к твердофазным процессам окислительного, сульфатизирующего и окислительно - сульфатизирующего обжига сульфидных концентратов. Фазовые превращения в системе.
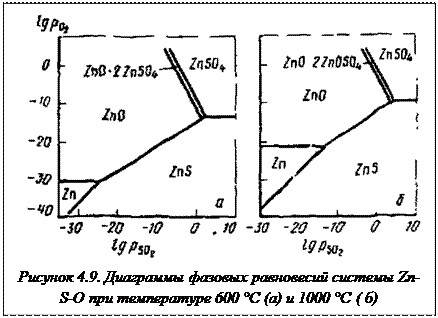
Головной операцией в цинковом производстве является обжиг сульфидных концентратов с переводом сульфида цинка в оксид. Этот этап абсолютно необходим, потому что прямое восстановление по схеме 2ZnS + С = 2Zn + СS2 или путем растворения сульфида цинка в серной кислоте — невозможно.
Термодинамический потенциал этих реакций имеет положительное значение, прямые реакции оказываются неосуществимыми, и поэтому предварительно проводится окислительный обжиг цинковых концентратов. Образованные в ходе окислительного обжига оксиды цинка в дальнейшем легко перерабатываются либо по пирометаллургической схеме (ZnO + CO == Zn + CO2), либо по гидрометаллургической (ZnO + H2SO4 = ZnSO4 + H2O) и далее (после очистки) электролизом.
Как видно из данных рисунке _, поставленная задача перевода ZnS в ZnO достаточно просто решается уже в условиях низких температур. Очевидно, в обоих случаях переработки ZnS на ZnO необходимы высокая температура (950—1050 °C; выше нельзя — возможно сплавление материала) и избыток кислорода в дутье по отношению к стехиометрии реакции ZnS + 3/2 O2 = ZnO + SO2.
Основным способом обжига сульфидных концентратов и для целей химической промышленности, и для решения металлургических задач является процесс окисления сульфидов в потоке воздуха (воздуха, обогащенного кислородом). Основная задача перевести всю серу в SO2, который потом может быть переработан на серную кислоту:
МеS + 3/2 O2 = МеО + SO2
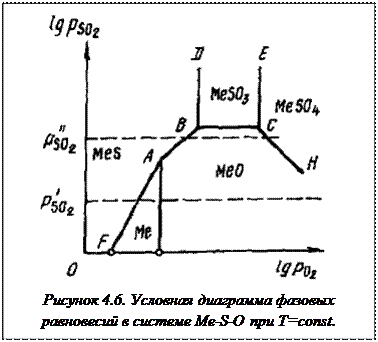
Для двухвалентных металлов основные взаимодействия в системе могут быть описаны как совмещенное равновесие нескольких реакций трехкомпонентной системы. Запишем эти реакции и отвечающие км выражения констант равновесия. Булем считать, что: 1) в системе отсутствуют растворы; 2) оксисульфаты в системе не образуются или по ним нет данных в термодинамических справочниках
При принятых ограничениях весы набор реакций совмещенного равновесия может быть представлен следующим образом:
для линии АF (рисунок 4.6):
MeS +O2 = Ме + SO2; lgKAF = lg(pSO2)-lg(pO2)
для линии АD:
МeО= Ме + 1/2 O2; lgKAD =1/2lg(pO2)
Для линии АВ:
MeS +3/2O2 = МеO + SO2; lgKAB = lg(pSO2)-3/2lg(pO2) ()
Для линии ВС:
МеSO3 = МeО + SO2; lgKBC = lg(pSO2) ()
Для линии СE:
МеSO4= МеSO3 + ½ O2; lgKCE = 1/2lg(pO2) ()
Для линии СH:
МеSO4= МеO +SO2+ ½ O2; lgKCH = lg(pSO2)+1/2lg(pO2) ()
Дата добавления: 2019-09-13; просмотров: 663; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
