Особенности кинетики окисления жидких сульфидов.
Окисление сульфидов кислородом воздуха – необратимая экзотермическая реакция:
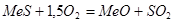
Термодинамически процесс сдвинут в сторону окисления для большинства сульфидов. Однако, при низких температурах реакция окисления не протекает. При нагревании сульфида скорость окисления увеличивается и с достижением определенной температуры скорость реакции становится настолько большой, что выделяющегося тепла достаточно не только для восполнения потерь тепла в окружающую среду, но и для повышения температуры окисляющегося сульфида, что еще больше ускоряет реакцию окисления. Та температура, при достижении которой процесс окисления может протекать самопроизвольно без подвода тепла извне, называется температурой воспламенения сульфида. Эта температура зависит от рода сульфида и размеров его зерен, причем у высших сульфидов с большей упругостью диссоциации она ниже, чем у низших сульфидов с малой упругостью диссоциации.
Скорость окисления сульфида в зависимости от температуры может лимитироваться или кинетическими, или диффузионными факторами. При низких температурах скорость окисления лимитируется кинетическими факторами, т.е. скоростью самого химического акта, при высоких температурах скорость окисления лимитируется диффузией кислорода воздуха через корку твердых продуктов реакции, покрывающую еще неизменившийся сульфид в центральном участке зерна. Реакция течет на границе раздела двух фаз – сульфида металла и твердого продукта реакции – окисла металла, через слой которого внутрь диффундирует кислород, а навстречу ему сернистый газ. По мере окисления сульфида скорость продвижения фронта реакции замедляется, так как условия подвода кислорода и отвода сернистого газа через постепенно утолщающуюся корку окислов ухудшаются. Время, необходимое для полного окисления зерна сульфида, возрастает с увеличением размера зерна.
Повышение температуры сверх определенного предела во многих случаях понижает скорость окисления, если при повышении температуры происходит уплотнение спекания корки окислов, затрудняющее диффузию. При окислении сульфида железа повышение температуры выше 900 ºС замедляет окисление, так как выше 900 ºС происходит значительно уплотнение корки окислов железа.
Термодинамика реакции восстановления магнетита сульфидом железа.
Содержание магнетита в окислительной зоне зависит от соотношения скоростей образования магнетита и его восстановления сульфидами и металлической фазой. Наибольшее влияние на полноту и скорость восстановления магнетита сульфидами оказывает температура, активность FeS в штейне и шлаке, содержания SiO2 в расплаве:
3Fe3O4 + FeS + 5SiO2 = 5FeO•SiO2 + SO2 (25)
Ведение процесса автогенной плавки при более высоких температурах (>1300ОС), повышение активности сернистого железа и содержания SiO2 в шлаке сдвигает равновесие реакции вправо. Из практики известно, что с ростом содержания меди в штейне, а, следовательно, с уменьшение активности сернистого железа растет содержание магнетита в шлаке и потери меди со шлаками.
Для снижения содержания магнетита и потерь меди желательно повышать содержание SiO2 в шлаках до 35-36%.
В автогенных процессах плавки взаимодействие кислорода дутья с шихтой протекает преимущественно либо в газовом пространстве печи, либо в барботируемом расплаве. [6]
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 6, 20
Гетерогенные реакции (г.р.). Определение, классификация. Примеры г. р. в современных технологических процессах цветной металлургии.
Гетерогенные реакции – реакции с участием веществ, находящихся в различных фазах (агрегатных состояниях) и в совокупности составляющих гетерогенную систему. Например, тв.1 + газ1 = тв.2 + газ2.
Примеры в современных технологических процессах цветной металлургии: Окисление сульфидов металлов кислородом воздуха (обжиг сульфидных концентратов в печи КС):
MeS + 1.5O2 = MeO + SO2
Восстановление оксидов металлов углеродом (период восстановления анодной плавки): MeO + CO = Me + CO2
Диффузионный режим и его признаки. Внутренняя и внешняя диффузия. Использование критериев подобия для анализа процессов массопереноса. Примеры критериальных уравнений для различных случаев (обтекание сферы, вынужденная конвекция вокруг сферы, набегание потока на пластину).
Диффузионный режим – режим проведения химической реакции, в которой лимитирующей стадией является массоперенос реагентов.
Внешняя диффузия – подвод реагента к поверхности твердой фазы через слой газа.
Внутренняя диффузия – проникновение газообразного реагента через поры твердого продукта реакции к ядру твердого компонента.
Для анализа кинетических возможностей диффузионных стадий процесса окисления сульфидов при обтекании твердой частицы потоком газа (внешняя диффузия) используют безразмерные критерии подобия и взаимосвязь между ними вида:
Nuд-f (Re, Pr),
где: Nuд - диффузионный критерий Нуссельта, характеризующий массопереда; Re = αl/ѵ – критерий Рейнольдса, определяющий гидродинамические свойства потока; Pr = ѵ/D – критерий Прандтля, характеризующий физико – химические свойства потока.
Для тел с известной геометрической формой (сфера, цилиндр, тонкая пластина) эмпирически определен вид зависимости:
Обтекание сферы: 0,54 Re1/2
Вынужденная конвекция вокруг сферы: 0,6Re1/2Pr1/3+2
Набегание потока на пластину: 0,064Re1/2Pr1/3
Модель массопередачи кислорода из объема газового потока к реакционной поверхности MeS . Особенности кинетики окисления при образовании твердой пленки оксидов металла на поверхности MeS .
Первоначально, когда отсутствует твердый продукт реакции (МеО), основными стадиями являются:
а) массоперенос кислорода из ядра газового потока к внешней поверхности сульфида (внешняя диффузия);
б) адсорбция кислорода на поверхности сульфида;
в) химическое взаимодействие адсорбированного кислорода с сульфидом (хемсорбция), сопровождающееся образованием твердых (оксида или промежуточного соединения типа сульфата) и газообразных продуктов реакции (диоксида серы);
г) десорбция SO2 с реакционной поверхности и переход его в газовую фазу.
По мере протекания окислительного процесса, на реакционной поверхности образуется оксидная фаза MeO и дополнительно появляются стадии: массоперенос кислорода к новой границе раздела MeO-MeS через слой МеО и десорбция SO2 из данной реакционной зоны к наружной поверхности (внутренняя диффузия).
Дата добавления: 2019-09-13; просмотров: 633; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
