ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 3, 16
Модель массопередачи кислорода из объема газового потока к реакционной поверхности MeS . Особенности кинетики окисления при образовании твердой пленки оксидов металла на поверхности MeS .
Модель массопередачи кислорода
Существуют 2 области:
- ядро (существует основной объем газа)
- пограничный сдой поверхности раздела фаз
Перенос компонентов в основном объеме при интенсивном перемешивании обычно происходит за счет конвективной диффузии (движение фаз за счет перемешивания), при этом роль молекулярной диффузии не столь велика (перенос вещества молекулами). По мере приближения к поверхности раздела фаз конвективные потоки затухают и возрастает значение молекулярной диффузии.
В непосредственной близости от границы раздела фаз существует пограничный слой, через который массопередача осуществляется только молекулярной диффузией (образования пограничного слоя объясняется наличием вязкости потока и силами притяжения между молекулами твердых компонентов и окр среды).
Особенности кинетики
По мере протекания окислительного процесса на реакционный поверхности образуется оксидная фаза MeO и появляется дополнительные стадии:
-массопередача кислорода к границе раздела MeO-MeS через слой MeO и десорбция SO2 из данной реакционной зоны к наружной поверхности (внутреняя диффузия)
Характерными признаками гетерогенных процессов, лимитирующих внутренней диффузией является
|
|
|
1. Скорость процесса не зависит от скорости движения газа
2. Скорость зависит от пористости MeO
3. Диффузионное сопротивление растет со временем, т.к толщина слоя MeO по мере протекания реакции окисления увеличивается.
Нестационарная диффузия. Вид уравнения для оценки диффузионного потока и коэффициента массоотдачи. Основные положения адсорбционно-диссоционной теории Маргулиса для процесса окисления сульфидов.
Вид уравнения для оценки диффузионного потока и коэффициента массоотдачи

Коэффициент массоотдачи показывает какая масса в-ва переходит от поверхности раздела фаз в ядро фазы через единицу поверхности в единицу времени, при движущейся силе равной 1.
Основные положение теории Маргулиса
-В результате Хемсорбции кислорода на поверхности сульфида образуется переоксидный комплекс который разлагается с выделением атомарного кислорода. Последний вступает во взаимодействие с соединениями молекулами сульфида, то приводит к образованию местаблильных сорбционных компонентов сульфатного типа с возрастающей насыщенного кислорода по схеме MeSO-MeSO2-MeSO3- MeSO4
- Устойчивые оксисльфидные комплексы образуются в результате сорбции сульфат, а менее устойчивые диссоциируют с выделением SO окисляющегося до SO2
|
|
|
Классификация восстановительных процессов. Особенности термодинамики восстановления оксидов газами. Сопоставимый анализ эффективности восстановления различных оксидов цветных металлов и железа.
Классификация восстановительных процессов.
- Восстановление окисдов нелетучих металлов
- Восстановление оксидов летучих металлов
- восстановление оксидов из расплавов
Восстановление по реакции MeO+C=Me+CO2 называется косвенной
Восстановление по реакции MeO+C=MeO+CO прямым
Особенности термодинамики
Если СО в газовой смеси выше равновесного значения, то будет происходить восстановление оксида
А при концентрации СО ниже равновесного наоборот будет происходить окисление металла с образованием оксида.
Восстановление оксидов металлов газами
Рассмотрим вначале восстановление чистых оксидов на примере реакции косвенного восстановления углеродом
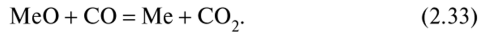
Допустим, что в системе отсутствует твердый углерод, т.е. реакция Белла—Будуара 2СО = Ств + С02 заторможена. Примем также, что конденсированные фазы чистые (яМс = 1; яМс0 = 1). Тогда
|
|
|
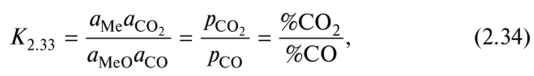
где %С02, %СО — процентные содержания (массовые) С02, СО в газовой атмосфере, состоящей только из этих газов. Число компонентов 4-1 = 3, число фаз 3. Поэтому С=3 + 2- 3 = 2. Следовательно, равновесие в системе можно изменять изменением двух параметров: р и Т. Но, как видно из (2.33), общее давление р не влияет на равновесие, т.е. содержание СО и С02, поскольку реакция протекает без изменения числа молей или объема газа. Уравнение (2.34) также не содержит р. Как принято в таких случаях, правило фаз можно применять в виде С = К + 1 - Ф. Тогда для реакции (2.33) С= 1, т.е. К2.33, или равновесный состав газовой смеси, зависит только от Т. Характер этой зависимости, согласно уравнению Вант-Гоффа (2.7), определяется знаком теплового эффекта реакции (2.33). Ее можно представить в виде разности двух реакций:
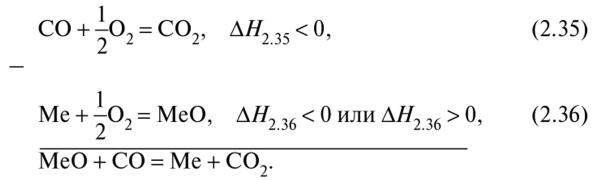
Энтальпия реакции (2.35) (реакции догорания) отрицательна, поэтому знак ∆Н2.33 зависит от знака и абсолютной величины энтальпии реакции окисления металла (2.36), так как ∆Н2.34 = ∆Н2.35 - ∆Н2.36. Если в итоге ∆Н2.33 < 0, то по принципу Ле-Шателье повышение температуры смещает реакцию (2.33) влево, если ∆Н2.33 > О, то, наоборот, с повышением U быстрее идет прямая реакция.
Уравнение изотермы реакции (2.33) имеет вид
|
|
|
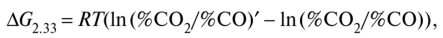
где (%С02/%С0)' — отношение фактического содержания С02 и СО в газовой фазе. Чем более отрицательна эта разность, тем быстрее идет восстановление. На рис. 2.9, который иллюстрирует зависимость равновесного содержания СО от Т, рассчитываемую по уравнениям (2.34) и изобары реакции (см. (2.8)), область 1 — область устойчивого существования металла ((%СО)' > (%СО)), а область 2 — оксида ((%СО)' < (%СО)).
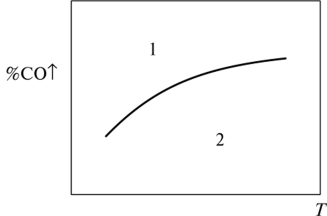
Рис. 2.9
Поскольку 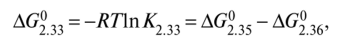
то К2.33 тем меньше, чем больше стандартное сродство металла к кислороду (-∆G^2.36 » 0). Поэтому у трудновосстановимых оксидов (МпО, ТЮ2, А1203, СаО и др.) и линия равновесия расположена высоко. Они устойчивы практически при любых температурах и составах газа. Восстановление газами, в том числе и СО, для них малоэффективно. У легковосстановимых оксидов (Cu20, PbO, Fe203 и др.) кривые равновесия расположены низко (ЛГ233 » 1). Для оксидов FeO, Fe304, W03, Мп304 и др. К2.33 близко к единице, поэтому содержание СО и С02 сопоставимы, т.е. легко создать как восстановительную, так и окислительную атмосферу. Восстановление газами, в том числе карботермическое, широко применяется для многих оксидов второго и третьего типов, например, в металлургии железа, меди, никеля и др.
Реакции восстановления металлов в реальных условиях протекают, когда оксид и металл образуют взаимные растворы или растворяются в других веществах. Поэтому
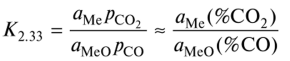
и равновесный состав (К2.33 = const) зависит не только от Т, но и от состава растворов, т.е. от аМе и яМеС). Следовательно, возрастает число степеней свободы системы. Растворение металла, т.е. уменьшение аМс, вызывает убыль %СО, необходимого для восстановления — ускоряется прямая реакция, а уменьшение яМе0, наоборот, приводит к возрастанию %СО.
Сопоставимый анализ эффективности восстановления различных оксидов цветных металлов и железа. (Я НЕ ЗНАЮ КАК ОТВЕТИТЬ НА ЭТОТ ВОПРОС , С……КА!!!!)
Дата добавления: 2019-09-13; просмотров: 428; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
