Формы нахождения цветных металлов в жидких шлаках.
Согласно теоретическим положениям ионной теории, jсновоположником которой является О.А. Есин, компоненты шлакового расплава диссоциированы на ионы. Поэтому закономерности, характерные для растворов электролитов, свойственны и для шлаковых расплавов.
В жидких шлаках присутствуют катионы металлов Ca2+, Mg2+,Fe2+,Zn2+,Al3+,Si4+ и др., а также простейшие анионы S2-, O2-. Структурной единицей шлакового расплава является кремнекислородный комплекс (SiO4)4-, имеющий вид тетраэдра, в центре которого находится ион Si4+, а в вершинах ион О2-. В общем случае ионный шлаковый расплав состоит из одноатомных катионов металлов, анионов кислорода О2- основных оксидов и многоатомных кремнекислородных анионов (SixOу)z- различной степени сложности.
Кислород в шлаковом расплаве присутствует: в виде свободного аниона (О2-); частично связанного (О-) одной валентностью с катионом кремния (Si3+-O-) и находящимся (Оо) внутри кремнекислородного комплекса Si3+-O-Si3+, соединенным с атомами кремния.
При низких концентрациях SiO2 в оксидных системах кремнекислородные тетраэдры разделены катионами. С повышением доли SiO2 тетраэдры объединяются вершинами, образуя цепочки, кольца и более сложные структуры. Размеры комплексных кремнекислородных анионов зависят от отношения числа атомов кислорода к числу атомов кремния в шлаке (О:Si): чем больше отношение, тем меньше размеры кремнекислородных комплексов (табл. 2.17).
|
|
|
Структура анионных комплексов зависит от концентрации в шлаке SiO2 и усложняется с возрастанием его содержания следующим образом:
Содержание SiO 2 в шлаке, %, мас……до 33 33-55 55
Вид комплекса…………………………SiO44- (SiO3)  SixO
SixO 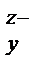
Из четырех валентных электронов атома кремния у катиона Si4+ находятся только два, а остальные два электрона в среднем распределены около четырех ближайших атомов кислорода. Поскольку каждый атом кислорода является вершиной двух тетраэдров, то он ведет себя как однозарядный анион. Таким образом, заряды ионов оказываются меньшими их валентностей.
Существование набора комплексных анионов SiiO 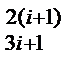 подтверждено экспериментально. Аналогичные комплексы образуют и анионы алюминия (Al3O7)5- , (AlO2)-, однако их влияние на свойства медеплавильных шлаков в связи с более низкой концентрацией алюминия, проявляется в меньшей степени.
подтверждено экспериментально. Аналогичные комплексы образуют и анионы алюминия (Al3O7)5- , (AlO2)-, однако их влияние на свойства медеплавильных шлаков в связи с более низкой концентрацией алюминия, проявляется в меньшей степени.
В силикатных расплавах катионы подразделяют на две группы: модификаторов и комплексообразователей. К первой группе относят катионы щелочных и щелочноземельных металлов, железа, цинка, цветных металлов, марганца и др., связь которых с анионами кислорода носит ионный характер с энергией связи менее 210-250 кДж/моль.
|
|
|
1. Одиночный тетраэдр и цепочки из двух и трех тетраэдров:
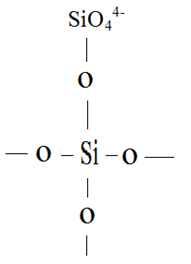
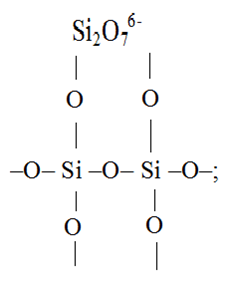
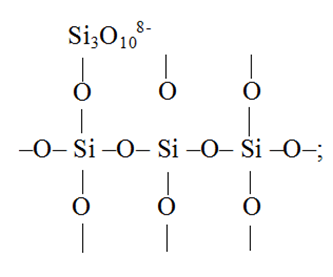
2. Трех- и четырехчленные кольца:

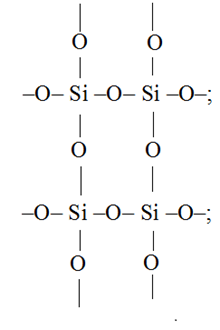
3. Тепловой баланс горения (окисления) одиночной сульфидной частицы. Взаимосвязь скорости окисления сульфидов и условий тепло-массопередачи на контактной поверхности MeS - O 2 . Понятие о температуре воспламенения (ТВ) сульфидов. Факторы, влияющие на ТВ.
Выявление лимитирующей, т.е. самой медленной стадии взаимодействия О2 с МеS имеет существенное прикладное значение т. к. определяет общее направление и пути интенсификации технологий, теоретической основой которых могут являться кинетические закономерности окислительных процессов.
Из основного закона химической кинетики, открытого Бекетовым, Гульдбергом и Вааге следует, что скорость химической реакции пропорциональна произведению концентраций реагирующих веществ:
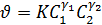 , (2.49)
, (2.49)
где: К-константа скорости реакции; γ1 и γ2-стехиометрические коэффициенты в уравнении реакции. Уравнение 2.49 называется кинетическим уравнением и позволяет сравнить константы скоростей простых реакций, протекающих в одну стадию.
С учетом (2.49) тепловой баланс горения (окисления) одиночной сульфидной частицы, может описываться выражением:
|
|
|
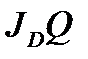 = a (T1- T2)1.25 +b (
= a (T1- T2)1.25 +b ( 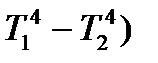 , (2.74)
, (2.74)
где 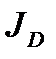 - поток окислителя, равный произведению его концентрации на поверхности (C) и константы скорости реакции (k); a и b - постоянные при слагаемых уравнения (2.50), учитывающие конвективный и лучистый теплообмен.
- поток окислителя, равный произведению его концентрации на поверхности (C) и константы скорости реакции (k); a и b - постоянные при слагаемых уравнения (2.50), учитывающие конвективный и лучистый теплообмен.
Взаимосвязь скорости окисления сульфидов и условий тепло-массопередачи на контактной поверхности MeS-O2.
По мере протекания окислительного процесса, на реакционной поверхности образуется оксидная фаза MeO и дополнительно появляются стадии: массоперенос кислорода к новой границе раздела MeO-MeS через слой МеО и десорбция SO2 из данной реакционной зоны к наружной поверхности (внутренняя диффузия). Уравнение (2.51) применительно к процессам окисления сульфидов показывает взаимосвязь скорости окисления и условий теплоотдачи на контактной поверхности MeS-O2. В дифференциальной форме уравнение конвективной диффузии в движущейся со скоростью ω несжимаемой среды в трехмерном пространстве при постоянном значении коэффициента диффузии D и с одновременно протекающей химической реакцией, имеет вид:
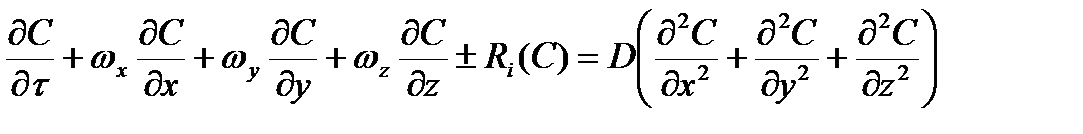 , (2.51)
, (2.51)
где 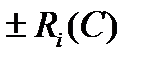 - член уравнения, учитывающий скорость изменения компонента в единице объема среды за счет протекания химической реакции; ωх, ωy, ωz – проекции общего вектора скорости ω на оси X, Y, Z, соответственно.
- член уравнения, учитывающий скорость изменения компонента в единице объема среды за счет протекания химической реакции; ωх, ωy, ωz – проекции общего вектора скорости ω на оси X, Y, Z, соответственно.
|
|
|
Понятие о температуре воспламенения (ТВ) сульфидов. Факторы, влияющие на ТВ.
Температура, при которой соблюдается неравенство (2.21), называется температурой воспламенения сульфидов (ТВ). 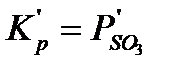 .
.
Величина tнач. определяется необходимой степенью активации сульфида, т.е. кинетическими параметрами реакции. Характеристикой граничного условия перехода из кинетической области в диффузионную является температура воспламенения сульфидов (ТВ ≈ tнач.). Температура воспламенения сульфидов, кроме размера зерна δ, зависит также от особенностей строения сульфида, степени дефектности, теплоемкости, теплопроводности, плотности окисляемого материала и образующихся оксидов. Чем больше дефектность структуры сульфида, тем эффективнее взаимодействие сульфида с кислородом.
Дата добавления: 2019-09-13; просмотров: 376; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
