Характеристика основных кинетических этапов процесса окисления сульфидов кислородсодержащей газовой фазой.
Процесс окисления твердых сульфидов кислородсодержащей газовой фазой в зависимости от времени взаимодействия складывается из различных этапов. Первоначально, когда отсутствует твердый продукт реакции (МеО), основными стадиями являются:
а) массоперенос кислорода из ядра газового потока к внешней поверхности сульфида (внешняя диффузия);
б) адсорбция кислорода на поверхности сульфида;
в) химическое взаимодействие адсорбированного кислорода с сульфидом (хемсорбция), сопровождающееся образованием твердых (оксида или промежуточного соединения типа сульфата) и газообразных продуктов реакции (диоксида серы);
г) десорбция SO2 с реакционной поверхности и переход его в газовую фазу.
По мере протекания окислительного процесса, на реакционной поверхности образуется оксидная фаза MeO и дополнительно появляются стадии: массоперенос кислорода к новой границе раздела MeO-MeS через слой МеО и десорбция SO2 из данной реакционной зоны к наружной поверхности (внутренняя диффузия).
Характерными признаками гетерогенных процессов, лимитируемых внутренней диффузией являются.
1. Скорость процесса не зависит от скорости движения газа;
2. Скорость зависит от пористости МеО:
3. Диффузионнное сопротивление растет со временем, т.к. толщина слоя МеО по мере протекания реакции окисления увеличивается.
Процесс взаимодействия твердых сульфидов с кислородом газовой фазы в основном состоит из явлений диффузии, хемсорбции и кристаллохимических превращений.
|
|
|
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 15, 2
Уравнение конвективной диффузии при набегании газового потока на твердое тело, сопровождаемое химической реакцией на его поверхности. Иллюстрация его применения для движения потока флюидной фазы в одном направлении (система «тв-газ») применительно к технологии обжига в КС и ПВС.
В дифференциальной форме уравнение конвективной диффузии в движущейся со скоростью ω несжимаемой среды в трехмерном пространстве при постоянном значении коэффициента диффузии D и с одновременно протекающей химической реакцией, имеет вид:
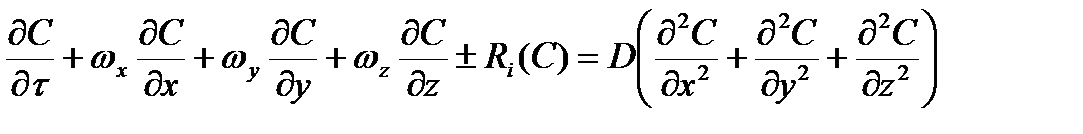 , (2.51)
, (2.51)
где Ri(C) - член уравнения, учитывающий скорость изменения компонента в единице объема среды за счет протекания химической реакции; ωх, ωy, ωz –проекции общего вектора скорости ω на оси X, Y, Z, соответственно.
Ограничимся анализом диффузии в одном направлении (например, по оси X) перпендикулярном движению среды (вдоль оси Y), тогда уравнение конвективной диффузии принимает вид:
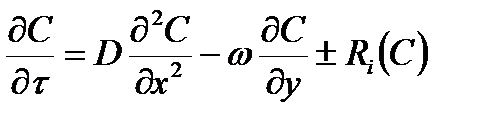 (2.55)
(2.55)
Полагая процесс, стационарным 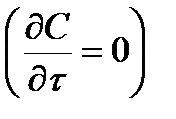 и пренебрегая конвективным членом
и пренебрегая конвективным членом 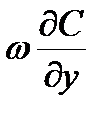 , получим в дифференциальной форме уравнение молекулярной диффузии:
, получим в дифференциальной форме уравнение молекулярной диффузии:
|
|
|
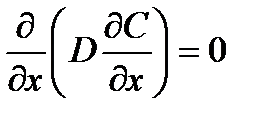 (2.56)
(2.56)
После двойного интегрирования уравнения 2.56 при граничных условиях x=0 и С=Сп; x=δ и С=Со на внешней поверхности слоя толщиной δ, выражение (2.56) в интегральной форме приобретает вид первого закона Фика:
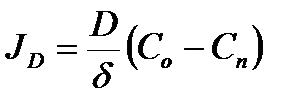
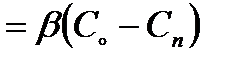 , (2.57)
, (2.57)
где 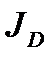 - поток реагента (в нашем случае кислорода) из объема газовой фазы с концентрацией Со через единицу поверхности в единицу времени, на которой устанавливается значение концентрации Сп; D - коэффициент диффузии кислорода в газе; δ – толщина пограничного слоя и β – коэффициент массоотдачи в пределах одной фазы, D/δ, имеющий гидродинамическую природу и связан со скоростью конвективного движения в объеме фазы.
- поток реагента (в нашем случае кислорода) из объема газовой фазы с концентрацией Со через единицу поверхности в единицу времени, на которой устанавливается значение концентрации Сп; D - коэффициент диффузии кислорода в газе; δ – толщина пограничного слоя и β – коэффициент массоотдачи в пределах одной фазы, D/δ, имеющий гидродинамическую природу и связан со скоростью конвективного движения в объеме фазы.
2. Элементы современной теории массопередачи. Понятия диффузионного и гидродинамического слоев. Количественная оценка величин  и
и 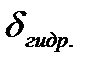 .
.
В соответствии с современными представлениями о механизме массопередачи реагента из объема газовой фазы к реакционной поверхности в режиме внешней диффузии различают две области: ядро (существует основной объем газа) и пограничный слой у поверхности раздела фаз. Перенос компонентов в основном объеме при интенсивном перемешивании обычно происходит за счет конвективной диффузии при этом роль молекулярной диффузии в этом случае не столь велика. По мере приближения к поверхности раздела фаз конвективные потоки затухают и возрастает значение молекулярной диффузии. В непосредственной близости от границы раздела фаз существует пограничный слой, через который массоперенос осуществляется только молекулярной диффузией.
|
|
|
Пограничный слой – область течения вязкой жидкости (газа) с малой по сравнению с продольными размерами поперечной толщиной, появляющаяся у поверхности обтекаемого твердого тела или у границы раздела двух потоков жидкости с различными скоростями, температурами или химическим составом. Возникновение пограничного слоя связано с явлением переноса в жидкости количества движения, теплоты и массы, характеризуемых коэффициентом вязкости, теплопроводности и диффузии. Образование и развитие пограничного слоя можно проследить на примере гидродинамического (скоростного) пограничного слоя у поверхности тела, обтекаемого потоком жидкости или газа. Вследствие вязкости жидкости она «прилипает» к поверхности тела, т.е. на стекле продольная составляющая скорости жидкости равна нулю (если поверхность тела непроницаемая, то здесь равна нулю и поперечная составляющая скорости). Разрыв продольной составляющей скорости в вязкой жидкости существовать не может, поэтому возникает переходная область течения, т.е. пограничный слой, в котором происходит плавное изменение скорости от нуля на стенке до некоторого конечного значения во внешнем потоке, где влияние вязкости исчезает. Толщина такой переходной области и профиль скоростей в ней определяются уравнениями сохранения количества движения. Помимо гидродинамического пограничного слоя при обтекании тела можно выделить также концентрационный (диффузионный) пограничный слой, образующийся при протекании на стенке химической реакции или же при вдуве инородного газа через проницаемую поверхность тела.
|
|
|
Вследствие влияния сил трения в непосредственной близости от поверхности тела скорость течения должна очень быстро падать до нуля. Тонкий слой газа вблизи поверхности тела, в котором происходит изменение скорости газа от значения скорости невозмущенного потока вдали от стенки до нуля непосредственно на стенке, называется гидродинамическим пограничным слоем. (Коротко, вблизи поверхности частицы образуется малоподвижный слой газа, который называется гидродинамическим неподвижным слоем).
Гидродинамический слой толщиной δг, где скорость изменяется от ωо - скорости движения в ядре потока до 0.01 ωо – скорости на поверхности твердого тела. Толщина δг связана со скоростью ωо соотношением:
δг = 1,73* 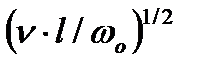 , (2.59)
, (2.59)
где ν - коэффициент кинематической вязкости; l - расстояние от точки набегания потока на твердую поверхность до заданной точки в направлении движения потока; ωо - скорость в ядре потока.
Характеристический размер (l) зависит от геометрической формы твердого тела и, например, для пластины представляет ее длину, для сферы или цилиндра – диаметр.
Для газовой фазы, в которой величины кинематической вязкости и диффузии одного порядка, чем меньше размеры частицы, тем больше толщина пограничного слоя.
Диффузионный слой – приповерхностные объемы материала, химический состав которых изменился в результате диффузии при химико-термической обработке (ХТО). Изменение химического состава этих объемов приводит к изменению фазового состава, структуры и свойств материала диффузионного слоя.
С повышением скорости потока толщина пограничного δд уменьшается по закону:
δд ~ 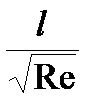
3. Тепловой баланс горения (окисления) одиночной сульфидной частицы. Взаимосвязь скорости окисления сульфидов и условий тепло-массопередачи на контактной поверхности MeS - O 2 . Понятие о температуре воспламенения (ТВ) сульфидов. Факторы, влияющие на ТВ.
Выявление лимитирующей, т.е. самой медленной стадии взаимодействия О2 с МеS имеет существенное прикладное значение т. к. определяет общее направление и пути интенсификации технологий, теоретической основой которых могут являться кинетические закономерности окислительных процессов.
Из основного закона химической кинетики, открытого Бекетовым, Гульдбергом и Вааге следует, что скорость химической реакции пропорциональна произведению концентраций реагирующих веществ:
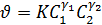 , (2.49)
, (2.49)
где: К-константа скорости реакции; γ1 и γ2-стехиометрические коэффициенты в уравнении реакции. Уравнение 2.49 называется кинетическим уравнением и позволяет сравнить константы скоростей простых реакций, протекающих в одну стадию.
С учетом (2.49) тепловой баланс горения (окисления) одиночной сульфидной частицы, может описываться выражением:
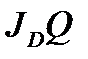 = a (T1- T2)1.25 +b (
= a (T1- T2)1.25 +b ( 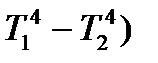 , (2.74)
, (2.74)
где 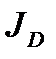 - поток окислителя, равный произведению его концентрации на поверхности (C) и константы скорости реакции (k); a и b - постоянные при слагаемых уравнения (2.50), учитывающие конвективный и лучистый теплообмен.
- поток окислителя, равный произведению его концентрации на поверхности (C) и константы скорости реакции (k); a и b - постоянные при слагаемых уравнения (2.50), учитывающие конвективный и лучистый теплообмен.
Взаимосвязь скорости окисления сульфидов и условий тепло-массопередачи на контактной поверхности MeS-O2.
По мере протекания окислительного процесса, на реакционной поверхности образуется оксидная фаза MeO и дополнительно появляются стадии: массоперенос кислорода к новой границе раздела MeO-MeS через слой МеО и десорбция SO2 из данной реакционной зоны к наружной поверхности (внутренняя диффузия). Уравнение (2.51) применительно к процессам окисления сульфидов показывает взаимосвязь скорости окисления и условий теплоотдачи на контактной поверхности MeS-O2. В дифференциальной форме уравнение конвективной диффузии в движущейся со скоростью ω несжимаемой среды в трехмерном пространстве при постоянном значении коэффициента диффузии D и с одновременно протекающей химической реакцией, имеет вид:
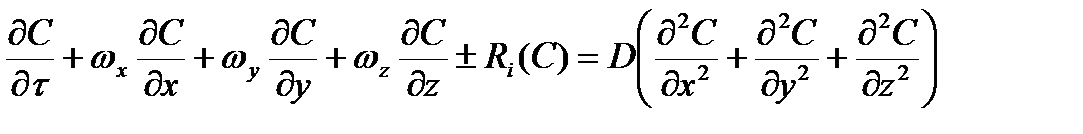 , (2.51)
, (2.51)
где 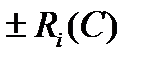 - член уравнения, учитывающий скорость изменения компонента в единице объема среды за счет протекания химической реакции; ωх, ωy, ωz – проекции общего вектора скорости ω на оси X, Y, Z, соответственно.
- член уравнения, учитывающий скорость изменения компонента в единице объема среды за счет протекания химической реакции; ωх, ωy, ωz – проекции общего вектора скорости ω на оси X, Y, Z, соответственно.
Понятие о температуре воспламенения (ТВ) сульфидов. Факторы, влияющие на ТВ.
Температура, при которой соблюдается неравенство (2.21), называется температурой воспламенения сульфидов (ТВ).  .
.
Величина tнач. определяется необходимой степенью активации сульфида, т.е. кинетическими параметрами реакции. Характеристикой граничного условия перехода из кинетической области в диффузионную является температура воспламенения сульфидов (ТВ ≈ tнач.). Температура воспламенения сульфидов, кроме размера зерна δ, зависит также от особенностей строения сульфида, степени дефектности, теплоемкости, теплопроводности, плотности окисляемого материала и образующихся оксидов. Чем больше дефектность структуры сульфида, тем эффективнее взаимодействие сульфида с кислородом.
Дата добавления: 2019-09-13; просмотров: 417; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
