Строение многоэлектронных атомов
Теорию строения многоэлектронных атомов разработал А. Зоммерфельд. Состояние электрона в многоэлектронном атоме характеризуют четыре квантовых числа.
1. Главное квантовое число (n) определяет энергию электрона в атоме и энергетический уровень
n = 1, 2, 3,…
2. Орбитальное квантовое число ( 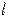 ) характеризует орбитальный момент импульса электрона
) характеризует орбитальный момент импульса электрона
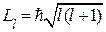 ,
,
где 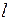 = 0, 1, 2,…(n - 1).
= 0, 1, 2,…(n - 1).
3. Магнитное квантовое число ( 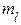 ) определяет проекцию орбитального момента импульса электрона на направление внешнего магнитного поля
) определяет проекцию орбитального момента импульса электрона на направление внешнего магнитного поля
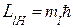 ,
,
где 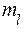 = 0, ±1, ±2,… ±
= 0, ±1, ±2,… ± 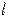 , т.е. всего 2
, т.е. всего 2 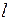 + 1 значений.
+ 1 значений.
Например, l = 1 соответствуют три значения 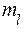 = 0, +1, -1.
= 0, +1, -1.
Для заданного значения n получают n2 состояний:
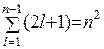 .
.
Для n = 1, l = 0, 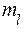 = 0 число состояний равно n2 = 1/
= 0 число состояний равно n2 = 1/
при n = 2, l = 0, 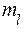 = 0 и для l = 1,
= 0 и для l = 1, 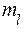 = 0,+1,-1 число состояний n2 = 4.
= 0,+1,-1 число состояний n2 = 4.
Магнитное квантовое число учитывает, что вектор момента импульса в пространстве может иметь 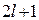 ориентацию. В магнитном поле энергетический уровень расщепляется на
ориентацию. В магнитном поле энергетический уровень расщепляется на 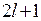 подуровней.
подуровней.
Соответственно каждая спектральная линия атома расщепляется на несколько линий. Расщепление спектральных линий в магнитном поле было открыто в 1896 г. и называется эффектом Зеемана. Позже наблюдали расщепление спектральных линий атома в электрическом поле (эффект Штарка).
4. В 1924 г. О. Штерн и В. Герлах обнаружили дополнительное расщепление спектральных линий в неоднородном магнитном поле.
Это явление называется тонкой структурой спектральных линий. Для объяснения явления американские физики Д. Уленбек и С. Гаудсмит предположили, что электрон имеет собственный момент импульса – спин
|
|
|
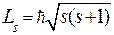 ,
,
где s = 1/2 - спиновое квантовое число.
Магнитное спиновое квантовое число ( 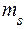 ) характеризует проекцию собственного момента импульса (спина) на направление внешнего магнитного поля
) характеризует проекцию собственного момента импульса (спина) на направление внешнего магнитного поля
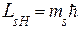 .
.
Магнитное спиновое квантовое число электрона принимает значения 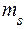 = ±1/2. (Магнитное спиновое квантовое число обычно называют спиновым квантовым числом, принимающим два значения
= ±1/2. (Магнитное спиновое квантовое число обычно называют спиновым квантовым числом, принимающим два значения 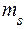 = +1/2 и
= +1/2 и 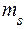 = -1/2).
= -1/2).
Частицы с полуцелым магнитным спиновым квантовым числом называются фермионами.
Для фермионов выполняется принцип В. Паули (1925 г.): в системе одинаковых фермионов любые два из них не могут находиться в одном и том же квантовом состоянии.
По принципу Паули: в атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел n, 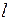 ,
, 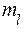 ,
, 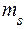 .
.
Количество различных состояний электронов в атоме с учетом спинового квантового числа равно
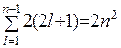 .
.
Периодическая система химических элементов
Электроны атома образуют электронные оболочки вокруг ядра. Состояние электрона в атоме обозначают
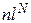 ,
,
здесь n - главное квантовое число определяет номер электронной оболочки, N - число электронов в оболочке. Максимальное число электронов в оболочке равно
|
|
|
N max = 2n2.
Каждой оболочке соответствует символ, обозначаемый заглавной буквой.
| Главное квантовое число | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Символ оболочки | K | L | M | N | O | P | Q |
| Максимальное число электронов в оболочке | 2 | 8 | 18 | 32 | 50 | 72 | 98 |
Оболочки делятся на подоболочки. Подоболочки определяются орбитальным квантовым числом 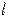 (0, 1,… n-1), которое принимает целые значения от нуля до n-1.
(0, 1,… n-1), которое принимает целые значения от нуля до n-1.
Максимальное число электронов в подоболочке равно
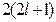 .
.
Подоболочку обозначают строчной буквой.
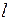
| 0 | 1 | 2 | 3 |
| Обозначение | s | p | d | f |
| Число электронов в подоболочке | 2 | 6 | 10 | 14 |
Рассмотрим распределение электронов в атоме. Порядковый номер атома водорода Z = 1, в ядре находится один протон. Нейтральный атом содержит один электрон N = 1.
Главное квантовое число равно n = 1, т.е. электрон находится в К-оболочке; орбитальное квантовое число 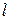 = n - 1 = 1 - 1 = 0, что соответствует s-подоболочке: состояние электрона можно записать с помощью квантовых чисел: 1s1.
= n - 1 = 1 - 1 = 0, что соответствует s-подоболочке: состояние электрона можно записать с помощью квантовых чисел: 1s1.
|
|
|
 Порядковый номер в таблице химических элементов атома гелия равен двум Z = 2, в нейтральном атоме находится два электрона N = 2, для них можно записать
Порядковый номер в таблице химических элементов атома гелия равен двум Z = 2, в нейтральном атоме находится два электрона N = 2, для них можно записать
n = 1, 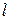 = n - 1 = 1 - 1 = 0: 1s2.
= n - 1 = 1 - 1 = 0: 1s2.
У атома гелия полностью заполнена электронами К-оболочка, поэтому гелий является инертным газом.
У лития Z = 3, поэтому в нейтральном атоме три электрона N = 3. Два электрона находятся в К-оболочке, третий электрон находится в L-оболочке, для него можно записать
n = 2, 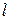 = n - 1 = 2 - 1=1: состояние 2р1.
= n - 1 = 2 - 1=1: состояние 2р1.
Литий легко отдает этот третий электрон и вступает в химические реакции. У атома берилия четыре электрона и полностью заполнено 2s2 состояние. У следующих шести химических элементов от бора до неона последовательно заполняется электронами 2р-подоболочка.
В М-оболочке у восьми химических элементов последовательно заполняются 3s и 3р-подоболочки.
У калия и кальция заполняются не 3d-подоболочки, а 4s, энергия которой меньше, т.е. энергетические уровни находятся ниже уровней, соответствующих 4s1 и 4s2 состояниям.

У следующих элементов скандия, титана и т.д. заполняется электронами 3d-подоболочка.
Физические и химические свойства элементов определяются строением внешних электронных оболочек атомов.
|
|
|
Металлы (Li, Na, K,…) имеют во внешней оболочке один электрон, который атомы легко отдают. Этим определяется большая химическая активность и электропроводимость металлов.
У инертных газов (He, Ne, Ar,…) полностью заполнены электронами оболочки, поэтому эти атомы не взаимодействуют с другими химическими элементами.
Галогены УІІ группы (F, Cl, Br, I, At) содержат 7 электронов во внешней оболочке. Для полного заполнения оболочки необходим один электрон, который атомы забирают у атомов других химических элементов, приобретая валентность -1 (Na+Cl-).
Лантаноиды (от лантана(Z = 57) до лютеция(Z = 71)) помещают в одну
клетку таблицы химических элементов, т.к. их химические свойства одинаковые, потому что внешняя Р-оболочка лантаноидов одинакова. Внешняя 6s-подоболочка лантаноидов заполнена. Эти элементы отличаются заполнением 4f-оболочки.
Аналогично у актиноидов (от актиния(Z = 89) до лоуренсия (Z = 103)) одинакова внешняя Q-оболочка, поэтому их химические свойства одинаковы, и они расположены в одной клетке в таблице Д. Менделеева.
Существуют правила отбора, полученные в результате экспериментальных наблюдений.
Правила отбора разрешают переходы электрона в атоме из одного квантового состояние в другое, если выполняются условия:
- изменение орбитального квантового числа равно
∆ 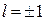 ;
;
- изменение магнитного квантового числа равно
∆ 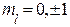 .
.
Остальные переходы электронов в атоме не наблюдаются.
Лекция 20

Дата добавления: 2019-09-13; просмотров: 230; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
