СХЕМА СТРОЕНИЯ ТАБЛЕТКИ ОСМОТИЧЕСКОГО ТИПА
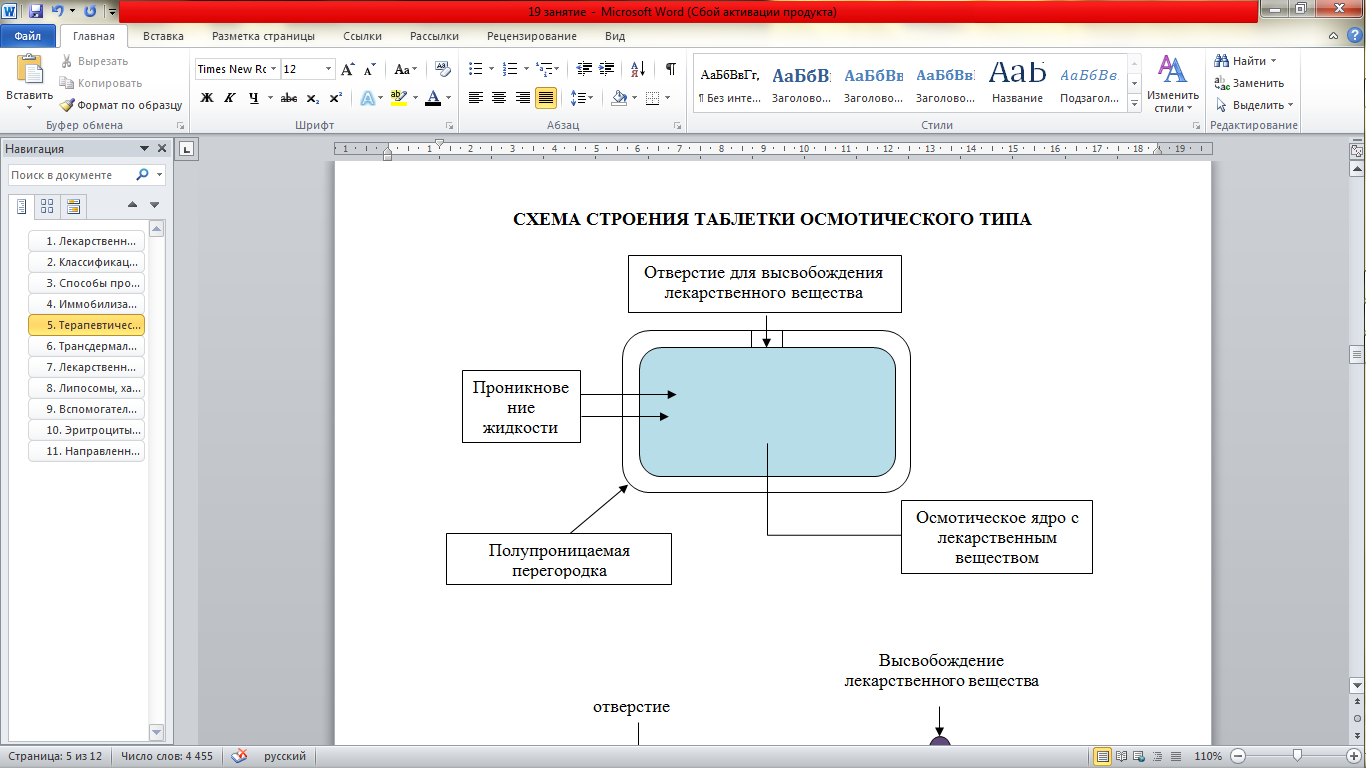

Преимущества данной ЛФ: введение действующих веществ не зависит от pH и от возможности точного расчета высвобождения. Пока в системе находится лекарственное средство в нерастворимой форме, высвобождение идет с постоянной скоростью.
Известны системы, предназначенные для трудно растворимых к воде ЛС, называемые «Пушпульный Орос». Терапевтические системы имеют две камеры. Одна из камер с отверстием содержит суспензию ЛС. Вторая - отделена от первой эластичной оболочкой и заполнена осмотически активным компонентом (NaCl).
Трансдермальные терапевтические системы (ТТС). Классификация ТТС по технологическому и фармакокинетическому принципу.
Трансдермальные терапевтические системы - это дозированная лекарственная форма, представляющая собой небольшого размера круглую пленку диаметром 1,8 см и площадью 2,5 см2. Приклеивается она, как правило, за ухом.
· Покрывающая мембрана;
· Резервуар лекарственного средства;
· Полимерная мембрана, контролирующая скорость высвобождения ЛC;
· Контактный адгезивный слой (липкий);
· Предохранительная пленка.
Трансдермальная терапевтическая система
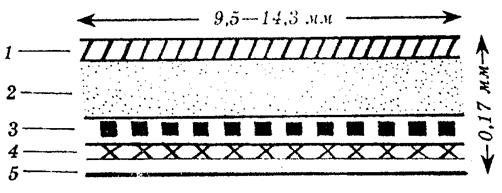
1 – покрывающая мембрана, 2 – резервуар лекарства, 3 – полимерная мембрана, контролирующая скорость высвобождения лекарственного вещества, 4 – контрольный адгезивный слой, 5 – предохранительная пленка
Виды ТТС
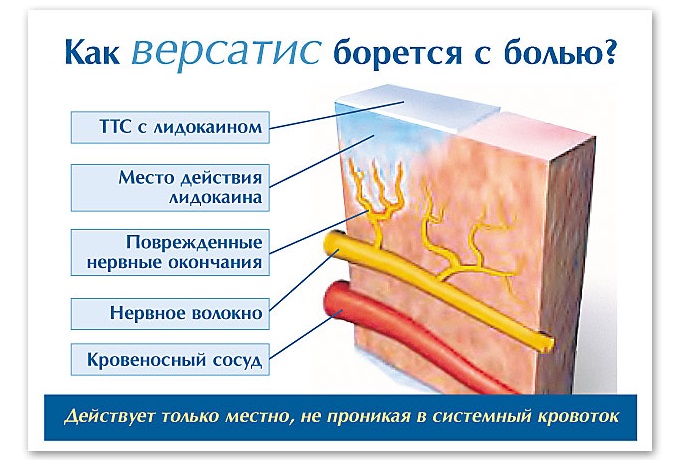
Действие ТТС с 5% лидокаином при постгерпетической невралгии
|
|
|
Классификация ТТС по технологическому принципу:
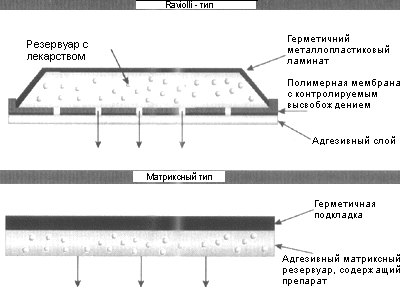
· Системы резервуарного типа, например «Катапресс» с клонидином: «Эстрадерм» - с эстрадиолом: «Трансдерм-Нитро» с нитроглицерином; «Трансдерм-Скоп» - скопаламин.
· Системы дисперсного типа с адгезионным полимером - «Дипонит»; «Минитран» и «Нитро- Дур» с нитроглицерином; «Франдол» - с изосорбидом динитратом.
· Системы дисперсного типа с неадгезионным полимером – «Нитро-Дур» и ТТС с нитроглицерином
· Системы микрорезервуарного типа – «Нитродиск» - с нитроглицерином и ТТС контрацептивная с прогестином и эстрогеном.
Классификация ТТС по фармакокинетическому принципу:
· системы с контролируемым проникновением через полимерную мембрану;
· системы с контролируемой диффузией из полимерной матрицы;
· системы с контролируемым градиентом лекарственного средства в резервуаре;
· системы с контролируемой дробностью микрорезервуаров (гибрид резервуарной и матричной систем, в котором резервуар для ЛС представляет собой гомогенную дисперсию нескольких тысяч суспендированных микрочастиц ЛС- с контролируемым растворением в воде, т.е. по существу - дисперсию микрорезервуаров в липофильном полимере. Направления в исследованиях ТТС:
|
|
|
Направлении и исследованиях по разработке ТТС:
· поиск новых полимерных материалов;
· расширение номенклатуры растворителей;
· расширение ассортимента лекарственных средств.
Характеристика ТТС
Лекарственные средства, вводимые в организм с помощью ТТС, должны:
· Обладать достаточной проницаемостью через кожу, чтобы достигать кровотока в необходимых количествах;
· Быть высокоэффективными, т.е. в малых дозах оказывать терапевтическое действие;
· Обладать хорошей толерантностью к коже;
· Быть пригодными для профилактического, длительного применения или для заместительной терапии.
В качестве подложки, на которой крепится вся трансдермальная терапевтическая система, используя ткани, бумагу, полимерные пленки, металлизированные покрытия, т.е. вещества, непроницаемые для лекарственных веществ и воды:
Резервуар - слои, в котором находится действующее вещество, состоит из носителя, в качестве которого используют различные полимерные материалы.
Самый простой пример - перцовый пластырь. В качестве резервуара используется каучук, регулирующий скорость высвобождения капсаицина. Действие обеспечивается в течение двух суток.
|
|
|
Применяется ТТС со скополамином «Скоподерм ТТС», используемый при заболеваниях органов движения. Система напоминает лейкопластырь толщиной 150 мкм и площадью от 1 до 10 см2 (действие в течение 3 дней).
На высвобождение ЛС здесь влияют такие факторы:
- природа вспомогательных веществ;
- соотношение количества полимера и ЛС;
- форма матричной таблетки;
- наличие оболочки.
Лекарственные средства направленного действия. Модель Рингсдорфа и ее компоненты: полимерный носитель, солюбилизатор, лекарственное средство, вектор (нацеливающее устройство). Современная номенклатура систем доставки: антитела моноклональные, гликопротеиды, эритроциты.
Системы доставки (системы направленной доставки) – ЛФ, доставляющие ЛС в пораженный участок организма человека к органу, ткани, клетки – мишени в точно регулируемых количествах.
В системах доставки ЛС находится во взаимодействии с другим веществом, либо с устройством для введения ЛС, либо с процессом введения ЛС. Цель взаимодействия заключается в контроле за скоростью высвобождения, или за доставкой ЛС к мишени, или и то и другое.
Лекарственные средства третьего поколения по модели Рингсдорфа состоят из четырех частей: полимерной основы (носителя) — 1, солюбилизатора — 2, лекарственного вещества — 3, и вектора — 4. В качестве носителей обычно используют биодеградируемые полимеры: нейтральные, склонные к комплексообразованию, полимерные N-оксиды и полиэлектролиты. Солюбилизатор обеспечивает растворимость системы в воде и липидах и может находиться в самом полимере или присоединяется химическим путем. Лекарственное вещество непосредственно связывается с полимером ковалентной связью или через вставку (бифункциональный реагент). Соединенный с полимером вектор предназначен для узнавания клеток-мишеней и присоединения к ним. Наиболее известным вектором являются моноклональные антитела, которые связываются с антигеном на клеточном уровне. Всасывание системы осуществляется только эндоцитозом.
|
|
|
При направленной доставке ЛС не только достигает заданного участка организма, но и концентрируется в нем. Вследствие избирательного накопления в патологическом очаге повышается эффективность ЛС, снижается его расход, устраняется возможное нежелательное действие ЛС на здоровые органы и ткани.
При создании систем доставки используют следующие подходы:
1. Химический (биохимический)
2. Введение ЛС непосредственно в больной орган или ткань
3. Физиологический
4. Использование различных конъюгатов ЛС
5. Применение внешних воздействий на ЛФ после ее введения.
В основе химического подхода лежит возможность модифицировать молекулу ЛС с образованием его предшественника (пролекарство), который в организме превращается в активное вещество. Непосредственное введение в заданный участок – один из наиболее простых способов направленной доставки ЛС (ТТС, аэрозоли ингаляционные, микросферы для инъекций).
При физиологическом подходе используется возможность достижения избирательного введения ЛВ за счет варьирования размеров их носителей. Так, при внутреннем введении коллоидных носителей (например, липосом, наночастиц) можно подобрать размер частиц таким образом, что более 90 % введенного ЛВ попадает в легкие или печень.
При четвертом подходе используют системы медиаторов различных рецепторов организма. Существующие на клеточном уровне специфические процессы (например, процесс взаимодействия антитело – антиген) можно использовать для присоединения ЛВ к соответствующим лигандам, а затем присоединять их к растворимым макромолекулам и коллоидным частицам – носителям ЛВ.
Пятый подход основан на использовании внешних воздействий, обеспечивающих избирательное поглощение носителя тканью или высвобождения ЛВ из носителя в заданной области (воздействия повышенных температур, света, магнитного поля, электромагнитного излучения). Например, местная гипертермия позволяет ускорить высвобождение противоопухолевого средства, введенного в липосомы.
С учетом размеров систем, механизм действия и уровни доставки различают системы доставки 1-го, 2-го,3-го и др. поколений. Современная номенклатура систем доставки включает антитела, гликопротеиды, ЛФ магнитные, липосомы, микрокапсулы, микросферы, нанокапсулы, ТС и др.
Антитела моноклональные – антитела, используемые в качестве систем доставки ЛС. Представляют перспективу для разработки более совершенных форм лекарственных и диагностических средств.
Гликопротеиды – комплексы полисахаридов и белков с ковалентной углевод-пептидной связью, используемые в качестве систем доставки ЛВ. Углеводная часть придает белку большую специфичность. Это своего рода векторные группы протеидов, «узнающие» участки других структур (макромолекулы, поверхности клеток). Взаимодействующие с гликопротеидами рецепторы локализуются в гепатоцитах, ретикулоцитах, макрофагах, щитовидной железе, лейкоцитах.
Липосомы, характеристика, классификация. Однослойные и многослойные липосомы. Липосомы термочувствительные и рН-чувствительные. Вспомогательные вещества для получения липосом. Природные фосфолипиды.
Липосомы – системы доставки, представляющие собой сферические мембранные пузырьки размером менее 1 мкм, сформированные из бимолекулярных, чаще всего фосфолипидных слоев и нагруженные молекулами гидрофильного или липофильного ЛВ для доставки его к органу-мишени. Благодаря особенностям структуры липосомы могут использоваться для доставки как гидрофильных (заключенные в водное пространство липосомы), так и гидрофобных (заключенных в липидные бислои) ЛВ. Защитная оболочка липосомы напоминает клеточную мембрану, а весь пузырек в целом похож на клеточную органеллу. Липосомы могут проникать в живые клетки, поэтому они используются для введения относительно токсичных ЛВ в пораженные болезнью участки организма, где оказывают максимальное лечебное воздействие. В зависимости от размеров, физико-химических свойств и липидного состава варьируются фармакокинетические параметры липосом: клиренс ЛВ из места инъекции и плазмы крови; доставка к органу-мишени; распределение в органах и тканях.
По размеру различают:
Большие многослойные липосомы, БМЛ - 0,1-3 мкм,
Большие однослойные липосомы, БОЛ — 0,2-3 мкм,
Малые однослойные липосомы, МОЛ - 0,02-0,05 мкм.
Направленный транспорт липосом может осуществляться путем изменения pH или температуры органов-мишеней. При воспалении температура мишени может повышаться до 41°С. Это приводит к быстрому вытеканию содержимого липосом, полученных из дипальмитоилфосфатидилхолина. Зону мишени можно разогреть с помощью микроволнового излучения.
Ацидоз характерен для зон воспаления и ряда опухолей. pH снижается с 7,4 до 6,0. Липосомы, содержащие pH-чувствительные оболочки из пальмитоилгомоцистеина или олеиновой кислоты с фосфатидилдиэтилэтаноламином, быстро освобождают лекарственные вещества.
Строение липосом весьма близко к строению биомембран. Они представляют собой замкнутые сферические структуры с жидким содержимым, ограниченным одним или несколькими липидными бислоями. Липосомы могут быть получены также из синтетических амфифильных веществ и мембранных экстрактов.
Липосомы из природных фосфолипидов нестабильны и самопроизвольно разрушаются через несколько дней. Стабильные липосомы получают из метилакрилатных, диеновых, диацетиленовых липидов и липидных аналогов при облучении ультразвуком. Происходит полимеризация липидов.
Стабилизация липосом из синтетических липидов может быть достигнута с помощью полимеризации ненасыщенных липидов в плоскости мембраны.
Дата добавления: 2019-07-15; просмотров: 380; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
