Соли, их состав и названия, взаимодействие с металлами, кислотами, щелочами, друг с другом с учётом особенностей реакции окисления – восстановления и ионного обмена.
Соли – это сложные кристалические вещества, в состав которых входят катионы металлов и анионы кислотных остатков. Исключением являются соли амонияNH4Cl. Состав солей определяет их название. Сначало называют кислотный остаток, а затем металл который входит в состав соли NaCl – хлорид натрия MgSO4 – сульфат магния и т.д.
Расплавы и растворы солей диссоциируют на ионы Na2SO4
Na2SO4 = 2Na + SO4
В водных растворах соли реагируют с кислотами с образованием соли и кислоты.
BaCl2 + H2SO4 = BaSO4 + 2HCl
Ba2+ + 2Cl- + 2H+ + SO42- = BaSO4 + 2H+ + 2Cl-
Ba2+ + SO42- = BaSO4
В водных растворах соли реагируют со щелочами с образованием соли и основания, если хотя бы один из продукции нерастворим.
Na2CO3 + Ca(OH)2 = Ca(OH)2 = CaCO3 + 2NaOH
2Na+ + CO32- + Ca2+ + 2OH- = CaCO3 + 2Na+ + 2OH-
CO32- + Ca2+ = CaCO3
В водных растворах соли реагируют между собой с образованием двух солей.
Pb(NO3)2 + K2SO4 = PbSO4 + 2KNO3
Pb2+ + 3NO3- + 2K+SO42- = PbSO4 + 2K+ + 2NO3-
Pb2++SO42- = PbSO4
В водных растворах солей метал, входящий в их состав может замещаться другими, более активными металлами.
Fe + CuCl2 = Cu + FeCl2
Fe0 + Cu2+ + 2Cl- = Cu0 + Fe2+ + 2Cl-
Fe0 + Cu2+ = Cu0 + Fe2+
Средние соли, их состав, названия, химические свойства (взаимодействие с металлами, кислотами, щелочами, друг с другом с учетом особенностей реакций окисления-восстановления и ионного обмена).
Соли — электролиты, в растворах которых есть катионы металлов или ион аммония и анионы кислотных остатков.
1.B водных растворах соли могут реагировать со щелочами. Так, хлористый магний MgCl2 взаимодействует с едким натром, образуя новую соль и новое основание:
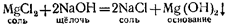
2. Соли могут реагировать с кислотами. Так, раствор азотнокислого бария Ва(гЮз)а взаимодействует с раствором серной кислоты, образуя новую кислоту и новую соль:
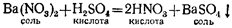
З.В водных растворах соли могут реагировать между собой.
Если слить вместе водные растворы хлористого кальция CaCl2 я углекислого натрия Na2CO3TO тотчас же образуется белый осадок нерастворимого в воде углекислого кальция СаСО3, а в растворе — хлористый натрий:
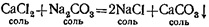
4. В водных растворах солей металл, входящий в их состав, может замещаться другим металлом, стоящим до него в ряду активности.
Если в раствор сернокислой меди опустить чистую железную проволоку или кусочек цинка, то на их поверхности выделяется медь, а в растворе образуется сернокислое железо (если было опущено железо) или сернокислый цинк (если был опущен цинк):
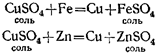
Но из сернокислого цинка нельзя вытеснить цинк медью: медь в ряду активности стоит после цинка.
ВОПРОС №42
Химическая и электрохимическая коррозия металлов. Меры защиты металлов и сплавов от коррозии
Коррозия – это разрушение металлов и сплавов под действием окружающей среды. Различают два вида коррозии – химическую и электрохимическую..
1. Химическая коррозия – это разрушение металла окислителями, находящимися в окружающей среде, в отсутствии электролита. Такая коррозия протекает без возникновения электрического тока в системе.
Химическая коррозия может быть газовой и жидкостной. Газовая коррозия возникает при воздействии на металл агрессивных газов – кислорода, галогенов, оксида серы (IV) и т.д. в условиях высоких температур.
Например: 4Fe + 3O2 = 2Fe2O3 (t0C)
2Cu + O2 = 2CuO (t0C)
2 Fe + 3Cl2 = 2FeCl3
Жидкостная коррозия протекает в среде жидких неэлектролитов: нефти, бензина, керосина и т.д.
Если образующийся на поверхности металла оксид ложится рыхлым слоем
(как у железа или меди), то коррозия продолжается до полного разрушения металла, так как кислород может диффундировать сквозь постепенно утолщающуюся оксидную пленку.
Однако некоторые металлы образуют на своей поверхности оксид в виде очень плотной пленки, предохраняющей металл от дальнейшей коррозии, т.е.
оксидная пленка пассивирует металл. Такие пленки всегда существует на поверхности алюминия, хрома, цинка, никеля и некоторых других металлов. В
этом случае коррозия быстро прекращается и не приносит большого вреда. Например, оксидная пленка алюминия образуется в результате реакции:
4Al + 3O2 = 2Al2O3
2. Электрохимическая коррозия приносит гораздо больший вред. Это разрушение металла при контакте его с электролитами и возникновением в системе электрического тока.
В этом случае наряду с химическим процессом (отдача электролитов) протекает и электрический (процесс переноса электронов от одного участка к другому).
Если коррозия происходит в кислой среде, то металл окисляется катионами водорода.
Например: Fe + 2HCl = FeCl2 + H2↑
Fe0 – 2e → Fe2+
2H++ 2e → H2↑
Таким образом, продукт коррозии железа – бурая ржавчина содержит гидроксид железа (III).
Электрохимическая коррозия может быть усилена, если металл содержит примеси других веществ (металлов и даже неметаллов). Например, железо загрязнено примесями меди. При этом возникает гальванический микроэлемент, который действует следующим образом: железо как более активный металл отдает электроны атому меди (Fe0 – 2e → Fe2+). Эти электроны принимаются катионами водорода и выделяются в виде пузырьков (2H++ 2e → H2↑). Образовавшиеся катионы железа Fe2+ переходят в раствор электролита (в нашем случае – кислота) и соединяются с анионами кислотного остатка. Таким образом, направленный поток электронов все время движется от более активного металла к менее активному, а катионы более активного металла переходят в среду электролита, т.е. возникает электрический ток (направленное движение заряженных частиц), в результате чего более активный металл разрушается, а менее активный не изменяется, он служит лишь проводником электронов.
Для предохранения металлов от коррозии существуют различные способы:
1. Чтобы изолировать металл от окружающей среды, его покрывают защитными покрытиями. Это могут быть как металлические, так и неметаллические покрытия. К неметаллическим покрытиям относятся лаки, краски, смазки, эмали. К металлическим – покрытия более активным металлом (например, оцинкованное железо) или менее активным металлом (хромированные и никелированные стальные изделия). Во всех этих случаях покрытие имеет пассивирующую оксидную пленку. В случае нарушения менее активного покрытия, начинает постепенно корродировать защищаемый металл (например, железо) и тогда надо сразу же возобновлять покрытие.
2. Чтобы сделать металл более устойчивым к коррозии, промышленность выпускает сталь, содержащую до 12% хрома, который создает пассивирующую пленку на поверхности стали. Такая сталь называется нержавеющей. Существуют и другие сплавы с антикоррозионными свойствами.
3. Протекторная защита металла состоит в том, что к поверхности защищаемого металла (например, подводная часть судна) прикрепляют кусок более активного металла (например, цинка) и тогда разрушается протектор (Zn), а не защищаемый металл. По мере разрушения протектора, его заменяют новым.
4. Для замедления коррозии металлических изделий можно также изменить состав среды (электролита) путем введения специальных веществ (чаще всего органических), которые замедляют коррозию. Такие вещества называются ингибиторами. Их обычно используют, когда металл следует защитить от разъедания кислотами, например, при перевозке соляной кислоты в стальной таре.
ВОПРОС №43
Дисперсные системы. Коллоидные растворы
1. Дисперсные системы. Все дисперсные системы состоят из сплошной фазы, называемой дисперсионной средой, и прерывистой фазы (частиц), называемой дисперсной фазой.
От линейных размеров частиц дисперсной фазы зависит гомогенность или гетерогенность дисперсной системы. Гомогенные дисперсные системы называются истинными растворами, или просто растворами. Истинные растворы содержат молекулы или атомы, размеры которых не превышают 5 нм (5˙10-9 м).
Гетерогенные дисперсные системы подразделяют на грубодисперсные системы, у которых частицы имеют размер 1000 нм и более, и коллоидные системы, размер частиц которых лежит в пределах от 1 до 500 нм.
К грубодисперсным системам относятся суспензии, эмульсии, пены. Суспензии представляют собой системы, состоящие из раздробленного твердого вещества и жидкости, в которой распределена дисперсная фаза. Например, крахмал в холодной воде, шоколад (какао в масле), мутная вода. Примеры концентрированных суспензий – пасты, взвесь глины в воде.
Эмульсии – образуются двумя несмешивающимися жидкостями; обычно одной из фаз является вода. Примеры эмульсий: молоко, майонез, маргарин, бензол в воде.
Пены – грубодисперсные системы, состоящие из ячеек, заполненных газом, и отделенных друг от друга пленками очень малой толщины. К пенам относятся: мыльная пена, мусс, пенопласты.
Характерным признаком грубодисперсных систем является то, что частицы дисперсной фазы видны в обычный микроскоп или даже невооруженным глазом.
Частицы в коллоидных системах уже невозможно различить в обычный микроскоп, так как их размеры меньше длины волны видимого света.
Дисперсные системы с частицами коллоидных размеров называют золями. По характеру дисперсионной среды различают: гидрозоли (растворитель – вода), аэрозоли (мельчайшие капельки жидкости, тонкораспыленные в газе, например, туман), мелкие твердые частицы в газе (дым).
Помимо классификации дисперсных систем по размерам частиц, существует и другая классификация – по агрегатному состоянию дисперсной фазы и дисперсионной среды.
2. Коллоидные растворы. Коллоидные растворы отличаются от истинных рядом свойств: 1) малой скоростью перемещения ввиду малой скорости диффузии; 2) повышенной вязкостью; 3) гетерогенностью.
От грубодисперсных систем они отличаются относительной устойчивостью. Для коллоидов характерна очень развитая поверхность, в связи с чем в коллоидных растворах исключительно важную роль играет адсорбция.
Адсорбция – это изменение (обычно – повышение) концентрации вещества вблизи поверхности раздела фаз.
Существует два основных пути получения коллоидных растворов.
1. Дисперсионный – измельчение частиц грубодисперсных систем до размеров, соответствующих коллоидам. При этом используются обычно физические методы с применением различных диспергаторов и коллоидных мельниц.
2. Конденсационный – укрупнение частиц истинных растворов (ионов, молекул) путем их ассоциации до размеров, соответствующих коллоидам. Применяются обычно химические методы: осаждение, гидролиз, окисления-восстановления, нейтрализации.
Например, в результате гидролиза солей железа (III) получают его гидроксид: Fe3+ + 3H2O = Fe(OH)3 + 3H+.
Для повышения устойчивости коллоидов в раствор вводят стабилизаторы – поверхностно-активные вещества (ПАВ).
2.1. Строение и заряд коллоидной частицы. Мицелла.Коллоидная частица состоит из ядра, адсорбирующего из окружающей среды ионы одного вида. Эти ионы называют зарядообразующими, их химическая природа близка химической природе ядра коллоидной частицы.
Ядро коллоидной частицы с адсорбированными зарядообразующими ионами притягивает к себе из среды ионы противоположного знака (заряда). Зарядообразующие ионы и противоионы гидратированы. Весь этот комплекс и называют коллоидной частицей.
3. Свойства коллоидных растворов. Оптические свойства коллоидных растворов. При прохождении через дисперсную систему свет может поглощаться, отражаться или рассеиваться частицами. Поглощение света – явление избирательное. Одни вещества полностью поглощают свет, другие поглощают только лучи определенной части спектра. Отражение света поверхностью частиц возможно только в грубодисперсных системах. Отражение света проявляется в мутности таких дисперсных систем как в проходящем свете, так и при боковом их освещении.
Для типичных коллоидных систем наиболее характерным оптическим свойством является рассеивание света по всем направлениям. Размеры коллоидных частиц меньше длины световой волны, и поэтому рассеивание света обусловлено не отражением его от поверхности частиц, а дифракцией. Рассеивание света при освещении коллоидного раствора было исследовано Тиндалем. Это свечение было названо опалесценцией.
Электрические свойства коллоидных растворов. В 1909 г профессор Московского университета Р. Рейсе наблюдал воздействие постоянного электрического тока на диспергированную в воде глину, и на этом основании описал электрические свойства коллоидных растворов.
Движение частиц дисперсной фазы к одному из электродов при пропускании через него постоянного электрического тока получило название электрофореза, а движение частиц дисперсионной среды – электроосмоса.
Электрические свойства коллоидных растворов объясняют их агрегатную устойчивость, которая проявляется в том, что частицы дисперсной фазы в коллоидном растворе не укрупняются и не слипаются.
Коагуляция коллоидных растворов. Коагуляцией называют процесс соединения коллоидных частиц в крупные агрегаты с последующей потерей коллоидной системой кинетической устойчивости.
Коагуляцию коллоидных растворов можно вызвать нагреванием, охлаждением, интенсивным перемешиванием, а также добавлением различных электролитов.
4. Коллоидные растворы в природе и технике. В природной воде содержится часть примесей в коллоидном состоянии. Поэтому воду, используемую для коммунальных нужд, электростанций, строительства, подвергают обработке, вызывающей коагуляцию коллоидных частиц.
Коагуляцию широко используют при очистке воды для удаления взвешенных веществ. В качестве коагулянтов используют сульфаты алюминия или железа.
Дымовые газы электростанций, металлургических заводов представляют собой аэрозоли. Для их коагуляции применяется электрогазоочистка методом электрофореза при очень высоких напряжениях. В коллоидном состоянии находятся многие составные части живых организмов: кровь, лимфа, внутриклеточная жидкость.
Наибольшее практическое применение имеют твердые системы с газовой дисперсной фазой, называемые твердыми пенами.
ВОПРОС №44
Дата добавления: 2019-07-15; просмотров: 5333; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
