Альдегиды, их строение и свойства. Получение, применение муравьиного и уксусного альдегидов.
Альдегиды – это органические соединения, в состав молекулы которых входит карбонильная группа, соединённая с водородом и углеводородным радикалом.
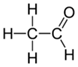 Этаналь
Этаналь
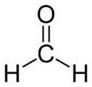 Метаналь (муравьиный альдегид)
Метаналь (муравьиный альдегид)
Физические свойства
Метаналь – газообразное вещество, водный раствор – формалинь
Химические свойства

|
+ H2 = CH3OH
Реактивом на альдегиды является Cu(OH)2
Применение
Наибольшее применение имеют метаналь и этаналь. Большое количество метаналя используется для получения фенолформальдегидной смолы, которую получают при взаимодействии метаналя с фенолом. Эта смола необходима для производства различных пластмасс. Пластмассы изготовлены для из фенолформальдегидной смолы в сочетании с различными наполнителями, называются фенопластами. При растворении фенолформальдегидной смолы в ацетоне или спирту получают различные лаки. При взаимодействии метаналя с карбамидом CO(NH2)2 получают карбидную смолу, а из нее – аминопласты. Из этих пластмасс изготавливают микропористые материалы для нужд электротехники.Метаналь идёт так же на производство некоторых лекарственных веществ и красителей. Широко применяется водный раствор, содержащий в массовых долях 40% метаналя. Он называетсяформалином. Его использование основано на свойстве свёртывать белок.
Получение
Альдегиды получают окислением алканов и спиртов. Этаналь получают гидротациейэтина и окислением этена.
Электрохимический ряд напряжений металлов
Li, K, Ca, Na, Mg, Al, Zn, Cr, Fe, Pb, H2, Cu, Ag, Hg, Au
Чем левее стоит металл в ряду стандартных электродных потенциалов, тем более сильным восстановителем он является, самый сильный восстановитель – металлический литий, золото – самый слабый, и, наоборот, ион золото (III) – самый сильный окислитель, литий (I) – самый слабый.
Каждый металл способен восстанавливать из солей в растворе те металлы, которые стоят в ряду напряжений после него, например, железо может вытеснять медь из растворов ее солей. Однако следует помнить, что металлы щелочных и щелочно-земельных металлов будут взаимодействовать непосредственно с водой.
Металлы, стоящее в ряду напряжений левее водорода, способны вытеснять его из растворов разбавленных кислот, при этом растворяться в них.
Восстановительная активность металла не всегда соответствует его положению в периодической системе, потому что при определении места металла в ряду учитывается не только его способность отдавать электроны, но и энергия, которая затрачивается на разрушение кристаллической решетки металла, а также энергия, затрачиваемая на гидратацию ионов.
Дата добавления: 2019-07-15; просмотров: 4584; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
