Неметаллы, их положение в Периодической системе Д И Менделеева, строение их атомов, окислительно восстановительные свойства не металлов на примере элементов подгруппы кислорода.
Самой первой научной классификацией химических элементов было деление их на металлы и неметаллы. Эта классификация не потеряла своей значимости и в настоящее время.
Из 118 известных на данный момент химических элементов 22 элемента образуют простые вещества, обладающие неметаллическими свойствами.
Неметаллы располагаются в III-VII группах. По физическим свойствам к неметаллам следует отнести также VIIIА группу, или группу благородных газов. Неметаллы образуют p-элементы, а также водород и гелий, являющиеся s-элементами. В длиннопериодной таблице p-элементы, образующие неметаллы, располагаются правее и выше условной границы B—At.
| Группа | I | III | IV | V | VI | VII | VIII |
| 1-й период | H | He | |||||
| 2-й период | B | C | N | O | F | Ne | |
| 3-й период | Si | P | S | Cl | Ar | ||
| 4-й период | As | Se | Br | Kr | |||
| 5-й период | Te | I | Xe | ||||
| 6-й период | At | Rn |
Неметаллы - это химические элементы, для атомов которых характерна способность принимать электроны до завершения внешнего слоя благодаря наличию, как правило, на внешнем электронном слое четырех и более электронов и малому радиусу атомов по сравнению с атомами металлов.
Особенности строения атомов неметаллов.
У большинства атомов неметаллов от четырех до восьми валентных электронов во внешнем слое, но у атома водорода - один, у атома гелия - два, а у атома бора - три валентных электрона, небольшой радиус атома (орбитальный радиус меньше 0,1 нм). Поэтому атомы неметаллов стремятся довести недостающие до 8е. Это свойство атомов характеризуется электроотрицательностью. Для атомов неметаллов характерны высокие значения электроотрицательности. Она изменяется в пределах от 2 до 4.
В соответствии с ним неметаллы образуют особый ряд:
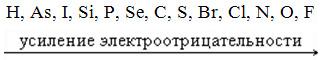
Вида связи, характерные для неметаллов:
· ионная (КСI);
· ковалентная (неполярная − в простых веществах (С12)
· полярная − в соединениях неметаллов (SCl2).
4. Неметаллы − простые вещества. Строение.
В простых веществах атомы неметаллов связаны ковалентной неполярной связью; в благородных газах химических связей нет. Благодаря этому формируется более устойчивая электронная система, чем у изолированных атомов. При этом образуются одинарные (например, в молекулах водорода Н2, галогенов Cl2, Вг2), двойные (например, в молекулах кислорода) тройные (например, в молекулах азота) ковалентные связи.
Перейдем к рассмотрению строения молекул неметаллов. Неметаллы образуют как одноатомные, так и двухатомные молекулы.
К одноатомным неметаллам относятся инертные газы, практически не реагирующие даже с самыми активными веществами. Инертные газы расположены в VIII группе Периодической системы, а химические формулы соответствующих простых веществ следующие: He, Ne, Ar, Kr, Xe и Rn.
Некоторые неметаллы образуют двухатомные молекулы. Это галогены − F2, Cl2, Br2, I2 (элементы VII группы Периодической системы), а также H2, N2, O2. Атомы озона, фосфора, серы — из большего числа атомов (O3, Р4, S8), инертных газов – из одного атома (Не,Ne,Ar,Kr).
Для веществ неметаллов, находящихся в твердом состоянии, составить химическую формулу довольно сложно. Атомы углерода в графите соединены друг с другом различным образом. Выделить отдельную молекулу в приведенных структурах затруднительно. При написании химических формул таких веществ, как и в случае с металлами, вводится допущение, что такие вещества состоят только из атомов. Химические формулы, при этом, записываются без индексов - C, Si, S и т.д.
Самые типичные неметаллы имеют молекулярное строение, а менее типичные – немолекулярное. Этим и объясняется отличие их свойств.
1. Молекулярное строение. У этих неметаллов в твердом состоянии молекулярные кристаллические решетки. В этом случае в каждой молекуле атомы соединены достаточно прочно ковалентной связью, а вот отдельные молекулы друг с другом в кристаллах вещества связаны очень слабо. Поэтому при обычных условиях большинство таких веществ представляют собой газы или твердые вещества с низкими температурами плавления и лишь единственный бром (Вг2) является жидкостью. Все эти вещества молекулярного строения, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярвого взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
Молекулярные неметаллы: H2, N2, P4 (белый фосфор), As4, O2, O3, S8, F2, Cl2, I2. К ним же можно отнести и благородные газы (He, Ne, Ar, Kr, Kx, Rn), атомы которых являются как бы "одноатомными молекулами".
2. Атомное строение. У этих неметаллов атомные кристаллические решетки, поэтому они обладают большой твердостью и очень высокими температурами плавления.Эти вещества образованы длинными цепями атомов. Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением ковалентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала.
Немолекулярные неметаллы: B (несколько аллотропных модификаций), C(графит), C(алмаз), Si, Ge, P(красный), P(черный), As, Se, Te. Все они твердые вещества, кремний, германий, селен и некоторые другие обладают полупроводниковыми свойствами.
Причина большого разнообразия физических свойств неметаллов кроется в различном строении кристаллических решёток этих веществ.
Часть неметаллов имеет атомную кристаллическую решетку. Кристаллы таких веществ состоят из атомов, соединённых между собой прочными ковалентными связями. Такие неметаллы находятся в твёрдом агрегатном состоянии и являются нелетучими. Примерами таких веществ служат алмаз, графит, красный фосфор и кремний.
Дата добавления: 2019-07-15; просмотров: 1988; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
