Виды химической связи ионная металлическая ковалентная полярная неполярная простые и краткие связи в органических соединениях
Химическая связь – электрические силы притяжения, которые удерживают частицы друг около друга. В образовании химической связи могут участвовать атомы, ионы или молекулы. Атомы химических элементов, имеющих незавершённый внешний уровень, неустойчивы и стремятся его завершить. В процессе химических реакций осуществляется завершение внешних уровней, что достигается либо отдачей электронов (у металлов), либо присоединением (у неметаллов), а также образованием общих электронных пар. Различают несколько типов химических связей:
1.Ковалентная связьосуществляется за счёт образования общих электронных пар, связывающих ядра атомов. Ковалентная связь образуется между атомами неметаллов.
Ковалентная неполярная связь образуется между атомами с одинаковой электроотрицательностью (в простых веществах – неметаллах):
Н◦ + ◦Н → Н◦◦Н (или Н—Н)
Общие электронные пары в равной степени принадлежат обоим атомам.
2.Ковалентная полярная связь образуется при взаимодействии атомов, электроотрицательности которых различаются незначительно.
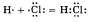
Атом хлора имеет большую электроотрицательность, чем атом водорода, поэтому общая электронная пара смещена в его сторону. Соответственно возникнут заряды: на атоме хлора - отрицательный, на атоме водорода – положительный. Такая связь называется полярной. (Примеры: Н2О, H2S, CH3Cl)
3. Ионная связь. Ионы - это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов.
Химическая связь между ионами, осуществляемая за счет электростатического притяжения, называется ионной связью. Ионная связь образуется при взаимодействии атомов, которые сильно различаются по электроотрицательности (связь между типичным металлом и типичным неметаллом).
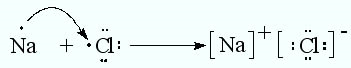
Атом натрия полностью отдаёт один электрон, а атом хлора его принимает, образуются ионы, которые притягиваются друг к другу и образуют ионную кристаллическую решётку:
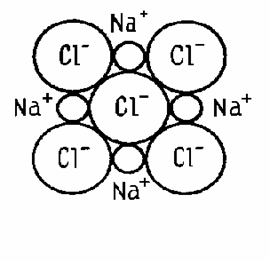
Ионная связь характерна для щелочей, солей, оксидов типичных металлов.
Простые и кратные связи
Если атомы связаны между собой одной общей электронной парой, то возникает одна ковалентная связь, которая называется простой, одинарной или σ-связью. Это основной вид связи, он существует во всех молекулах: Н-Н; Br-Br; CH3-CH3
σ-связи – это ковалентные связи, при образовании которых перекрывание электронных облаков осуществляется вдоль линии связи, соединяющей центры атомов.
Двойные и тройные связи имеют общее название: кратные связи.
π-Связи – это ковалентные связи, при образовании которых область перекрывания электронных облаков находится по обе стороны от линии, соединяющей центры атомов.
π-Связь образуется в тех случаях, когда между двумя атомами возникает две или три общие электронные пары.
Если связь между двумя атомами образована двумя общими электронными парами, то такая связь называется двойной связью. Любая двойная связь состоит из одной σ-связи и одной π-связи: СН2=СН2; О=О.
Если связь между двумя атомами образована тремя общими электронными парами, то такая связь называется тройной связью. Любая тройная связь состоит из одной σ-связи и двух
π-связей: СН≡СН; N≡N.
Различают четыре основных вида химической связи:
1. Ковалентная связь осуществляется общими электронными парами. Она образуется в результате перекрывания электронных облаков (орбиталей) атомов неметаллов. Чем больше перекрывание электронных облаков, тем прочнее химическая связь. Ковалентная связь бывает полярная и неполярная.Ковалентная неполярная связь возникает между атомами одного вида, у которых электроотрицательность одинакова. (Электроотрицательность – это свойство атомов притягивать к себе электроны). Например, образование молекулы водорода можно показать схемой:
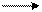 H . + .H = H (:) H H2
H . + .H = H (:) H H2
или H . + .H = H – H
Аналогично образуются молекулы O2, Cl2, N2, F2 и др.
Неполярная ковалентная связь симметрична. Электронное облако, образованное общей (поделенной) электронной парой, одинаково принадлежит двум атомам.
Полярная ковалентная связь возникает между атомами, электроотрицательности которых отличаются, но незначительно. В этом случае общая электронная пара сдвигается в сторону более электроотрицательного элемента, например, при образовании молекулы хлороводорода электронное облако связи смещено к атому хлора. За счет этого смещения атом хлора приобретает частичный отрицательный заряд, а атом водорода – частичный положительный заряд, а образующаяся молекула является полярной.
H + Cl = H Cl H → Cl HCl
Аналогично образуются молекулы HBr, HI, HF, H2O, CH4 и т.д.
Ковалентные связи бывают одинарные (осуществляются одной общей электронной парой), двойные (осущ. двумя общими электронными парами), тройные (осущ. тремя общими электронными парами). Например, в этане все связи одинарные, в этилене присутствует двойная связь, а в ацетилене – тройная связь.
Этан: CH3 –CH3 Этилен: CH2 = CH2 Ацетилен: CH ≡ CH
2. Ионная связь возникает в соединениях, образуемых атомами элементов, которые сильно отличаются по электроотрицательности, т. е. с резко противоположными свойствами (атомы металлов и неметаллов). Ионы – это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов.
Ионная связь образуется за счет электростатического притяжения разноименно заряженных ионов. Например, атом натрия, отдавая свой электрон, превращается в положительно заряженный ион, а атом хлора, принимая этот электрон, превращается в отрицательно заряженный ион. За счет электростатического притяжения между ионами натрия и хлора возникает ионная связь:

 Na + Cl Na+ + Cl– Na+Cl–
Na + Cl Na+ + Cl– Na+Cl–
Молекулы хлорида натрия существуют только в парообразном состоянии. В твердом (кристаллическом) состоянии ионные соединения состоят из закономерно расположенных положительных и отрицательных ионов. Молекулы в этом случае отсутствуют.
Ионную связь можно рассматривать как крайний случай ковалентной связи.
3. Металлическая связь существует в металлах и сплавах. Она осуществляется за счет притяжения между ионами металла и обобществленными электронами (это валентные электроны, которые покинули свои орбитали и перемещаются по всему куску металла между ионами – « электронный газ »).
4. Водородная связь – это своеобразная связь, которая возникает между атомом водорода одной молекулы, имеющим частичный положитедьный заряд, и электроотрицательным атомом другой или той же самой молекулы. Водородная связь может быть межмолекулярной и внутримолекулярной. HF…HF…HF. Обозначается точками. Слабее ковалентной.
ВОПРОС №28
Классификация химических реакций в неорганической и органической химии
Дата добавления: 2019-07-15; просмотров: 738; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
