КИНЕТИКА ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ КАТОДНАЯ И АНОДНАЯ ПОЛЯРИЗАЦИЯ
Скорость коррозионного процесса определяется количеством растворившегося металла, которое эквивалентно количеству электричества, протекающему за определенный промежуток времени.
Электрохимическая коррозия — частный случай необратимых электрохимических процессов, поэтому для определения скорости коррозии можно исходить из закона Фарадея:
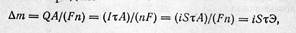
Скорость электрохимической коррозии можно выразить не только через плотность тока коррозии (А/м2):
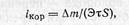
но и через потерю массы металла с единицы поверхности в единицу времени, К- m в г/(м2 • ч)
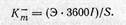
Отклонение потенциалов электрохимических реакций при прохождении тока от равновесных значений называется поляризацией (катодной или анодной).
В процессе коррозии с выделением водорода происходит восстановление гидратированных ионов водорода в кислой среде по реакции (1.10), а в щелочной и нейтральной средах — по реакции (1.11):
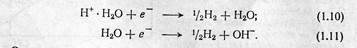
Замедление процесса выделения водорода вызывает катодную поляризацию, т. е. отставание процесса связывания электронов, высвобождающихся в анодной реакции. В большинстве случаев причиной катодной поляризации является затруднение процесса разряда ионов водорода — перенапряжение водорода. Таким образом, создавая перенапряжение водорода, можно снижать интенсивность коррозионных процессов.
Во многих коррозионных процессах катодный процесс представляет восстановление растворенного в электролите кислорода с образованием иона гидро-ксила. В нейтральных и щелочных средах ионизация кислорода протекает по реакции (1.12), а в кислых средах—по реакции (1.13):
|
|
|
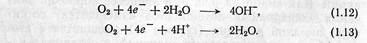
Катодная поляризация может возникать в' этом случае из-за недостаточной диффузии кислорода вследствие малой растворимости его в воде или в связи с затруднением собственно катодной реакции — ионизации кислорода (перенапряжением ионизации кислорода) при условии высоких скоростей подвода кислорода, например при перемешивании электролита.
Коррозия металлов с ионизацией кислорода встречается очень часто. Она наблюдается в случаях, когда металлы находятся в контакте с атмосферой, водными растворами, почвой и другими средами, в которых имеется растворенный кислород.
Скорость анодных реакций может уменьшаться из-за замедленности перехода металла в раствор в виде ионов (перенапряжение ионизации металла) или
в результате замедленности диффузии их в глубь раствора от поверхности. Причиной анодной поляризации может быть также образование защитных пленок на металле при его взаимодействии с компонентами электролита. В этом случае растворение металла сильно уменьшается и потенциал металла сдвигается в сторону положительных значений.
|
|
|
Различают несколько областей потенциалов, в которых протекает анодная реакция коррозионного процесса (рис. 6).
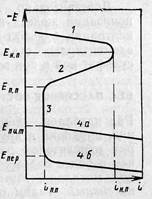
Рис. 6. Потенциостатическая поляризационная кривая:
1 — область активного растворения
2 — активно-пассивное состояние
3 — пассивное состояние металла; 4 — нарушение пассивного состояния металла; (а — питтингообразование, б — перепассивация) (Ен.п и iн.п — потенциал и ток начала пассивации; Еп.п и iп.п — потенциал и ток полной пассивации; епит — потенциал питтингообразования; Епер —потенциал перепассивации).
Участок 1 анодной поляризационной кривой отвечает активному состоянию металла.
Особенностью анодных реакций коррозионного процесса в области активного растворения является то, что они состоят из нескольких стадий, в которых принимают участие компоненты раствора.
Схематически анодную реакцию можно записать:
1) адсорбция аниона с образованием поверхностного комплекса
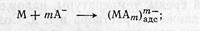
2) электрохимическая стадия, определяющая скорость всего процесса
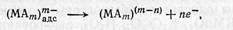
причем пе-- могут отщепляться в несколько стадий, например, последовательно по одному электрону в каждой из стадий;
3) распад комплекса на простые ионы
|
|
|
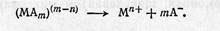
Действительно, доказано, что скорость реакции ионизации железа в серной кислоте зависит от концентрации сульфат-иона и рН. Это означает, что в элементарных стадиях анодной реакции участвуют сульфат-ион и ион водорода.
Дата добавления: 2019-07-15; просмотров: 448; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
