ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ МЕТАЛЛОВ
Процессы коррозии
В системе стандартизации (ГОСТ 5272—68) коррозия металлов определена как разрушение металлов вследствие химического и электрохимического взаимодействия их с коррозионной средой. В системе международной стандартизации (ИСО) это понятие несколько шире: физико-химическое взаимодействие между металлом и средой, в результате которого изменяются свойства металла и часто происходит ухудшение функциональных характеристик металла, среды или включающей их технической системы.
Объекты воздействия коррозии — металлы, сплавы, металлопокрытия, металлоконструкции машин, оборудование и сооружения.
Процесс коррозии представляют как коррозионную систему, состоящую из металла и коррозионной среды. Последняя содержит одно или несколько веществ, вступающих в реакцию с металлом. Коррозионная среда может быть жидкой и газообразной. Газообразная среда, окисляющая металл, называется окислительной газовой средой.
Изменение в любой части коррозионной системы, вызванное коррозией, называется коррозионным эффектом.
Коррозионный эффект, ухудшающий функциональные характеристики металла, покрытия, среды или включающих их технических систем, расценивают как эффект повреждения или как коррозионную порчу (по системе ИСО).
В результате коррозии образуются новые вещества, включающие окислы и соли корродирующего металла, это — продукты коррозии. Видимые продукты атмосферной коррозии, состоящие в основном из гидратированных оксидов железа, называют ржавчиной, продукты газовой коррозии — окалиной.
|
|
|
Экономический и экологический ущерб, наносимый нашей планете коррозией металлических изделий, оборудования и конструкций, неисчислим. В последние годы, например, только в Соединенных Штатах Америки ежегодные потери от коррозии составили 300 миллиардов долларов, что соответствует 6 % национального дохода всей страны.
В Российской Федерации ежегодные потери металлов из-за их коррозии составляют до 12 % общей массы металлофонда, что соответствует утрате до 30% ежегодно производимого металла. Кроме столь огромных связанных с коррозией прямых потерь, существуют еще большие косвенные потери. К ним относятся расходы, обусловленные потерей мощности металлического оборудования, его вынужденными простоями из-за аварий, а также расходы на ликвидацию последствий аварий, часто носящих характер экологических катастроф.
Как правило, металлическое изделие, пришедшее в негодность вследствие коррозионных разрушений, отправляют на переплавку. В этом случае общие потери будут включать безвозвратные потери металла, перешедшего в продукты коррозии, стоимость изготовления металлических изделий и косвенные потери. По статистическим данным безвозвратные потери составляют 8-12% от первоначальной массы металла. Стоимость изготовления металлических конструкций зачастую превосходит стоимость самого металла. К косвенным потерям относят расходы, связанные с отказом в работе металлического оборудования, с его простоями и ремонтом.
|
|
|
Росту потерь от коррозии способствует постоянное интенсивное развитие наиболее металлоемких отраслей промышленности, например, энергетики (тепловой и атомной), транспорта (в том числе трубопроводного), металлургии, химической, нефтяной и нефтехимической промышленности и др., а также ужесточение условий эксплуатации металла как в промышленности, так и в городском хозяйстве.
Наибольшие потери от коррозии несут топливно-энергетический комплекс (ТЭК), сельское хозяйство, химия и нефтехимия. Так, потери металла от коррозии составляют: в ТЭК—30 %, химии и нефтехимии — 20 %, сельском хозяйстве — 15 %, металлообработке — 5 %. В настоящее время проблема коррозии усугубляется резким старением основного металлофонда, физическим и моральным износом, совершенно недостаточной степенью возобновляемости и реновации (реконструкции, ремонта) (таблица 1.2).
|
|
|
Таблица 1.2
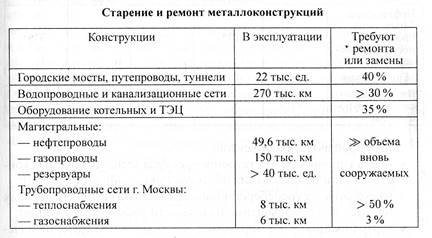
Большая часть из 800 млн тонн потенциально опасных сварных конструкций выработала свой ресурс на 50—70%. Значительная часть сооружений исчерпала свой плановый ресурс и вступает в период интенсификации отказов.
Нефтегазовые сооружения (трубопроводные, магистральные и промысловые системы, несущие конструкции нефтеперерабатывающих заводов и т.д.) эксплуатируются в условиях воздействия добываемых, транспортируемых, перерабатываемых углеводородных продуктов и агрессивных коррозионных сред.
Анализ причин отказов и аварий нефтегазовых сооружений свидетельствует о превалирующем влиянии коррозионного фактора. В нефтедобывающей промышленности и транспорте нефти 70 % отказов произошло по причине коррозионных повреждений.
Для нахождения путей практического решения тех или иных задач, возникающих в результате коррозионного разрушения различных металлических объектов, необходимо, в первую очередь, знание законов такого разрушения, т.е. теории коррозии металлов.
Способность металла сопротивляться коррозионному воздействию среды называют коррозионной стойкостью.
|
|
|
Коррозия металла или сплава происходит, как правило, на границе раздела фаз, т. е. на границе соприкосновения твердого вещества с газом или жидкостью.
Причиной коррозии является термодинамическая неустойчивость металла в окружающей среде. Подавляющее большинство металлических элементов в земной коре находится в окисленном состоянии — в виде оксидов, сульфидов и других соединений. Металлургическая промышленность осуществляет восстановление металлов из их природных соединений. Металл в виде изделия при его эксплуатации в природных условиях, в химической промышленности и в других отраслях взаимодействует с компонентами окружающей среды, например с кислородом воздуха, по реакции
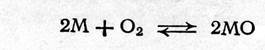
Для определения направления реакции нужно знать изменение ∆G энергии Гиббса (изобарно-изотермического потенциала) в системе:
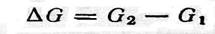
где G1 и G2 — энергия Гиббса исходных веществ и продуктов реакции соответственно.
Самопроизвольно протекают те процессы, которые сопровождаются уменьшением энергии Гиббса, т. е. для которых G1 > G2, или ∆G < 0. Для рассмотренной выше реакции окисления у всех металлов (кроме золота) при стандартных условиях ∆G° < 0. Следовательно, металлы самопроизвольно переходят в окисленное состояние при взаимодействии с окислительным компонентом окружающей среды. Чтобы продлить срок службы металлических изделий, необходимо осуществлять специальные мероприятия по защите, металлов от коррозии.
Коррозионные процессы классифицируют по механизму взаимодействия металла со средой; по виду коррозионной среды; по виду коррозионных разрушений; по объему разрушенного металла; по характеру дополнительных воздействий, которым подвергается металл одновременно с действием коррозионной среды.
По механизму взаимодействия металла со средой различают химическую и электрохимическую коррозию. Коррозию, протекающую под влиянием жизнедеятельности микроорганизмов, относят к биологической коррозии, а протекающую под действием радиоактивного излучения — к радиационной.
По виду коррозионной среды, участвующей в коррозионном разрушении металла или сплава, различают коррозию в жидкостях — неэлектролитах, коррозию в растворах и расплавах электролитов, газовую, атмосферную, подземную (почвенную) коррозию, коррозию блуждающим током и др.
По характеру изменения поверхности металла или. сплава либо по степени изменения их физико-механических свойств в процессе коррозии независимо от свойств среды различают несколько видов коррозионных разрушений (рис. 1).
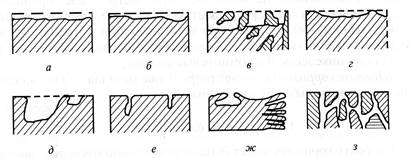
Рис. 1. Виды коррозии:
а. — сплошная равномерная; б — сплошная неравномерная; в — структурно-избирательная; г — пятнами; д — язвами; е — точками (питтинговая); ж — подповерхностная; з — межкристаллитная
Если коррозия охватывает всю поверхность металла, то она называется сплошной (рис. 1,а, б). Такой вид коррозии металлов наблюдается под действием кислот, щелочей, атмосферы. Сплошная коррозия может быть равномерной (рис. 1,а), т. е. разрушение металла происходит с одинаковой скоростью по всей поверхности, и неравномерной (рис. 1,б), когда скорость коррозии на отдельных участках поверхности неодинакова. Примером равномерной коррозии может служить коррозия при взаимодействии меди с азотной, железа — с соляной, цинка — с серной кислотами, алюминия—с растворами щелочей. Аналогично коррелируют железные трубы на открытом воздухе.
Сплавы некоторых металлов подвержены избирательной коррозии, когда один из компонентов (или одна из структур) сплава разрушается, а остальные практически остаются без изменений. При соприкосновении латуни с серной кислотой происходит компонентно-избирательная коррозия — коррозия цинка, а сплав обогащается медью. Такое разрушение легко заметить, так как происходит покраснение поверхности изделия вследствие увеличения концентрации меди в прокорродировавшей области. При структурноизбирательной коррозии (рис. 1,в) происходит преимущественное разрушение какой-либо одной структуры сплава, например, при соприкосновении стали с кислотами разрушается ферритовая структура, а карбид железа остается без изменений. Этому виду коррозии особенно подвержен чугун.
При местной (локальной) коррозии на поверхности металла обнаруживаются поражения в виде отдельных пятен — поражений, не сильно углубленных в толщу металла (рис. 1,г); язв — поражений, сильно углубленных в толщу металла (рис. 1,д); точек (питтингов), иногда еле заметных глазу, но глубоко проникающих в металл (рис. 1,е). Коррозия в виде язв и точек очень опасна для таких конструкций, где важно поддерживать условия герметичности и непроницаемости (емкости, аппараты, трубопроводы, применяемые в химической промышленности).
Подповерхностная коррозия начинается с поверхности металла при разрушении на отдельных участках его защитного покрытия (пленки оксида и др.). В этом случае разрушение идет преимущественно под покрытием, и продукты коррозии сосредоточиваются внутри металла. Подповерхностная коррозия часто вызывает вспучивание и расслоение металла (рис. 1,ж). Определить ее возможно только под микроскопом.
Межкристаллитная коррозия — разрушение металла по границам кристаллитов (зерен) с потерей его механической прочности; внешний вид металла при этом не меняется, но он легко разрушается на отдельные кристаллики под механическим воздействием (рис. 1,з). Объясняется это образованием между зернами металла или сплава рыхлых малопрочных продуктов коррозии. Этому виду коррозии подвержены хромистые и хромоникелевые стали, никелевые и алюминиевые сплавы.
Щелевая коррозия — разрушение металла под прокладками, в зазорах, резьбовых креплениях, в клепаных соединениях и т. п. Она чаще развивается на участке конструкции, находящейся в зазоре (щели) (рис. 2).
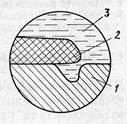
Рис. 2. Щелевая коррозия:
1 — металл; 2 — диэлектрик; 3 — кислота
По характеру дополнительных воздействий, которым подвергается металл одновременно с воздействием агрессивной среды, можно выделить коррозию под напряжением, коррозию при трении и кавитационную.
Коррозия под напряжением — это коррозия при одновременном воздействии коррозионной среды и постоянных или временных напряжений. Если это растягивающие напряжения, возможно коррозионное растрескивание, когда разрушение происходит не только по границам кристаллитов, а разделяется на части и сам кристаллит металла. Это очень опасный вид коррозии, особенно для конструкций, несущих механические нагрузки (мосты, оси, тросы, рессоры, автоклавы, паровые котлы, двигатели внутреннего сгорания, водяные и паровые турбины и др.). Одновременное воздействие циклических растягивающих напряжений и коррозионной среды вызывает коррозионную усталость — происходит понижение предела усталости металла. Этому виду коррозии подвержены валы гребных винтов, рессоры автомобилей, канаты, охлаждаемые валки прокатных станов и др.
Коррозия при трении — разрушение металла при совместном действии коррозионной среды и трения. При перемещении двух поверхностей относительно друг друга в условиях воздействия коррозионной среды происходит коррозия истиранием, или фреттинг-коррозия. Устранить коррозию при трении возможно правильным выбором коррозионно-стойкого и стойкого к истиранию конструкционного материала, снижением коэффициента трения, применением покрытий и т. д.
Кавитационная коррозия — разрушение поверхности металла или сплава, вызываемое одновременным коррозионным и механическим воздействием агрессивной среды, например, коррозия лопастей гребных винтов.
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ МЕТАЛЛОВ
Электрохимическая коррозия — разрушение металлических материалов в результате электрохимического взаимодействия их с коррозионной средой (электролитом). Электрохимическая коррозия может протекать в атмосфере, если на поверхности металла конденсируется влага (атмосферная коррозия) , а также в растворах или расплавах электролитов.
При электрохимической коррозии на металле одновременно протекают две реакции: анодная (ионизация атомов металла с переходом их в раствор электролита — растворение металла)

и катодная (восстановление окислителя Ох). 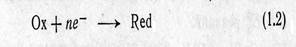
где Red— восстановленная форма реагирующего вещества.
Реакции (1.1) и (1.2) являются сопряженными, связанными между собой балансом электрических зарядов электрохимических процессов: электроны, высвобождающиеся в процессе ионизации атомов металла под действием электролита, переходят к окислителю, который при этом восстанавливается. Следует обратить внимание, что при электрохимической коррозии катион металла вступает в связь не с окислителем, а с другим компонентом коррозионной среды, способным сольватировать катионы, например:
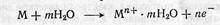
или образовывать комплексные соединения
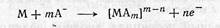
без участия валентных электронов металла.
К коррозии металла (растворению металла) приводит протекание собственно анодной реакции. Если поверхность металла и коррозионная среда однородны, реакции (1.1) и (1.2) протекают с одинаковой скоростью в любой точке поверхности металла, и металл растворяется равномерно (общая коррозия). Поверхность реальных металлов и сплавов обычно неоднородна, различной по составу может быть и коррозионная среда. Это приводит к тому, что анодная реакция ионизации атомов металла сосредоточивается на отдельных небольших участках поверхности металла, а на остальной поверхности протекает катодная реакция, т. е. имеет место локальная коррозия.
Дата добавления: 2019-07-15; просмотров: 418; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
