ТЕРМОДИНАМИКА ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
Причиной коррозии металлов является их термодинамическая неустойчивость в коррозионной среде. Мерой термодинамической неустойчивости служит изменение энергии Гиббса, наблюдаемое при взаимодействии металла с электролитом:

Термодинамически коррозионный процесс возможен лишь при ∆G < 0, поэтому Ер > 0, следовательно, Eрк> Ера. Это означает, что электрохимическая коррозия металла будет происходить, если в растворе присутствует окислитель, равновесный потенциал которого положительнее равновесного потенциала металла.
Равновесный (обратимый) потенциал (Ер) рассчитывают по уравнению Нернста:

Равновесный потенциал анодной реакции равен

Для расчета равновесного потенциала катодной реакции Eрк нужно знать, какой компонент коррозионной среды будет окислителем.
В водных растворах окислителями, как правило, являются ионы водорода и растворенный кислород. В этом случае основные катодные реакции следующие: восстановление (разряд) ионов водорода

и восстановление (ионизация) растворенного кислорода

Равновесный потенциал реакции (1.3) рассчитывают по уравнению

Когда Рн2= 1 атм и с учетом того, что — lg ан+ = = рН, для температуры 25 °С получим:

Равновесный потенциал реакции (1.4) равен

При Рo2 = 1 атм и с учетом того, что ан+аон- = Кнго (Кн2о — ионное произведение воды, равное 1,27· 10-14 при 25 °С), получим:

Для характеристики термодинамической устойчивости электрохимических систем в водных растворах можно использовать диаграмму потенциал — рН (диаграмму электрохимической устойчивости воды). На диаграмме (рис. 3) приведены линии равновесного потенциала водородного (линия 1) и кислородного (линия 2) электродов, рассчитанные по уравнениям (1.5) и (1.6), и отмечены значения стандартных потенциалов некоторых металлов. Металлы, потенциалы которых расположены ниже линии 1, могут корродировать под действием окислителей Н+ (Н3О+) и растворенного О2, так как EрМ< Ен+/Н2 и тем более EрМ < E pо2/он-. Если потенциал металла находится между линиями 1 и 2, то окислителем, вызывающим коррозию металла, будет только растворенный кислород (EрМ < Epо2/он-).
|
|
|

Рис. 3. Диаграмма электрохимической устойчивости воды при 25°С
Коррозию благородных металлов, равновесный потенциал которых находится выше линии 2, могут вызвать только сильные окислители с равновесным потенциалом более положительным, чем в реакциях (1.3) и (1.4).
Таким образом, сопоставляя равновесные потенциалы металла и предполагаемого окислителя, можно сделать вывод о вероятности коррозионного процесса.
УСЛОВИЯ ВОЗНИКНОВЕНИЯ КОРРОЗИОННОГО ПРОЦЕССА
|
|
|
Уравнение Нернста позволяет рассчитать значение потенциала металла, погруженного в раствор собственных ионов. В этом случае происходит обмен ионами между металлом и раствором

и скорость восстановления ионов металла, выраженная через плотность тока iм→(ток прямой реакции, ток разряда), равна скорости растворения металла iм←(ток обратной реакции, ток ионизации). Скорость обмена ионами металла между металлом и раствором при равновесном потенциале называют током обмена iо, который равен

Схема установления равновесного потенциала показана на рис. 4, а. Примером электрохимических систем, в которых устанавливается равновесный потенциал, является Ag в растворе АgNО3.

Рис. 4. Схема установления равновесного (а) и стационарного (б) потенциалов
Таким образом, при установлении равновесного потенциала границу металл — раствор пересекает только один вид ионов — катионы металла. При этом наблюдается баланс по зарядам (1.7) и баланс по веществу, т. е. коррозия отсутствует.
В реальных условиях во взаимодействии металла и электролита участвуют не только катионы данного металла, но и другие ионы (или молекулы). Установившееся при этом значение потенциала называется неравновесным, или необратимым. В таких условиях анодная реакция обеспечивается в основном ионами металла, а катодная — другими ионами, например, ионами водорода, присутствующими в электролите. Необратимый потенциал возникает, например, при погружении цинка в раствор серной кислоты Zn/Н2S04. В этом случае анодная реакция заключается в растворении цинка:
|
|
|
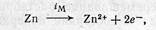
а катодная — в выделении водорода:

Значения необратимых потенциалов определяют опытным путем, так как их нельзя рассчитать по уравнению Нернста. Установившееся значение необратимого потенциала в результате равенства суммарных скоростей (можно измерить по плотности тока i ) катодных i→ и анодных i← процессов

называется стационарным потенциалом (потенциалом коррозии Екор).
При установлении стационарного потенциала (рис. 4, б) будет протекать коррозионный процесс, скорость которого выражается равенством
 Таким образом, при потенциале коррозии соблюдается баланс электрических зарядов [уравнение (1.8)], но происходит изменение массы металла в результате электрохимического растворения (коррозии) его [уравнение (1.9)].
Таким образом, при потенциале коррозии соблюдается баланс электрических зарядов [уравнение (1.8)], но происходит изменение массы металла в результате электрохимического растворения (коррозии) его [уравнение (1.9)].
На значение необратимого потенциала влияют температура, перемешивание раствора и концентрация его, природа и состояние поверхности металла.
|
|
|
Необратимые потенциалы определяют скорости электрохимической коррозии. Чем более отрицательное значение имеет потенциал металла, тем больше возможность перехода металла в ионное состояние, т. е. скорость электрохимического растворения.
Потенциал коррозии Екор и ток коррозии iкор являются основными характеристиками коррозионного процесса.
Дата добавления: 2019-07-15; просмотров: 231; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
