Форма отчета к выполненной лабораторной работе
«Физико - химический анализ технических жидкостей»
ФИО студентов______________________________группа_________
Руководитель занятий________________________Дата____________
Применяемое оборудование___________________________________
_____________________________________________________________
| Показатели качества | Данные | Имеющиеся | |
| НД | Испытаний | отклонения | |
| Внешний вид антифриза: цвет прозрачность | |||
| Состав исследуемого образца: этиленгликоль, объемные % вода, объемные % | |||
| Температура замерзания исследуемого образца, оС | |||
| Расчетный объем добавляемого компонента (воды или этиленгликоля) в см3 | |||
| Состав исправленного образца: этиленгликоль, объемные % вода, объемные % | |||
| Температура замерзания исправленного образца, оС | |||
| Внешний вид тормозной жидкости: цвет прозрачность | |||
| Основа тормозной жидкости растворимость в воде растворимость в бензине | |||
Заключение:
Отметка о защите
Определение жесткости воды и способы ее
Умягчения
Теоретическая часть
Вода является наиболее распространенной жидкостью применяемой для охлаждения.
Она обладает наибольшей охлаждающей способностью, имеет самую высокую теплоемкость, небольшую вязкость, большую теплоту испарения.
|
|
|
Применение воды осложняется по причине следующих недостатков:
- вода замерзает при температуре 0 оС со значительным увеличение объема, это вызывает разрушение системы охлаждения;
- вода имеет низкую температуру кипения, поэтому рабочая температура не должна превышать 90 оС, а при эксплуатации воды в горных районах эта температура еще меньше;
- при использовании воды в качестве охлаждающей жидкости в системе образуются отложения;
- при эксплуатации зимой систем с водным охлаждением приходится расходовать дополнительное количество топлива для периодического прогрева двигателя;
- сливать воду при длительных остановках.
Вода, используемая для охлаждения двигателей внутреннего сгорания, не должна вызывать коррозии металлов и образовывать отложения (накипь) на внутренних полостях системы охлаждения и радиаторов.
Образовавшаяся в системе охлаждения накипь препятствует нормальному отводу тепла от деталей двигателя, поэтому нарушается нормальный температурный режим его работы, ухудшаются мощностные и экономические показатели двигателя, повышается износ деталей.
Отложение накипи на деталях двигателя внутреннего сгорания зависит от содержания в воде растворенных солей, особенно кальция и магния.
|
|
|
О количестве растворенных в воде солей судят по ее жесткости. Различают временную, постоянную и общую жесткость воды.
Общую жесткость воды составляют временная (карбонатная), создаваемая бикарбонатами кальция Cа(HCO3)2 и магния Mg(HCO3)2, и постоянная (некарбонатная), создаваемая хлоридами, сульфатами и нитратами этих же металлов CaCl2, CaSO4, Ca(NO3)2, MgCl2, MgSO4, Mg(NO3)2.
Жесткость воды измеряется молярной концентрацией эквивалентов солей жесткости моль/дм3. Для ионов кальция Ca²+ содержание 20,04 мг/ дм3 соответствует миллиграмм - эквиваленту солей жесткости кальция, и для ионов магния 12,16 мг/дм3 соответствует миллиграмм - эквиваленту солей жесткости магния.
Поэтому общая жесткость воды равна
Ж0 = Ca 2+/20,04 + Мg2+/12,16 (8.1)
Воду, содержащую до 1,5 моль/дм3 солей жесткости, считают очень мягкой, до 3 моль/дм3 – мягкой, от 3 до 6 моль/дм3 – умеренно жесткой, от 6 до 9 моль/дм3 – жесткой и более 9,0 моль/дм3 – очень жесткой.
Вода с жесткостью 3…7 моль/дм3 вызывает образование накипи в системе охлаждения двигателей внутреннего сгорания, что требует систематической очистки радиатора и рубашки системы охлаждения двигателя. Воду с жесткостью 7…10 моль/дм3 применять в качестве охлаждающей жидкости в двигателях не рекомендуется, а с жесткостью более 10 моль/дм3 – применять недопустимо. Различные единицы жесткости воды приведены в таблице 8.1.
|
|
|
Таблица 8.1- Единицы жесткости воды
|
| моль/дм3 | Градусы | |||
| немецкие | французские | английские | американские | ||
| 1 моль/дм3 | 1 | 2,804 | 5,005 | 3,511 | 50,045 |
| 1 немецкий градус | 0,3566 | 1 | 1,7848 | 1,2521 | 17,847 |
| 1 французский градус | 0,1998 | 0,5603 | 1 | 0,7015 | 10 |
| 1 английский градус | 0,2848 | 0,7987 | 1,4255 | 1 | 14,253 |
| 1 американский градус | 0,0199 | 0,0560 | 0,1 | 0,0702 | 1 |
Жесткая вода перед применением в системах охлаждения двигателей внутреннего сгорания подлежит умягчению.
При использовании воды для технических целей (в том числе и для двигателей внутреннего сгорания) ее умягчают различными способами: простым кипячением, переводом солей жесткости в осадок с помощью химических реактивов (содой, известью тринатрийфосфатом и др.); фильтрацией воды через пермулитовые и глауконитовые фильтры, магнитной обработкой воды и т.д.
Наибольшее распространение получил способ умягчения воды фильтрацией через глауконитовый и пермулитовый фильтры.
|
|
|
Сущность этого умягчения состоит в пропускании жесткой воды через слой естественного или искусственного минерала (катионита).
Катиониты – нерастворимые зернистые материалы, имеющие примерный состав Al2O3(SiO2)x (Na2O)·nH2O, способные обменивать свои катионы на катионы водного раствора.
Цель данной работы – изучение методов определения качества воды (временной и постоянной жесткости), используемой для технических целей и ее умягчения.
Экспериментальная часть
8.2.1 Оборудование, инструменты, реактивы
Набор стеклянной лабораторной посуды;
Бюретка с глауконитом;
Электроплитка;
0,1 моль/дм3 раствор соляной кислоты;
Щелочная смесь, приготовленная смешиванием равных объемов 0,1 моль/дм3 раствором карбоната натрия Na2CO3 и 0,1 моль/дм3 раствора едкого натра NаOH;
Водные растворы карбоната натрия Na2CO3 концентрации 5 мг/см3
Водные растворы тринатрийфосфата Na3PO4 концентрации5 мг/см3;
Раствор водный 0,1% (масс.) индикатора метилового - оранжевого;
Фильтровальная бумага или фильтры “Синяя лента”.
8.2.2 Определение временной (карбонатной) жесткости
Сущность определения временной жесткости воды состоит в переводе бикарбонатов кальция и магния, содержащихся в анализируемой воде в хлористые соединения титрованием 0,1 моль/дм3 раствором соляной кислоты.
При воздействии соляной кислоты бикарбонаты переходят в хлориды этих же металлов.
Для определения временной жесткости Жв в коническую колбу налить 100 см3 анализируемой воды, добавить две-три капли индикатора метиловогооранжевого, титровать 0,1моль/дм3 раствором соляной кислоты до появления слабо-розового окрашивания и кипятить в течение 3 мин.
В результате кипячения окраска раствора может измениться на желтую. В этом случае в колбу снова добавить раствор соляной кислоты до слабо-розовой окраски и кипятить еще 2 мин.
Временную жесткость Жв (моль/дм3) воды вычислить по формуле
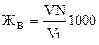 (8.1)
(8.1)
где V – объем раствора соляной кислоты, пошедшей на титрование анализируемой воды, см3; N – молярная концентрация соляной кислоты, моль/дм3; V1 – объем воды, отобранной на анализ, см3.
8.2.3 Определение общей жесткости воды
На практике существует несколько способов определения общей жесткости воды. Один из наиболее простых – это щелочной метод, суть которого заключается в переводе солей жесткости, содержащихся в воде, в малорастворимые карбонат кальция и гидрооксид магния с помощью щелочного раствора.
Для приготовления щелочного титрованного раствора перемешивают равные объемы 0,1 моль/дм3 растворов карбоната натрия Na2CO3 и едкого натра NaOH.
Под действием щелочного раствора соли некарбонатной жесткости анализируемой воды, предварительно оттитрованной раствором соляной кислоты, превращаются в малорастворимые соединения и выпадают в осадок.
При определении общей жидкости налить в коническую колбу 100 см3 анализируемой воды и титровать ее раствором 0,1 моль/дм3 соляной кислоты в присутствии двух-трех капель индикатора метилового оранжевого до появления слабо-розовой окраски. Затем раствор кипятить в течение 3 мин с целью удаления из пробы воды углекислого газа СО2. В случае появления при кипячении желтой окраски воду дополнительно титровать тем же раствором соляной кислоты до слабо-розовой окраски. После этого в кипящую воду с помощью бюретки прилить 20 см3 щелочной смеси и раствор кипятить еще в течение 3…5 мин для полного осаждения солей кальция и магния.
После кипячения воду охладить и перелить в мерную колбу вместимостью 200 см3. Оставшийся на стенках колбы осадок смывают дистиллированной водой из промывальной склянки в мерную колбу.
Объем воды в мерной колбе довести дистиллированной водой до метки, тщательно перемешать содержимое и затем осадок отфильтровать.
С помощью пипетки или мерного цилиндра отмерить 100 см3 фильтрата, вылить его в чистую и сухую коническую колбу, прилить три-четыре капли индикатора метилового оранжевого и титровать раствором 0,1 моль/дм3 соляной кислоты до слабо-розового окрашивания. При титровании нейтрализуется избыток щелочной смеси, добавленной к пробе воды и не вступившей в реакцию.
Общую жесткость Ж0 анализируемой воды вычисляют по формуле
Ж0 = V1 – 2V, (8.2)
где V - объем раствора 0,1 моль/дм3 соляной кислоты, израсходованной на нейтрализацию избыточной щелочной смеси, см3; V1 - объем раствора щелочной смеси, взятой для осаждения солей жесткости, см3; 2 - коэффициент, учитывающий то обстоятельство, что из общего объема раствора воды с щелочной смесью на титрование взята только половина.
8.2.4 Умягчение жесткой воды кипячением
Воду налить в химический стакан в количестве 200 см3 и кипятить 30 мин на электрической плитке.
В процессе кипячения происходит разложение карбонатов и бикарбонатов кальция и магния с выпадением части их в осадок и переходом в газообразное состояние.
После кипячения стакан с анализируемой водой охладить, образовавшийся осадок отфильтровать через бумажный фильтр “Синяя лента”.
Затем фильтрат подвергнуть анализу и определить его временную Жфв и общую Жоф жесткость.
Изменение жесткости воды 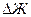 фв и
фв и 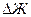 фо в результате кипячения вычислить по формулам
фо в результате кипячения вычислить по формулам
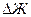 фв = Жв -Жфв (8.3)
фв = Жв -Жфв (8.3)
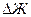 фо = Жо -Жфо, (8.4)
фо = Жо -Жфо, (8.4)
где Жв и Жо – временная и общая жесткость воды соответственно, до кипячения; Жфв и Жоф - временная и общая жесткость воды соответственно, после кипячения.
8.2.5 Умягчение жесткой воды содой Na2CO3 и тринатрийфосфатом Na3PO4.
При добавлении в жесткую воду Na2CO3 или Na3PO4 протекают реакции, в результате которых соли жесткости превращаются в нерастворимые соли кальция и магния, выпадающие в осадок. Вода становится мягкой.
Работу по умягчению воды выполнить в следующем порядке.
Сначала подсчитать требуемое для умягчения воды объем А1 и А2 (см3) реагентов (смягчителей) по формулам:
для соды А1=53ЖоV/Т; (8.5)
для тринатрийфосфата
А2=55ЖоV/Т; (8.6)
где Жо - общая жесткость умягчаемой воды, моль/дм3; V - объем воды, взятой для умягчения, л; Т – массовая концентрация реагента, мг/см3 раствора; 53 и 55 – молярная масса эквивалентов соответственно Na2CO3 и Na3PO4, мг.
В два химических стакана налить по 100 см3 умягчаемой воды. Затем в один из них добавить с помощью бюретки рассчитанное количество смягчителя, содержащего соду, в другой – тринатрийфосфат.
Для ускорения реакции стаканы поставить на электроплитку, нагреть и кипятить раствор с содовым смягчителем в течение 5…8 мин, с тринатрийфосфатом - 10…15 мин.
После кипячения стаканы охладить, а содержимое их отфильтровать через бумажные фильтры “Синяя лента”.
В связи с тем, что сода и тринатрийфосфат полностью удаляют соли временной жесткости, после умягчения определить только общую жесткость умягченной воды.
8.2.6 Умягчение жесткой воды глауконитом (катионитом).
Сущность этого метода умягчения заключается в пропускании воды через слой мелкозернистого глауконита (условное обозначение Na2R).
Так как глауконит способен за счет обменной реакции извлекать из воды ионы кальция и магния и заменять ионами натрия, то в результате такого умягчения в воде уменьшается содержание кальция и она становится мягкой. Остаточная жесткость воды в этом случае обычно не превышает 0,95 моль.экв/дм3.
На качество умягчения влияет начальная жесткость испытуемой воды, высота слоя катионита в фильтре, его активность, а также скорость пропускания воды через фильтр.
Для умягчения пробы воды насыпать в бюретку слой катионита (глауконита) высотой 300…400 мм и через него медленно пропустить примерно 100 см3 воды небольшими порциями. Скорость выхода воды через нижнее отверстие бюретки должна быть не более 2 см3/мин. При такой скорости фильтрации вода достаточное время контактирует с смягчителем и обменные реакции полностью завершаются.
Для проверки качества умягчения воды первые 10…20 см3 отбросить, затем отобрать пробу для определения временной и общей жесткости.
Этот способ выгодно отличается от других, так как конструкция фильтров смягчителей проста, легко восстанавливается (регенерируется) активность минерала и т. д.
По истечении рабочего цикла фильтра - смягчителя (обычно не менее 6 ч) отработанный глауконит регенерируют пропусканием через него 5…10 процентного раствора хлористого натрия. После этого его обменная способность восстанавливается.
Контрольные вопросы
Какие достоинства и недостатки имеет вода как охлаждающая жидкость? Чем обуславливается жесткость воды?
В каких единицах измеряется жесткость воды?
В чем различия между временной и постоянной жесткостью?
Способы умягчения воды?
Дата добавления: 2019-02-26; просмотров: 118; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
