Идеальный газ. Уравнение состояния идеального газа.
Уравнением состояния называется уравнение, связывающее параметры физической системы и однозначно определяющее ее состояние.
p = nkT может быть записано в другой форме
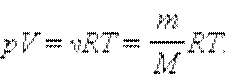
m – масса газа в сосуде
M – молярная масса газа.
v – количество вещества
V – объём
T – температура
R– универсальная газовая постоянная
R = 8,31 Дж/моль·К.
Для одного моля любого газа это соотношение принимает вид:
pV=RT
Если температура газа равна T н = 273,15 К (0 °С), а давление p н = 1 атм = 1,013·105 Па, то говорят, что газ находится при нормальных условиях. Как следует из уравнения состояния идеального газа, один моль любого газа при нормальных условиях занимает один и тот же объем V 0, равный
V 0 = 0,0224 м3/моль = 22,4 дм3/моль.
Это утверждение называется законом Авогадро.
Для смеси невзаимодействующих газов уравнение состояния принимает вид
pV = (ν1 + ν2 + ν3 + ...)RT
Уравнение состояния газа называется уравнением Клапейрона–Менделеева.
Изотермический процесс (T = const)
pV = const
Это уравнение называют законом Бойля–Мариотта.
Изохорный процесс (V = const)
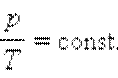
Уравнение изохорного процесса называется законом Шарля.
Уравнение изохорного процесса может быть записано в виде:
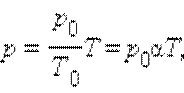
p0 – давление газа при T = T0 = 273,15 К (т. е. при температуре 0 °С).
Коэффициент α, равный (1/273,15) К–1, называют температурным коэффициентом давления.
Изобарный процесс (p = const)
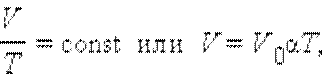
V0 – объем газа при температуре 0 °С.
|
|
|
Коэффициент α равен (1/273,15) К–1. Его называют температурным коэффициентом объемного расширения газов.
Уравнение изобарного процесса называют законом Гей-Люссака.
Экспериментально установленные законы Бойля–Мариотта, Шарля и Гей-Люссака находят объяснение в молекулярно-кинетической теории газов. Они являются следствием уравнения состояния идеального газа.
Давление идеального газа на основе МКТ.
Основное уравнение МКТ.
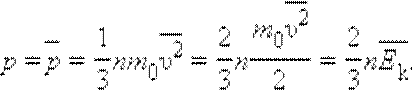
Давление газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема.
p = nkT
k - постоянная Больцмана
k = 1,38·10–23 Дж/К.
Молекулярно-кинетическое толкование абсолютной температуры.
Сравнивая соотношения p = nkT с основным уравнением молекулярно-кинетической теории газов, можно получить:
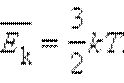
Средняя кинетическая энергия хаотического движения молекул газа прямо пропорциональна абсолютной температуре.
Таким образом, температура есть мера средней кинетической энергии поступательного движения молекул.
Число степеней свободы молекулы. Закон равномерного распределения температуры по степеням свободы молекулы.
Числом степеней свободы iматериального объекта называют число независимых координат, которые необходимо задать, чтобы однозначно определить положение этого объекта относительно рассматриваемой системы отсчета.
|
|
|
Одноатомные молекулы: i=3
Двухатомные молкеулы: i=5
Трехатомные молекулы: i=6
Если система молекул находится в тепловом равновесии при температуре T, то средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой поступательной и вращательной степени свободы молекулы она равна kT/2.
На каждую колебательную степень свободы приходится:
Дата добавления: 2019-02-22; просмотров: 181; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
