Физические характеристики некоторых веществ
| Вещество | РКР, МПа | ТКР, К | Константы уравнения Ван-дер-Ваальса | |
| аּ101, (Джּм3)/моль | bּ105, м3/моль | |||
| Азот | 3,39 | 126,2 | 1,36 | 3,85 |
| Аммиак | 11,33 | 405,4 | 4,23 | 3,73 |
| Ацетилен | 6,14 | 308,3 | 4,37 | 5,12 |
| Вода | 22,06 | 647,1 | 5,55 | 3,26 |
| Водород | 1,32 | 33,2 | 2,48 | 2,19 |
| Диоксид серы | 7,88 | 430,6 | 6,76 | 5,65 |
| Диоксид углерода | 7,38 | 304,2 | 3,65 | 4,27 |
| Кислород | 5,04 | 154,6 | 1,38 | 3,18 |
| Метан | 4,66 | 191,6 | 2,28 | 4,28 |
| Оксид углерода | 3,50 | 132,9 | 1,48 | 3,94 |
| Пропилен | 9,18 | 365,0 | 4,23 | 4,13 |
| Сероводород | 8,94 | 373,2 | 5,45 | 5,20 |
| Хлор | 7,71 | 417,2 | 6,59 | 5,62 |
| Хлороводород | 5,15 | 324,7 | 3,70 | 4,08 |
| Этан | 4,87 | 305,3 | 5,58 | 6,52 |
| Этилен | 5,04 | 282,4 | 4,55 | 5,72 |
ПРИЛОЖЕНИЕ 2
Термическая характеристика некоторых типов
Внутримолекулярной связи (к формуле Коновалова)
| Группа атомов или тип связи | Структурная формула | Х, кДж/моль |
| Одинарная связь | С – С | 0,0 |
| Двойная связь | С = С | 87,9 |
| Тройная связь | С ≡ С | 213,4 |
| Фенильная группа | R – C6H5 | 100,4 |
| Спиртовая группа | R – CH2OH | 50,2 |
| Простой эфир | R1 – O – R2 | 87,9 |
| Альдегидная группа | R – CHO | 75,3 |
| Кетогруппа | R1 – CO – R2 | 50,2 |
| Карбоксильная группа: | ||
| в одноосновной кислоте | R – COOH | 0,0 |
| в двухосновной кислоте | HOOC – R – COOH | 12,6 |
|
|
|
ПРИЛОЖЕНИЕ 3
Термодинамические свойства веществ
| Вещество | DН°298, кДж/моль | S°298, Дж/моль×К | DG°298, кДж/моль | СР°298, Дж/моль×К |
| Al | 0 | 28,33 | 0 | 24,35 |
| C графит | 0 | 5,74 | 0 | 8,54 |
| Н2 | 0 | 130,52 | 0 | 28,83 |
| N2 | 0 | 191,5 | 0 | 29,12 |
| Si | 0 | 18,83 | 0 | 19,99 |
| О2 | 0 | 205,04 | 0 | 29,37 |
| СО | -110,53 | 197,55 | -137,15 | 29,14 |
| СО2 | -393,51 | 213,66 | -394,37 | 37,11 |
| НСNГ | 132,0 | 201,71 | 121,58 | 35,90 |
| HCl | -92,31 | 186,79 | -95,3 | 29,14 |
| HNO3Ж | -173,0 | 156,16 | -79,9 | 109,87 |
| HNO3Г | -133,91 | 266,78 | -73,78 | 54,12 |
| Н2ОЖ | -285,83 | 69,95 | -237,23 | 75,30 |
| Н2ОГ | -241,81 | 188,72 | -228,61 | 33,61 |
| Н2SO4Ж | -813,99 | 156,9 | -690,14 | 138,91 |
| NH3Ж | -69,87 | - | - | 80,75 |
| NH3Г | -45,94 | 192,66 | -16,48 | 35,16 |
| NOГ | 91,26 | 210,64 | 87,58 | 29,86 |
| NO2Г | 34,19 | 240,06 | 52,29 | 36,66 |
| SiO2 | -910,94 | 41,84 | -856,67 | 44,43 |
| Al2O3 | -1675,69 | 50,92 | -1582,27 | 79,04 |
| SO2Г | -296,9 | 248,07 | -300,21 | 39,87 |
| SO3Г | -395,85 | 256,69 | -371,17 | 50,09 |
| СН4Г метан | -74,85 | 186,27 | -50,85 | 35,71 |
| С2Н2Г ацетилен | 226,75 | 200,82 | 209,21 | 43,93 |
| С2Н4 этилен | 52,3 | 219,45 | 68,14 | 43,56 |
| С3Н6Г пропен | 20,41 | 266,94 | 62,70 | 63,89 |
| С6Н6Ж бензол | 49,03 | 173,26 | 124,38 | 135,14 |
| СН2ОГ формальдегид | -115,9 | 218,78 | -109,94 | 35,39 |
| СН2О2Г муравьиная кислота | -378,8 | 248,77 | -351,51 | 45,8 |
| СН4ОГ метанол | -201,00 | 239,76 | -162,38 | 44,13 |
| С3Н8ОЖ пропанол | -304,55 | 192,88 | 170,70 | 148,60 |
| С3Н4О2Г акриловая кислота | -336,23 | 311,01 | -286,06 | 77,78 |
| С2Н4Cl2Г 1,2 дихлорэтан | -129,7 | 308,19 | -73,85 | 78,66 |
| С2Н4Сl2Ж 1,2 дихлорэтан | -165,02 | 208,53 | -79,45 | - |
ПРИЛОЖЕНИЕ 4
|
|
|
Средние ионные коэффициенты активности сильных
электролитов в водных растворах при 25ºС
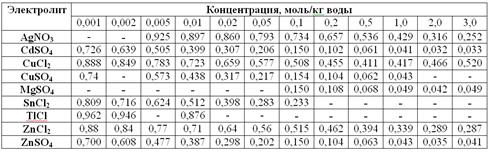
ПРИЛОЖЕНИЕ 5
Нормальные электродные потенциалы при 25ºС
| Электродная реакция | Е0, В | Электродная реакция | Е0, В |
| Li ® Li++e | -3,02 | As ® As3++3e | +0,30 |
| Rb ® Rb++e | -2,98 | Cu ® Cu2++2e | +0,34 |
| K ® K++e | -2,92 | Cu ® Cu++e | +0,52 |
| Ba ® Ba2++2e | -2,92 | 2Hg ® Hg  +2e +2e
| +0,798 |
| Sr ® Sr2++2e | -2,89 | Ag ® Ag++e | +0,799 |
| Zn ® Zn2++2e | -0,763 | Pd ® Pd2++2e | +0,83 |
| Cr ® Cr3++3e | -0,71 | Hg ® Hg2++2e | +0,854 |
| S2- ® S+2e | -0,51 | Pt ® Pt2++2e | +1,2 |
| Fe ® Fe2++2e | -0,441 | Au ® Au3++3e | +1,42 |
| Cd ® Cd2++2e | -0,402 | Au ® Au++e | +1,7 |
| Tl ® Tl++e | -0,335 | Ca ® Ca2++2e | -2,84 |
| Co ® Co2++2e | -0,27 | Na ® Na++e | -2,713 |
| Ni ® Ni2++2e | -0,23 | Mg ® Mg2++2e | -2,38 |
| Sn ® Sn2++2e | -0,140 | Al ® Al3++3e | -1,66 |
| Pb ® Pb2++2e | -0,126 | Mn ® Mn2++2e | -1,05 |
| Fe ® Fe3++3e | -0,036 | Bi ® Bi3++3e | +0,23 |
| 1/2H2 ® H++e | +0,000 | Sb ® Sb3++3e | +0,20 |
| Sn ® Sn4++4e | +0,050 |
Диаграмма
|
|
|

Литература
Основные источники
1. Белик В.В., Киенская К.И. Физическая и коллоидная химия. – М.: Академия, 2006
Дополнительные источники
1. Ахметов Б.В. Физическая и коллоидная химия: учеб. Для техникумов – Л.: Химия 1986
2. Ахметов Б.В. Задачи и упражнения по физической и коллоидной химии.− Л.: Химия, 1998
3. Байрамов В.М. Основы химической кинетики и катализа. – М.: Академия, 2003
4. Гельфман М.И. Коллоидная химия. М.: Лань, 2004
5. Горшков В.И., Кузнецов И.А. Основы физической химии. – М.:БИНОМ Лаборатория знаний, 2006
6. Краткий справочник физико-химических величин /под ред. Равделя, Пономаревой – М.: ООО «ТИД и As-book», 2009
Интернет – ресурсы
1. Альтернативные источники энергии (сайт) URL: http:// www.alternativenergy.ru. (дата обращения 17.09.2010)
2. Портал URL: http:// www.nanometer.ru. (дата обращения 22.08.2010)
|
|
|
3. Тесты физическая химия (сайт) URL: http:// www.twipx.com.ru. (дата обращения 11.02.2011)
4. Химические науки и образование в России (сайт) URL: http:// www.chemnet.ru. (дата обращения 03.02.2011)
Дата добавления: 2019-02-12; просмотров: 169; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
