Тема 1.5. Химическое равновесие
Химические реакции протекают обратимо и необратимо.
 Обратимыми называются реакции, которые могут при одних и тех же условиях протекать в противоположных направлениях.
Обратимыми называются реакции, которые могут при одних и тех же условиях протекать в противоположных направлениях.
А + В  С + D
С + D
Необратимыми называются реакции, при которых образуются трудно растворимые осадки, либо выделяются газообразные продукты реакции.
А + В ® С + D ¯; A + B ® C + D
Пределом протекания обратимых реакций при данных условиях является достижение истинного химического равновесия.
Химическое равновесие характеризуется константой химического равновесия К.
Для реакции аА + bB  cC + dD.
cC + dD.

Такая константа химического равновесия обозначается КС, индекс С обозначает, что константа выражена через молярные концентрации

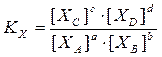 – константа химического равновесия, выраженная через молярные доли.
– константа химического равновесия, выраженная через молярные доли.
 – константа химического равновесия, выраженная через парциальные давления.
– константа химического равновесия, выраженная через парциальные давления.
Значение Константы
1. К >> 1 , то процесс протекает со значительным выходом продуктов.
2. К << 1 , то выход продукта мал, процесс нетехнологичный, т.е нерентабельный для технологии применения.
3. К > 104 - реакцию считают необратимой.
К < 10-4 – реакции практически невозможны.
4. 104 > К > 10-4 – практически обратимы.
Существует другой критерий для определения характера протекания химического процесса. Если химический анализ указывают:
1) на отсутствие исходных веществ в равновесной химической системе, то реакция считается необратимой.
2) на наличие в равновесной системе, как исходных веществ, так и продуктов реакции, которую считают обратимой.
3) если в системе не обнаружилось продуктов реакции, то такая реакция считается практически невозможной.
Знание константы позволяет технологу определить состав равновесной системы, рассчитать выход продукта, вычесть коэффициент использования сырья и др. расчеты.

∕ ∕

\
H
КР >> 104 – протекает необратимо
КР << 10-4 практически невозможно
Далее также будет говорить об использовании КР при выяснении влияния состава системы на направленность протекания процесса, т.е. на химическое сродство.
Константа химического равновесия показывает во сколько раз скорость прямой реакции больше или меньше скорости обратной реакции.
Она зависит от природы реагирующих веществ и от температуры.
Взаимосвязь между КР, КС, КХ выражается следующими формулами:
КР = КС( RT) D n = К x( Pсм) D n
где Dп = å nпрод - å nисх
Dп = ( c + d ) - ( a + b) – учитывается количество вещества газообразных компонентов системы.
Химическое равновесие подвижно, то есть если изменить одно из условий, при котором система находится в равновесии, то произойдёт сдвиг равновесия вправо или влево, в сторону той реакции, которая противодействует этому изменению. Это соответствует принципу Ле-Шателье (1884г).
Рассмотрим факторы, которые влияют на смещение равновесия на примере синтеза аммиака: 3Н2 + N2  2 NH3 + Q
2 NH3 + Q
1) Влияние температуры.
Прямая реакция экзотермическая, то есть с выделением теплоты +Qx Þ обратная реакция эндотермическая, идущая с поглощением теплоты системой из окружающей среды.
Если увеличить температуру равновесной химической системы (подвод тепла), то в системе начнётся процесс, направленный на уменьшение её t° (поглощения), и наоборот при уменьшении температуры начнётся процесс, направленный на увеличение температуры, отсюда вывод: увеличение Т смещает химическое равновесие в сторону эндотермической реакции, а уменьшение – в сторону экзотермической реакции.
2) Влияние давления.
3Н2 + N2  2NH3
2NH3
Вспомним, что в газообразных системах объём приравнивается количеству веществ, то есть реагируют 4 моль вещества, образуется 2 моль вещества.
Если увеличить Р, то в системе начнётся процесс, направленный на уменьшение Р путём уменьшения объёма (числа молей) газообразных веществ, и наоборот.
Вывод: увеличение Р смещает химическое равновесие в сторону той реакции, которая идёт с уменьшением числа моль вещества. Если уменьшить Р, то химическое равновесие сместится в сторону реакции, идущей с увеличением числа моль вещества.
3) Влияние концентрации.
Если в равновесную химическую систему добавить вещество, которое участвует в химической реакции, то в системе начнётся процесс, идущий на расходование этого вещества.
Например:
1. добавляем в систему H2 или N2, то равновесие сместится вправо – в сторону образования NH3, то есть идёт процесс расходования H2 или N2.
2. добавляем в систему NH3 – равновесие сместится влево – идёт процесс расходования NH3 с образованием H2 и N2.
Если удалить из системы какое-либо из взаимодействующих компонентов, то равновесие сместится в сторону реакции, направленной на образование дополнительного количества этого компонента.
Например:
1. если удалить из системы NH3, то равновесие системы сместиться в сторону реакции, направленной на образование этого вещества, то есть слева направо.
2. если уменьшить концентрацию H2 или N2, то есть удалить из системы, то равновесие сместиться справа налево (на образование дополнительного количества).
Итак, чтобы в реакции синтеза аммиака получить большой
выход продукта ( NH3), необходимо:
1. понизить Т;
2. увеличить давление;
3. увеличить концентрацию исходных веществ (H2 и N2), уменьшить концентрацию NH3, то есть удалять его в ходе синтеза из реакции.
Для того, чтобы совершалась химическая реакция, должна быть затрачена работа, которая идёт на увеличение свободной энергии образующихся веществ. Величина изменения свободной энергии (энергия Гиббса DG, энергия Гельмгольца DF) является мерой реакционной способности взаимодействующих веществ, а знак её указывает на направленность процесса.
Расчёты ведут по уравнениям изотермы химической реакции Вант Гоффа:


где Кс, Kр – константы равновесия при абсолютной Т
[C],[D],[A],[B] – концентрации
РС, Р D, PA, PB – парциальные давления
Если [C]=[D]=[B]=[A] = 1 моль/м3 Þ DF ° = – RTlnKC ;
– DF ° = RTlnKC
если [РС]=[РD]=[РB]=[РA]= 1Па Þ DG ° = – RTlnK р ;
– DG ° = RTlnK р
При самопроизвольном процессе DF,DG < 0; система совершает полезную работу
W = – DG = Dп RTlnK р
W = – DF = Dп RTlnKC
Вспомним формулы из второго закона термодинамики, по которым можно рассчитать
DG °298 = DH °298 - TDS °298
Константа химического равновесия зависит от температуры системы. Эта зависимость представлена в виде уравнения изобары Вант Гоффа.

Если DН < 0 (экзотермическая реакция), то при увеличении температуры константа уменьшится Þ равновесие сместится в строну исходных веществ (справа налево).
Если DН > 0, то при увеличении температуры const увеличивается, равновесие сместится слева направо - в сторону продуктов реакции.
Если DН = 0. Константа не зависит от температуры.
Для расчётов удобнее пользоваться преобразованным уравнением изобары.

Примеры решения задач
Пример 1
 При состоянии равновесия системы 3Н2 + N2 2NH3 концентрация азота 0,3 моль/м3, водорода 0,9 моль/м3, аммиака 0,4 моль/м3. Вычислить константу равновесия реакции и исходные концентрации азота и водорода.
При состоянии равновесия системы 3Н2 + N2 2NH3 концентрация азота 0,3 моль/м3, водорода 0,9 моль/м3, аммиака 0,4 моль/м3. Вычислить константу равновесия реакции и исходные концентрации азота и водорода.
| KC - ? [N2]'- ? [H2]'- ? | Так как реакция идёт без изменения объёма, то значение К будет одинаково при всех способах выражения концентраций. 1) 2) Находим исходные концентрации [N2]', [H2]' |
| [N2] = 0,3моль/м3 [H2] = 0,9моль/м3 [NH3] = 0,4моль/м3 |
Из уравнения видно, что для образования 2 моль NH3 расходуется 1 моль N2 и 3 моль Н2. К моменту достижения равновесия в смеси образовалось 0,4 моль NH3, то есть прореагировало
1 × 0,4/2 моль N2 и 3×0,4/2 моль Н2.
Учитывая равновесные концентрации веществ
[N2]' = 1 × 0,4/2 + 0,3 = 0,5 моль/м3
[H2]' = 3 × 0,4/2 + 0,9 = 1,5 моль/м3
Пример 2
 Константа равновесия КС реакции SO2 + Cl2 SO2Cl2, при 102°С равна 13,33.
Константа равновесия КС реакции SO2 + Cl2 SO2Cl2, при 102°С равна 13,33.
Определить КР при данной температуре.
KP = KC(RT)Dn
| KP - ? | Си | Dn = 1 – (1+1) = – 1
KP = 13,33 × (8,314 × 373)-1 » 4,3 × 10-3 |
| KC = 13,33 t = 102°C R = 8,314Дж/моль×К | 375°С |
Пример 3
В какую сторону сместится равновесие реакции
 N2O4 2NO2 – 56,98 кДж
N2O4 2NO2 – 56,98 кДж
1) при повышении температуры
2) при понижении давления
3) при увеличении концентрации NO2
Данная задача решается по принципу Ле-Шателье:
1) прямая реакция эндотермическая Þ при Т химическое равновесие будет смещаться вправо (в сторону эндотермической реакции).
2) прямая реакция идёт с увеличением числа моль вещества, поэтому при понижении Р равновесие сместиться вправо.
3) при увеличении [NO2], равновесие будет смещаться в сторону той реакции, которая идёт на расходование этого вещества, то есть влево.
Пример 4
Изменением каких факторов можно осуществить сдвиг равновесия вправо у реакции
 СО2 + Ств 2СО – 160,5 кДж.
СО2 + Ств 2СО – 160,5 кДж.
Прямая реакция эндотермическая, идёт с увеличением числа моль газообразных веществ (СО2 и СО) Þ необходимо:
1) повысить Т
2) понизить давление
3) увеличить концентрацию исходных веществ СО2 и С, уменьшить продукта СО.
Пример 5
 Для реакции СН3СООН + С2Н5ОН СН3СООС2Н5 + Н2О при 25°С КС = 4. В каком направлении протекает реакция, если массы веществ равны: уксусной кислоты 50кг, 27кг спирта, 37кг эфира и 54кг воды.
Для реакции СН3СООН + С2Н5ОН СН3СООС2Н5 + Н2О при 25°С КС = 4. В каком направлении протекает реакция, если массы веществ равны: уксусной кислоты 50кг, 27кг спирта, 37кг эфира и 54кг воды.
| DF - ? | Задача на уравнение изотермы Вант Гоффа. |
| T = 298 K KC = 4 m k = 50кг m СН = 27кг m эф = 37кг m в = 54кг R = 8,314Дж/моль×К | Так как объём в системе не меняется, то вместо молярной концентрации можно использовать количество вещества (моль).
 
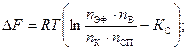
|
пэф = mэф/ Mэф Мэф = 10-3(12 × 4 + 16 × 2 + 8) = 88 ×10-3кг/моль
пв = mв/ Mв Мв = 10-3(2 + 16) = 18×10-3кг/моль
пк = mк/ Mк Мк = 10-3(12×2 + 16×2 + 4) = 60×10-3кг/моль
пв = mв/ Mв Мсп = 10-3(12×2 + 16 + 6) = 46 × 10-3кг/моль
пк = 50/60×10-3 = 0,83×103моль
пв = 54/18×10-3 = 3×103моль
пэф = 37/88×10-3 = 0,42×103моль
псп = 27/46 × 10-3 = 0,59моль
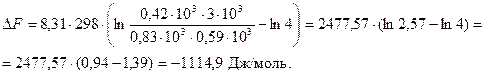
D F < 0 Þ реакция протекает в прямом направлении.
Пример 6
 Константа равновесия КР для реакции I2 2I при t1 = 677°C равна 1,149 × 102, а при t2 = 777°C 7,413 × 102. Определить тепловой эффект реакции.
Константа равновесия КР для реакции I2 2I при t1 = 677°C равна 1,149 × 102, а при t2 = 777°C 7,413 × 102. Определить тепловой эффект реакции.
| DНр° - ? | Си | Для решения задачи используем уравнение изобары D H = 2,3lg ((7,413×102×8,314×1050×950)/(1,149×102(-100))) = 154600 Дж/моль = 154,6 кДж/моль. |
| t1 = 677°C t2 = 777°C KP1 = 1,149×102 KP2 = 7,413×102 | 950K 1050K |
Вопросы для самоконтроля
1. Назовите признаки химического равновесия.
2. Приведите примеры обратимых и необратимых реакций.
3. Что понимают под термином химическое сродство.
4.  Перечислите условия, которые необходимо создать для большего выхода продуктов реакции: СН4(г) + Н2О(г) СО(г) + 3Н2(г) + Q
Перечислите условия, которые необходимо создать для большего выхода продуктов реакции: СН4(г) + Н2О(г) СО(г) + 3Н2(г) + Q
Тема 1.6. Фазовое равновесие
Фазовыми равновесиями называются гетерогенные равновесия, то есть состояния, при которых переход веществ из одной фазы в другую не сопровождается изменением их химического состава (кристаллизация, парообразования и т.д.)
Американский учёный Гиббс вывел правило фаз, которое устанавливает при каких условиях (t°, P, C) отдельные однородные участки гетерогенных систем (фазы) находятся в состоянии термодинамического равновесия.
С + Ф = К n + n.
Ф – число фаз – совокупность гомогенных частей системы, обладающих одинаковыми термодинамическими свойствами и которые отделены от других частей системы видимыми поверхностями раздела.
К n – число независимых компонентов – минимальное число компонентов, достаточное для построения любой фазовой системы.
Для физических систем (системы, в которых происходят фазовые превращения, не химические). К n = K
K – число компонентов в системе (химических соединений).
Для химических систем (системы, в которых протекают химические реакции).
К n = K минус число химических реакций.
С – число степеней свободы – это наибольшее число факторов (t°, P, C), которое можно произвольно менять без числа фаз в системе (фазовых равновесий).
n – число внешних факторов
С + Ф = К n + 2 (для неконденсированных систем)
С + Ф = К n + 1 (для конденсированных систем)
При изучении гетерогенных равновесий используют фазовые диаграммы – диаграммы состояния системы и фазовых равновесий в ней в зависимости от внешних условий (t°, P) или от состава системы.
Диаграммы состояния строятся в масштабе по экспериментальным данным и позволяет определить состояние системы при любых заданных условиях.
Примеры решения задач
Пример 1
Определить число степеней свободы для системы, состоящей из N2, H2, O2
Решение:
Система гомогенная (физически однородная) Þ Ф = 1 (любая смесь газов составляет однородную систему).
Система физическая (нет химических реакций) К n = К К = 3 (N2, H2, O2).
Система неконденсированная n = 2.
C = Kn + 2 – Ф; C = 3 + 2 – 1 = 4 – т.е. система тетравариантная – это означает, что в данной фазовой системе можно произвольно менять 4 фактора и при этом не произойдёт сдвиг фазового равновесия, то есть в системе число фаз будет = 1.
Пример 2
Определить число степеней свободы для системы


Ф = 3 (тв, ж, газ)
К n = 1 (H2O)
n = 2 (система неконденсированная)
С = Кn + 2 – Ф = 1 + 2 – 3 = 0 – система безвариантная.
Данная физическая система существует при строго определённых условиях, если изменить одно из условий, при которых система находится в равновесии, то число фаз в системе нарушится.
Пример 3
Определить число степеней свободы для системы
С aCO3(тв) ® С aO(тв) + СО2(г).
Ф = 3 (любое твёрдое вещество определяет собственную фазу)
К n = K – 1 (одна химическая реакция)
К n = 3 -1 = 2
n = 2 (система неконденсированная, то есть имеется газовая фаз)
С = Кn + 2 – Ф = 2+2-3 = 1 – система моновариантная, то есть можно произвольно менять только 1 фактор (t°), чтобы не произошло сдвига фазового равновесия, а 2 фактор (Р) будет строго зависеть от изменения первого фактора.
Вопросы для самоконтроля
1. Проанализируйте фазовую диаграмму однокомпонентной системы не примере воды. Определите число степеней свободы на каждом из трёх полей фазовой диаграммы, на каждой линии, которые делят область диаграммы на 3 поля, в тройной точке.
2. Проанализируйте фазовую диаграмму двухкомпонентной системы на примере сплавов двух металлов. Какой сплав называется эвтектическим.
3. Проанализируйте фазовую диаграмму водно-солевой системы.
Растворы
Растворами называют гомогенную часть многокомпонентной системы, состав которой может произвольно меняться, относительное содержание компонентов в растворе может быть любым.
Состав – основная характеристика растворов, выражается:
1) в относительных единицах х i = п i / пр-ра – молярная доля х1 + х2 + … хк = 1(100%)
2) в специальных:
а) молярная концентрация
с i = п i / Vр-ра [c] = 1 моль/л = М(молярность)
n- количество растворённого вещества
V – объём раствора
б) моляльная концентрация
mi = ai /(Mi × g) [mi] = 1 моль/кг = 1 Мл (моляльность)
g– масса растворителя
а i, M i – масса, молярная масса растворённого вещества.
Моляльная концентрация определяется число моль вещества, растворённых в 1кг растворителя.
В растворах наблюдается диффузия растворённого вещества и растворителя, это приводит к выравниванию концентрации в объёме раствора.
Если отделить раствор от растворителя через мембрану (полупроницаемую перегородку типа сита), то наблюдается односторонняя диффузия растворителя к раствору, которая называется осмосом. А давление частиц растворённого вещества на мембрану называется осмотическим давлением.
Вант – Гофф (1887г) установил закон:
Осмотическое давление π(пи) пропорционально молярности раствора и температуре
π = с RT - для растворов неэлектролитов.
π = iс RT – для электролитов.
i– изотонический коэффициент, поправка на диссоциацию.
i = 1 + a(К - 1)
a - степень диссоциации
К–число ионов, на которое распадается электролит, например
К (NaCl) = 2; K(K2SO4) = 3
[ π ] = Па .
Давление пара над жидкостью зависит от испаряемости и температуры. Давление пара над чистым растворителем РА° всегда выше давления пара над раствором с нелетучим компонентом РА.
РА° > PA PA° – PA = DP
Рауль (1884г) устанавливает закон: РА = РА °ХА – первый закон Рауля.
Давление пара над раствором нелетучего вещества пропорционально мольной доле растворителя в растворе.
Или после преобразования получим вторую формулу закона Рауля
DР/РА ° = ХВ DР/РА ° - депрессия раствора.
Для растворов электролитов перед Х вводится изотонический коэффициент.
Из-за понижения давления пара растворителя над растворами нелетучих веществ температура замерзания растворов всегда ниже температуры замерзания чистых растворителей, а температура кипения выше.
TЗ > TЗ׳ TЗ׳, TЗ – температура замерзания раствора и растворителя.
DТЗ = ТЗ - ТЗ׳ – понижение Т замерзания
ТК׳ > TK TK׳, TK – температура кипения раствора и растворителя.
DТК = ТК׳ – TK – повышение Т кипения.
Второй закон Рауля устанавливает:
Понижение температуры замерзания и повышение температуры кипения раствора пропорционально моляльности ( m) раствора с нелетучим компонентом.
DТЗ = КК × m
– второй закон Рауля.
D TK = Kэб × m
где КК – криоскопическая постоянная;
Kэб – эбуллиоскопическая постоянная.
Для каждого растворителя имеется своя КК, Kэб (справочная величина).
Для растворов электролитов перед m вводится i.
Многие жидкости можно смешивать в любых пропорциях – неограниченно растворимые жидкости (вода и уксусная кислота), в других случаях – ограниченно растворимые (вода и фенол), в третьем случае взаимонерастворимые жидкости (вода и углеводороды).
В идеальных растворах силы межмолекулярного взаимодействия между молекулами одинаковы, то есть испарение каждой из жидкостей происходит независимо от другой и к каждой из жидкостей применяется 1 закон Рауля.
Рсм = РА + РВ = ХА × РА ° + ХВ × РВ °
Применяя к таким системам закон Дальтона: РА = Рсм ХА n; PB = Pсм ×ХВ n
и 1 закон Рауля РА = РА °ХА; РВ = РА °ХВ
А, В – компоненты смеси (растворённое вещество и растворитель)
ХА n; XBn – молярные доли компонентов в паре над раствором
Получаем закон Рауля – Дальтона: 
РА °/РВ ° = a - относительная испаряемость.
Если a > 1, то относительное содержание компонента А в паре над раствором больше, чем в растворе.
Если a < 1, то наоборот компонента В больше в паре, чем в растворе.
Если a = 1. состав пара над раствором одинаков с составом раствора.
На этом законе основываются процессы перегонки, ректификации. Это массообменные процессы.
Перегонка– общепринятый метод разделения смеси жидкостей на составные части или для выделения какого-либо компонента из сложной смеси, основан на разности температур кипения.
Для увеличения степени разделения компонентов применяют перегонку с дефлегматором.
Ректификация – более эффективный способ разделения, основывается на непрерывном и многократном чередовании испарения жидкости с конденсацией пара в ректификационной колонне.
Эти процессы основываются на законах Коновалова.
Закон Коновалова:
Над двойной жидкой системой пар относительно жидкости богаче тем компонентом, прибавление которого к системе повышает общее давление пара – понижает температуру кипения смеси при данном давлении.
2 закон Коновалова:
Экстремумы ( max или min) на кривых давления пара над растворами соответствуют жидкости и пару с одинаковым составом.
Растворы, состав которых отвечает указанным экстремальным точкам, называют азеотропными смесями – нераздельно кипящие смеси (то есть разделить их простой перегонкой невозможно), с одинаковым составом жидкости и пара.
Перегонка с водяным паром используется для снижения температуры перегонки, то есть смесь кипит при Т = const, которая ниже самого низкокипящего компонента – воды (вещество А). Тперегонки < 100°C.
Используя закон Дальтона Р i Vсм = miRT/ Mi. можно вывести формулу расходного коэффициента Х: 
Он выражает массу водяного пара (mA), приходящееся на 1кг пара органического вещества (mB) в паре над смесью.
МА, МВ – молярные массы воды и органического вещества.
Если в систему, состоящую из двух взаимонерастворимых жидкостей ввести третье вещество, которое растворимо в обеих жидкостях, то оно распределится между ними определённым образом.
В 1890г. Нернст сформулировал закон распределения.
При Т = const отношение концентраций вещества (третьего компонента), растворённого в двух фазах, постоянно.
c1/с2 = K K – коэффициент распределения.
(с1) n/с2 = К – закон распределения Шилова.
n – const, зависит от Т, природы всех компонентов.
На законе распределения основан метод экстрагирования или экстракция – способ извлечения веществ из сложных систем, обработкой их селективным растворителем – выборочным экстрагентом.
В результате экстракции образуется экстракт – раствор извлечённых компонентов в экстрагенте и рафинат – обработанная смесь, обеднённая извлекаемым компонентом (исходная смесь).
Экстракцию обычно ведут ступенчато, n-кратно.
Расчёты ведут по формуле: 
где V0 – объём исходного раствора, в котором находится извлекаемый компонент;
VЭ – объем экстрагента;
К – коэффициент распределения;
g0 – масса экстрагируемого вещества в исходном растворе;
g1 – масса экстрагируемого вещества в рафинате;
g0 – g1 – масса экстрагируемого вещества в экстракте;
п – число ступеней экстракции.
При соприкосновении газа с жидкостью происходит поглощение газов жидкостью – процесс абсорбции.
Этот процесс характеризуется коэффициентом абсорбции a - это тот объём газа, приведённый к н.у., который приходится на 1 объём жидкости при нормальном давлении и данной Т.
Зависимость растворимости газа от давления выражается законом Генри:
При Т = const растворимость газа в жидкости прямо пропорциональна давлению этого газа над раствором.
Сж = К Р - закон Генри
где Сж – концентрация газа в жидкости
Р – давление этого газа
К – коэффициент Генри.
При T = const сж/сг = S
где сг – концентрация газа в газовой фазе.
S – коэффициент растворимости.
Взаимосвязь между a и S выражается следующей формулой: S/ a = Т/Т0
Для газовой смеси используется закон Генри-Дальтона:
с i = K'Pi
При T = const растворимость каждого компонента идеальной газовой смеси в жидкости прямо пропорциональна давлению этого газа (парциальное Р) в смеси газов над раствором.
Примеры решения задач
Пример 1
Вычислить молярную массу мочевины, если водный раствор, содержащий 0,3680г мочевины в 200см3 при 20°С имеет осмотическое давление 74630Па.
| M - ? | Си | В данной задаче используется закон Вант – Гоффа. Мочевина – не электролит Þ используем формулу π = с RT с = п/ V ; п = m / M Þ c = m /( M · V ) Þ π = mRT/(M·V) отсюда М = mRT /( π· V ) |
| m = 0,368г V = 200cм3 t = 20°C π = 74630Па R = 8,314 Дж/(моль×К) | 0,368×10-3кг 200×10-6м3 293К |
Пример 2
Вычислить давление пара раствора, содержащего 8г нафталина С10Н8 в 100г бензола при 20°С. Давление пара бензола при данной Т равно 9,99×105Па.
| Рб - ? | Си | Задача на 1 закон Рауля Рб = Рб ° · Хб; Хб = пб/(пб + пн) пб = m б /Мб Мб = 78 × 10-3кг/моль пн = m н /Мн Мн = 128×10-3кг/моль пн = 8 × 10-3/(128 × 10-3) = 0,062 моль пб = 100 × 10-3/(78×10-3)= 1,282 моль Хб = 1,282/(1,282+0,062) = 0,954 Рб = 9,99×105 × 0,954 = 9,529 × 105 Па |
| mн = 8г mб = 100г t = 20°C Pб° = 9,99×105Па | 8×10-3кг 100×10-3кг |
Пример 3
Давление пара диэтилового эфира (С2Н5)2О при 20°С равно 58920Па, а давление пара раствора, содержащего 12,4г бензойной кислоты в 100г эфира 54790Па.
Вычислить молярную массу бензойной кислоты в эфире.
| MК - ? | Cu | Для решения задачи используем 1 закон Рауля. Найти ХЭФ найдём и МК Рэф = РЭФ° × ХЭФ. ХЭФ = РЭФ/РЭФ° ; ХЭФ = 54790/58920 = = 0,93 ХЭФ= пЭФ/( mЭФ + mК). Необходимо найти пК; так как пК = mК/ MК |
| PЭФ° = 58920Па РЭФ = 54790Па t = 20°C mК = 12,4г mЭФ = 100г MЭФ = 74 × 10-3кг/моль | 12,4 × 10-3кг 100 × 10-3кг |
mЭФ+ mК = nЭФ/хЭФ; пК= (пЭФ/хЭФ) - пЭФ.
пЭФ = mЭФ/ MЭФ = 100×10-3/74×10-3 = 1,35
пК = (1,35/0,93) – 1,35 = 1,45–1,35 = 0,1 Þ МК= 12,4×10-3/0,1=
= 124×10-3кг/моль
При решении задач на 1 закон Рауля необходимо понять, что для растворов электролитов перед концентрацией или мольной долей используется i = 1 + a( K - 1). А также при решении задач можно использовать первую и вторую формулы закона Рауля.
Пример 4
Какое количество метилового спирта СН3ОН(кг) необходимо добавить к 1кг воды, чтобы раствор замерзал при t = –20°. Криоскопическая постоянная воды 1,85.
| а – ? | Си | При решении задачи используется 2 закон Рауля D ТЗ = КК × m ; m = a /(M × g); D T З = КК × а/(М × g) a = D T × M × g/KK D T = T З - ТЗ ’ D T = 273 – 253 = 20K a = (20×32×10-3×1)/1,85 = 0,346кг |
| g = 1 кг T'З = 20°С Кк = 1,85 ТЗ = 0°С М(СН3ОН) = 32×10-3 кг/моль | 253К 273К |
Пример 5
Рассчитать степень диссоциации 0,05 моляльного раствора Pb(NO3)2, если он замерзает при температуре – 0,24°С. Растворитель вода. Криоскопическая постоянная 1,85.
| a - ? | Cu | Используем 2 закон Рауля, так как раствор электролит, то используем в формуле i 1) DT З = i KK × m из формулы можно найти i, а изотонический коэффициент связан со степенью диссоциации. 2) i = 1 + a (K - 1) |
| ТЗ'= - 0,24°С ТЗ = 0°С m = 0,05мл КК = 1,85 | 272,76К 273К |
i = DTЗ /КК × m ; DTЗ = ТЗ – ТЗ' = 273 – 272,76 = 0,24K
i = 0,24/1,85×0,05 = 2,59
a = (i – 1)/(K - 1); K(Pb(NO3)2) = 3 иона
a = (2,59 – 1)/(3 – 1) » 0,8 = 80%
Пример 6
Рассчитать состав пара при 27°С в молярных долях над смесью бензола и толуола, содержащей 0,7 молярных долей бензола. При 27°С давление пара чистого бензола 20000Па, толуола 5000Па.
| ХбП - ? XтП - ? | Используем законы Дальтона PБ = PСМ× ХБП ХБП = РБ/РСМ; ХТП = 1 – XБП Для того, чтобы найти состав бензола и толуола в паре, необходимо определить РСМ = РБ + РТ, а для того, чтобы определить РСМ, необходимо знать парциальные давления бензола и толуола, для их определения применяем 1 закон Рауля. РБ = РБ° ×ХБ РТ = РТ° ×ХТ; ХТ = 1 - ХБ |
| Xб = 0,7 t = 27°C Pб° = 2×104Па Рт° = 5×103Па |
Производим расчёты
РБ = 2×104×0,7 = 1,4×104 Па
РТ= 5×103×0,3 = 1,5×103 Па
РСМ = 14×103 + 1,5×103 = 15,5×103 Па
ХБП = РБ/РСМ ; ХБП = 14×103/15,5×103 = 0,9; ХТП= 1 – 0,9 = 0,1.
Пример 7
Какой из компонентов будет содержаться в дистилляте, если смесь состоит из уксусной кислоты и воды, подчиняется закону Рауля. При t° = 100°С Р воды 760 мм.рт.ст., а уксусной кислоты 400мм.рт.ст.
| a - ? | Си | В данной задаче необходимо определить коэффициент относительной летучести, используя закон Рауля – Дальтона.
|
| t = 100°C Pв° =760мм.рт.ст. Рк = 400мм.рт.ст. | 373K 101325Па 53328,95Па |
применяя его к данной задаче получим:
a = РВ°/РК° ; a = 101325/53328,95 » 1,9.
Так как a > 1, то относительное содержание воды в паре (а следовательно и в дистилляте будет больше, чем в растворе.
Пример 8
Бромбензол от высококипящих примесей очищают перегонкой с водяным паром. Рассчитать расходный коэффициент водяного пара, если при температуре перегонки равной 94°С, давление паров воды рано 620мм.рт.ст., а давление бромбензола 110мм.рт.ст.
| Х - ? | Cu | В данной задаче используется формула расходного коэффициента
|
| tп = 94°С Pв° = 620мм.рт.ст. Рб = 110мм.рт.ст. | 367 К 82659,87Па 14665,46Па |
МВ = 18×10-3 кг/моль
М(С6Н5Br) = 157×10-3 кг/моль
Х = 82659,87×18×10-3/(14665,46×157×10-3) = 0,65
То есть на 1кг бромбензола берётся 0,65 кг воды для очистки от высококипящих жидкостей.
Пример 9
Определить какое максимальное количество I2 можно извлечь из 10м3 минеральной воды, если концентрация йода в ней равна 3 × 10-3моль/л, экстрагент хлороформ, объёмом 0,1м3. Коэффициент распределения равен 0,0075. При одноступенчатой и четырёхступенчатой экстракции.
| 1) g0-g1 2) g0-g4 | Cи | Данная задача на процесс экстракции, расчёты проводят по формуле:
|
| C(I2)=3ּ10-3 моль/л Vэ=0,1м3 V0= 10м3 К=0,0075 М(I2)=254ּ10-3кг/моль | 3моль/м3 |
Решение:
1) Находим g0 – масса экстрагируемого вещества (I2) в исходном растворе.
g0 = n × M; С = n/ V0; n = С × V0 ; g0 = С V0M
g0 = 3 × 10 × 254 ×10-3 = 7,62 кг
2) Находим g1 – масса I2 в рафинате
g1 = 7,62×0,0075×10/(0,1 + 0,0075×10) = 3,26 кг
3) Находим g0 – g1 – массу I2, которое можно извлечь при 1-ступенчатой экстракции
g0 – g1 = 7,62 – 3,26 = 4,36 (кг)
При 4-х ступенчатой экстракции в каждой ступени используется объём экстрагента = VЭ = 0,025м3

g 0 – g 4 = 7,62 – 2,41 = 5,21 (кг), то есть при 4-х ступенчатой экстракции извлекают большее количество I2, чем при 1-ступенчатой.
Пример 10
Коэффициент распределения янтарной кислоты между водой и эфиром равен 6. Концентрация янтарной кислоты в воде равна 48 моль/м3. Определить концентрацию янтарной кислоты в эфире.
| СЭФ - ? | Используем закон распределения Нернста К = С1/С2 Для данной задачи К = СВ /СЭФ ; СЭФ = СВ/К СЭФ = 48/6 = 8 моль/м3 |
| К = 6 СВ = 48моль/м3 |
Пример 11
Коэффициент растворимости ацетилена в воде при 30°С равен 0,93. Вычислить коэффициент абсорбции.
| a - ? | S/ a = T/T0 a = S × T0/T a = 0,93×273/303 = 0,84. |
| S = 0,93 T = 303K T0 = 273K |
Вопросы для самоконтроля
1. Назовите причины понижения давления пара растворителя над раствором с нелетучим компонентом.
2. На чём основано действие антифризов?
3. Проанализируйте диаграммы состояния 2-х компонентной системы для идеальной смеси (Р – состав), (Т кипения – состав).
4. Назовите условия проведения ректификации.
5. Системы с отклонениями от закона Рауля. Проанализируйте диаграммы состояния 2-х компонентных реальных смесей (Р – состав; Т кипения – состав). Азеотропная смесь.
6. Особенности перегонки.
7. Почему при повышении температуры растворимость газов уменьшается?
Тема 1.8. Электрохимия
Этот раздел физической химии изучает закономерности и взаимные превращения между электрической и химической энергии.
Вещества, которые проводят электрический ток называются проводниками.
Проводники I рода – металлы и их сплавы.
Проводники II рода – растворы и расплавы электролитов.
При погружении металла (электрод) в полярный растворитель на границе раздела фаз возникает скачок потенциала j (фи), за счёт образования двойного электрического слоя, он в свою очередь образуется за счёт взаимодействия электрода с раствором, при этом происходит переход катионов металла с электрода в раствор или наоборот, то есть скачок потенциала, который возникает на границе электрод-раствор при условии равновесия между электродом и раствором называется равновесным электродным потенциалом.
Он рассчитывается по формуле Нернста:
 – формула для концентрированных растворов.
– формула для концентрированных растворов.
где j i ° - нормальный электродный потенциал;
F – число Фарадея (1F = 96500 Кл/моль);
Zi – степень окисления – восстановления ионов;
ai – активность ионов i в растворе.
j i ° - потенциал данного металла, погружённого в раствор при t = 25°С с активностью ai = 1.
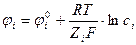 – формула для разбавленных растворов.
– формула для разбавленных растворов.
Если металлы расположить в порядке возрастания их нормальных электродных потенциалов, то получим электрохимический ряд напряжения металлов или ряд химической активности:
Li, K, Ca, Na, Mg, Al, Mn, Zn, Fe, Ni, H2, Cu, Ag, Au.
j ° каждого металла дано в справочной литературе.
j °(Н2) = 0.
У металлов до Н2 j ° < 0, после Н2 j ° > 0.
Устройство, в котором химическая энергия (то есть энергия химических реакций) превращается в электрическую называется гальваническим элементом.
В них непрерывно протекают окислительно-восстановительные процессы. На электродах поддерживается разность потенциалов, которая определяет ЭДС – электродвижущую силу элемента:
ЭДС = j2 – j1
где j2 – потенциал положительного электрода (анода)
j1 – потенциал отрицательного электрода (катода).
ЭДС является мерой способности гальванического элемента совершать электрическую работу.
Для измерения ЭДС применяют компенсационный метод, при котором разность потенциалов на концах цепи компенсируется выверенной по эталону разностью потенциалов от внешнего источника тока. В качестве эталона используют элемент Вестона ЭДС, которого равна 1,0183В. Расчёт ЭДС гальванического элемента определяют по формуле:

где lэт – положение контакта на реохорде эталона;
lх – положение контакта на реохорде элемента, ЭДС которого определяют
Электролизом называют совокупность окислительно-восстановительных процессов, протекающих у катода и анода при прохождении постоянного электрического тока через растворы или расплавы электролитов.
Протекание первичных анодных и катодных процессов подчиняются законам Фарадея.
Закон Фарадея
Масса вещества ( m), выделяемая на электроде прямо пропорциональна количеству электричества ( Q), прошедшего через электролит.
m = К ּ Q Q = K ּ I ּ t
где[Q] = 1Кл (Кулон)
I – сила тока, А (Ампер)
t - время, с
К – электрохимический эквивалент.
Закон Фарадея
Количество различных веществ, прореагировавших при электролизе на электродах под действием одинакового количества электричества, пропорциональны их химическим эквивалентам .
m1/ m2 = Э1/Э2
Для выделения 1 эквивалента вещества требуется пропустить через электролит одно и то же количество электричества – число Фарадея .
F = 96500 Кл/моль
Объединённое выражение 1,2 закона Фарадея: m = Э × I t/ F
Результаты расчётов и опыта отличаются, поэтому вводят поправочный коэффициент – выход по току h.
h = mпр×100% / mтеор; h = Qтеор × 100% / Qпр.
где Mпр, mтеор – масса фактически выделенного вещества и масса, рассчитанная по закону Фарадея.
Qпр – количество электричества, практически затраченного на выделение данного количества вещества.
Qтеор– количество электричества, необходимое по закону Фарадея.
То есть закон Фарадея можно представить в виде формулы:
mпр = h ×Э × I × t/ F
Примеры решения задач
Пример 1
Ток, проходя через раствор кислоты выделяет за 3мин 50см3 водорода, измеренных при 17°С под давлением 99300Па. Рассчитать силу тока.
| I - ? | Си | 1) Силу тока рассчитывают по объёдинённому закону Фарадея 2) m = Э×I t/F; I = m×F/Э t Э(Н) = 1 3) Сначала необходимо найти массу вещества из уравнения состояния идеального газа PV = mRT /М; m = PVM / RT |
| t = 3 мин V = 50см3 t = 17°C P = 99300 Па R = 8,314 Дж/(моль×К) F = 9,65×104Кл/экв М(Н2) = 2г/моль | 180с 50×10-6м3 290К |
Пример 2
При рафинировании меди ток 50А выделяет за 4 часа 224г меди. Рассчитать выход по току.
| h - ? | Си | 1) По закону Фарадея рассчитаем m = Э × I t / F = 32×50×14400/9,65×104 = 237г Э (С u ) = M /п = 64/2 = 32 2) h = m пр × 100%/ m теор ; h = 224×100%/237 = 94,45% |
| t = 4ч mпр = 224г I = 50А F = 9,65× 104Кл/моль | 14400с |
Пример 3
Вычислить ЭДС гальванического элемента при 25°С.
Ag/AgNO3//NiSO4/Ni
Концентрация раствора AgNO3 m1 = 0,005 моль/1000 г Н2О, раствора NiSO4 m2 = 0,1 моль/1000 г Н2О. Коэффициент активности для AgNO3 = 0,925, для NiSO4 = 0 ,15.
| Е - ? | 1) ЭДС рассчитываем по формуле Е = j 2 - j 1 2) Рассчитываем по формулам Нернста потенциалы j j2Ag/Ag+= j ° + R × T × lna × (Ag+)/n × F a ( Ag +) =γ × m j0Ag°/Ag+= 0,799 В (табличное значение – приложение № 4) |
| m(AgNO3) = 0,005моль/кг m(NiSO4) = 0,1моль/кг γ(AgNO3) = 0,925 γ(NiSO4) = 0,15 |


a ( Ni2+) = γ × m
j ° Ni/ Ni2+ = - 0,23 В (табличное значение)

Е = j 2 - j 1 = 0,661 – (–0,284) = 0,945В
Вопросы для самоконтроля
1. Прикладное значение электрохимии.
2. Гальванический элемент Якоби – Даниэля, возникновение электрического тока.
3. Концентрационные элементы. Диффузионный потенциал.
4. Электроды сравнения: нормальный водородный электрод, каломельный, хлорсеребряный.
Дата добавления: 2019-02-12; просмотров: 99; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

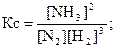





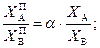 a = PA ° / PB ° ,
a = PA ° / PB ° , 

