Примеры решения задач по теме «Химическая кинетика»
Пример 1
Как измениться скорость прямой и обратной реакции
2NO + O2  2NO2
2NO2
при увеличении давления в 3 раза при T = const.
| υ2/υ1 (прямой) - ? υ2/υ1 (обратной) - ? | В задаче используем закон действия масс υ = k РАа × РВ b Прямая реакция (протекает слева направо) до увеличения Р υ1 = kP2( NO ) P ( O2) после увеличения Р υ2 = k (3 P ( NO ))2× 3 P ( O2) |
| Р2 = 3Р1 |
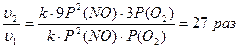
Скорость прямой реакции увеличится в 27 раз.
Для обратной реакции (справа налево):
υ 1 = kP2(NO2); υ 2 = k(3P2(NO2))2

Скорость обратной реакции увеличится в 9 раз.
Пример 2
Константа распада Ra равна 3,79×10-3 с-1. Определить период полураспада и время, за которое Ra распадается на 90%.
| t1/2 - ? t10% - ? | Используем кинетическое уравнение первого порядка: a = 100% (начальная максимальная концентрация Ra). a-x = 100 – 90 = 10% t 10% = (ln(a/(a-x)))/kI t 10% = (ln(100/10))/3,79×10-3 = 607c t 1/2 = ln2/kI t 1/2 = ln2/3,79×10-3 = 183 c |
| kI = 3,79×10-3 c-1 x = 90% |
Пример 3
Во сколько раз увеличиться время, необходимое для завершения реакции, если повысить температуру на 40°С, температурный коэффициент равен 3.
| k2/k1 - ? | Используем правило Вант Гоффа. k2/ k1 = g(t2-t1)/10 k2/ k1= 340/10 = 34 = 81 Скорость увеличится в 81 раз. |
| g = 3 Dt = 40°C |
Вопросы для самоконтроля
1. Почему катализаторы увеличивают скорость химической реакции.
2. Приведите пример, когда порядок реакции не совпадает с молекулярностью.
3. Дайте энергетическую характеристику элементарного акта химической реакции.
|
|
|
Тема 1.4. Поверхностные явлении. Катализ
Катализ – это явление изменений скорости химической реакции в присутствии вещества.
Механизм катализа можно разделить на 5 частей:
1. Диффузия реагирующих веществ к поверхности катализатора
2. Адсорбция на поверхности катализатора реагирующих веществ
3. Химическая реакция
4. Десорбция продуктов реакции
5. Диффузия продуктов от поверхности катализатора
Поэтому прежде, чем говорить о катализе рассмотрим процесс адсорбции.
На поверхности соприкосновения двух фаз идут процессы поглощения частиц одной фазы, другой фазой. Такой процесс называется сорбцией.
Процесс поглощения поверхностью одной фазы частиц из другой фазы называется адсорбцией.
Если поглощение идёт всей массой вещества или объёмом, то процесс называется абсорбцией.
Количественно адсорбция измеряется удельной адсорбцией Г S – это количество поглощаемого вещества (адсорбтива) единицей поверхности адсорбента (вещество, способное поглощать) или единица веса адсорбента:
Г S = п/ S; моль/м2 Г S = п/ m; моль/кг
где п – количество адсорбтива
S – площадь адсорбента
m – масса адсорбента
Адсорбция зависит от:
|
|
|
1) природы адсорбента, адсорбтива
2) температуры
3) концентрации (давления для газа)
Термодинамическое описание адсорбционного равновесия (для систем жидкость-газ; жидкость-жидкость) даётся уравнением изотермы адсорбции Гиббса

где c – равновесная концентрация адсорбтива в среде.
d s/ dc – изменение поверхностного натяжения (s).
1) если d s/ dc < 0 Þ ГS > 0 – идёт процесс положительной адсорбции;
2) если d s/ dc > 0 Þ ГS < 0 – отрицательная адсорбция – десорбция (вещество удаляется от поверхности адсорбента).
Для систем твёрдое тело – газ, твёрдое тело – жидкость удобно пользоваться уравнением изотермы адсорбции Лэнгмюра.
 – для жидкостей;
– для жидкостей;
 – для газов
– для газов
где b – константа адсорбционного равновесия
Г¥ - максимальная адсорбция
Преобразуя уравнение Лэнгмюра
для области малых давлений (концентраций) 
для области высоких давлений (концентраций) 
На процессах адсорбции основаны действия катализаторов.
Катализаторы – это вещества, которые увеличивают скорость реакции.
Катализ – это процесс, при котором скорость реакции изменяется.
Виды катализа: положительный, отрицательный, автокатализ, гомогенный, гетерогенный катализы:
Положительный катализ – это катализ, при котором скорость реакции увеличивается в присутствии катализатора.
|
|
|
Отрицательный катализ – это катализ, при котором - скорость реакции уменьшается в присутствии ингибитора.
Автокатализ – это катализ, при котором катализатор возникает в процессе реакции.
Гомогенный катализ – это катализ, при котором катализатор и реагирующие вещества находятся в одной фазе.
Гетерогенный катализ – это катализ, при котором катализатор и реагирующие вещества находятся в различных фазах.
Особенности катализаторов
1. Катализатор участвует в реакции, образует промежуточное соединение.
2. Катализатор снижает величину Е активации.
3. Количество катализатора << реагирующих веществ.
4. Катализатор одинаково ускоряет прямую и обратную реакцию.
5. Катализатор не изменяет величины теплового эффекта.
6. Катализаторы специфичны.
7. На катализатор влияют примеси - одни активируют (активаторы, промоторы), другие пассивируют (каталитические яды)
8. Катализаторы меняют механизм реакции.
Основные требования, предъявляемые к катализаторам
1. Физическое и химическое сродство к реагентам.
2. Специфичность.
3. Избирательный характер - способность ускорять одну или несколько реакций из возможных химических процессов.
|
|
|
4. Селективность выражается в сравнении каталитических и некаталитических реакций.
5. Активность - оценивается по количеству целевого продукта, полученного с единицы массы или объема катализатора за единицу времени.
6. Способность к регенерации.
7. Доступность и экономичность.
8. Физически и химически устойчив.
9. Термическая стабильность.
10. Прочность.
Факторы, влияющие на активность катализаторов:
1. поверхность катализатора;
2. температура;
3. структура поверхности катализатора.
Катализатор характеризуется активностью В k и селективностью Sk.
Вк = v1/ v2 ; Вк = k1/ k2
где v1, v2 – скорости
k1,k2 – константы скорости реакции в отсутствии и в присутствии катализаторов.
Sk = mц/( mц+ n); Sk = Vц/( Vц+ n)
где mц, Vц - масса, объём целевого продукта
mц+ n, Vц+ n – масса, объём всех веществ, образующихся в ходе реакции.
Вопросы для самоконтроля
1. В чём состоит сущность автокатализа, гомогенного, гетерогенного катализов?
2. Назовите особенности каталитических процессов.
3. Назовите пути повышения активности твёрдого катализатора.
Дата добавления: 2019-02-12; просмотров: 92; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

