Раздел 2. Основы коллоидной химии
Тема 2.1. Дисперсные системы
Коллоидная химия – физическая химия дисперсных систем. Классификация коллоидных систем. Свойства дисперсных систем. Способы получения и очистки дисперсных систем.
Молекулярно-кинетические свойства дисперсных систем. Броуновское движение. Осмотическое давление. Диффузия. Седиментация
Оптические свойства дисперсных систем. Эффект Фарадея-Тиндаля.
Электрокинетические свойства коллоидов. Электроосмос и электрофорез, практическое применение.
Термодинамическая неустойчивость дисперсных систем. Коагуляция (скрытая и явная). Факторы, влияющие на коагуляцию.
Строение и заряд коллоидной частицы.
Грубодисперсные системы (эмульсии, суспензии, пены). Методы получения. Устойчивость, стабилизация и разрушение. Использование в технологических процессах.
Тема 2.2. Растворы высокомолекулярных соединений (В.М.С.)
Растворы высокомолекулярных веществ. Общая характеристика и особенности В.М.С. Термодинамическая устойчивость высокомолекулярных веществ.
Набухание В.М.С. Самопроизвольное образование ВМС при неограниченном набухании. Понятие устойчивости растворов В.М.С. Высаливание. Студнеобразование. Стабилизация дисперсных систем посредством ВМС.
Раздел 1. Физическая химия
Тема 1.1. Молекулярно-кинетическая теория агрегатных
Состояний вещества
Газообразное состояние вещества
|
|
|
Физическое состояние газа определяется параметрами:
Р – давление
V – объём
Т – температура.
Они связаны уравнением состояния идеального газа или уравнением Клапейрона – Менделеева
PV =п RT
где n или n (ню) – количество вещества, моль
R – молярная (универсальная) газовая постоянная.
Её численное значение определяется при нормальных условиях (н.у.):
P0 = 101 325Па (Паскаль) нормальное давление
Т0 = 273К (Кельвин) нормальная температура
Vm – молярный объём, то есть объём 1 моля вещества.
При н.у. 1 моль вещества занимает объём 22,4 × 10-3м3/моль
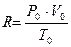 R = 8, 314 Дж/(моль ×К)
R = 8, 314 Дж/(моль ×К)
Применение уравнения состояния идеального газа
Воспользуемся такими понятиями, как:
Количество вещества: п = m/ M; моль
плотность: r = m/ V; кг/м3
концентрация: с = п / V; моль/м3
1. Для определения молярной массы вещества
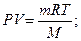
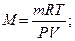
2. Для определения концентрации с = Р/( RT);
3. Для определения плотности 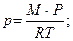
4. Для приведения параметров газа к н.у. 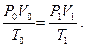
В 1749г в трактате «Размышление о природе теплоты и холода» Ломоносов, исходя из кинетических представлениях о строении материи развил основные положения МКТ:
1. Идеальный газ состоит из материальных точек (маленькие упругие шарики, которые не взаимодействуют между собой, кроме столкновений).
|
|
|
2. Силы межмолекулярного взаимодействия малы, ими пренебрегают. Потенциальная энергия = 0.
3. Движение частиц непрерывно и хаотично, а траектория их линейна.
4. Средняя скорость их поступательного движения при Т=const постоянна и они равномерно заполняют занимаемый объём.
Идеальные газы (т.е. газы, находящиеся при таких условиях, когда можно пренебречь межмолекулярными силами взаимодействия и собственным объёмом молекул газа) подчиняющихся газовым законам:
1. Закон Бойля – Мариотта для изотермического процесса
Т = соnst.
V1/ V2 = P2/ P1
следствия:
с1/с2 = Р1/Р2; r1/ r2 = Р1/Р2
2. Закон Шарля для изохорного процесса V=const
P1/ P2 = T1/ T2
3. Закон Гей – Люссака для изобарного процесса Р = соnst
V1/ V2 = T1/ T2
следствия:
с1/с2 = Т2/Т1; r1/ r2 = Т2/Т1
4. Закон Авогадро
V1/п1 = V2/п2
следствия:
1. При н.у. 1 моль газа занимает объём 22,4 × 10-3м3/моль (Vm)
2. Число молекул, содержащихся в 1 моль называется постоянной Авогадро NA = 6,02 × 1023 молекул
На практике обычные газы отличаются от идеальных, такие газы называют реальными.
Голландский учёный Ван-дер-Ваальс для описания свойств реальных газов ввёл поправки в уравнение Клапейрона – Менделеева.
(Р + а/ Vm2)( Vm - в) = RT
|
|
|
где Р ' = а/ Vm2 – внутреннее давление, которое зависит от сил притяжения между молекулами
в – несжимаемый объём, поправка на собственный объём молекул газа.
а, в = const, табличные значения.
Уменьшая температуру и увеличивая давление газы можно превратить в жидкость. Состояние, при котором газ переходит в жидкость, называется критическим и определяется критическими параметрами: Ркр, Ткр, Vкр – табличные значения.
В критической точке уравнение Ван-дер-Вальса не применимо, используют следующее уравнение:
PV = bп RT
где b – коэффициент сжимаемости газа. Определяется по специальной диаграмме, как функция приведённых параметров (давления и температуры).
П = Р/Ркр; t = Т/Ткр
В технологических процессах используются смеси газов. Физическое состояние газа определяется не только давлением, температурой, объёмом, но и составом.
Способы выражения состава смеси:
1) Объёмная доля j (фи) или ri j i = Vi/ Vcм
Vi – объём компонента в смеси
Vcм – объём смеси.
2) Массовая доля - w (омега) w i = m i/ mсм
m i – масса данного компонента
mсм – масса смеси
3) Молярная доля х (икс) х i = п i/п cм
п i – количество данного компонента
п cм – количество компонента в смеси
|
|
|
для газовой смеси х i = j i
х1+ х2 +… хк = 1 (100%) (к – число компонентов)
4) Молярная концентрация с i =п i/ Vcм
5) Массовая концентрация r i = mi/ Vcм
Газовые смеси подчиняются закону Дальтона
Рсм = Р1 + Р2 + … Рк (к – число компонентов)
Р1, Р2 – парциальные давления (то есть давление, оказываемое каждым компонентом в смеси - Р i)
Рсм = псм RT/ Vсм
Парциальное давление можно рассчитать по формуле:
Р i = xi Pсм
Pi = п i RT/ Vсм
Следствия из закона Дальтона – правило смешения (аддитивности).
1. Свойства газовой смеси равны сумме произведений соответствующих свойств её компонентов на их молярные доли в смеси
А = a1х1 + a2х2 + … a kх k
А – свойство газовой смеси
a1, a2, a k – свойства (соответствующие) компонентов.
2. Молярная масса газовой смеси определяется по формуле
Мсм = М1х1 + М2х2 + … М kх k
М – средняя молярная масса газовой смеси.
М1, М2, М k – молярные массы компонентов смеси
Между молярной и массовой концентрацией существуют формулы взаимосвязи.
 ρ i = Ci Mi =
ρ i = Ci Mi = 
Жидкое состояние вещества
Жидкости занимают промежуточное положение между газами и твёрдыми телами.
Поверхностный слой жидкости, граничащий с другой средой, отличается по свойствам от слоёв, находящихся в объёме жидкости.
Молекулы внутреннего слоя окружены со всех сторон такими же молекулами, то есть силы притяжения взаимоуравновешиваются. Предположим, что жидкость граничит с газом. Молекулы поверхностного слоя находятся под действием сил притяжения со стороны молекул газа и со стороны молекул жидкости (внутренний слой), причем силы притяжения со стороны жидкости больше, чем со стороны газы, таким образом:
Из-за неуравновешенности сил межмолекулярного взаимодействия (сил притяжения) в поверхностном слое всякой жидкости действуют силы, стремящиеся предельно (до min) сократить её поверхность – это силы поверхностного натяжения.
Мерой измерения поверхностного натяжения является коэффициент поверхностного натяжения s (сигма).
s = W/ S – это работа W, которую необходимо затратить на образование единицы новой поверхности S.
[ s] = Дж/м2
или
s = F/ l – это сила F, необходимая и достаточная для предотвращения сокращения длины полосы поверхности жидкости, шириной в 1м – l.
[ s] = Н/м
Факторы, влияющие на поверхностное натяжение:
1. природа жидкости;
2. температура. При повышении температуры поверхностное натяжение уменьшается и достигает нуля при критической температуре (эту зависимость установил в 1860г Д.И. Менделеев и температуру назвал температурой абсолютного кипения жидкостей).
3. примеси: ПАВ – поверхностно активные вещества, они уменьшают поверхностное натяжение жидкости (для воды – это мыла, белки, спирты, аминокислоты)
ПНАВ – поверхностно неактивные вещества, они увеличивают поверхностное натяжение жидкости (для воды – это минеральные кислоты, сульфаты, карбонаты и др. соли)
Используя табличные значения поверхностного натяжения s0 в качестве стандартов, можно определить опытным путём поверхностное натяжение любой жидкости sх.
Наиболее простой способ – сталагмометрический (метод счёта капель).
sх = sо rх nо /( rо nx)
где rо, rх – плотности стандартной и испытуемой жидкости.
nо, x – число капель стандартной и испытуемой жидкости.
При движении одних слоёв жидкости относительно других возникает сопротивление, которое называется внутренним трением или вязкостью.
Вязкость характеризуется коэффициентом внутреннего трения или динамической вязкостью - h (эта).

 - это сила сопротивления F, возникающая между слоями жидкости площадью S = 1м2 при расстоянии между ними Dl = 1м при перемещении их относительно друг друга со скоростью Du = 1м/с.
- это сила сопротивления F, возникающая между слоями жидкости площадью S = 1м2 при расстоянии между ними Dl = 1м при перемещении их относительно друг друга со скоростью Du = 1м/с.

Кинематическая вязкость n учитывает внутреннее сопротивление и плотность r жидкости.
n = h/ r
[ n] = м2/с = 104 Ст (Стокс)
Текучесть – это свойство тела, противоположное вязкости.
f = 1/ h; [ f] = м2/Н ×с = (Па ×с)-1
Вязкость в жидкостях обусловлена внутренним давлением, а в газах – тепловым движением молекул. В газах вязкость мала.
Факторы, влияющие на вязкость:
1. природа жидкости (в гомологических рядах вязкость возрастает)
2. температура (с увеличением температуры вязкость понижается)
3. давление (при повышении давления вязкость возрастает). Вязкость является важным техническим показателем качества смазочных масел, поэтому при подборе масел исследуют их вязкость при низкой и повышенной температуре.
4. концентрация (с увеличением концентрации вязкость возрастает)
Вязкость любой жидкости hх можно определить экспериментально, используя табличные значения вязкости стандартной жидкости hо.
Наиболее простой метод – вискозиметрический метод (метод истечения жидкости).
hх = hо × rх × tх / ( rо × tо)
где tо tх – время истечения стандартной и испытуемой жидкости.
Переход вещества из жидкого состояния в газообразное называется парообразованием.
Формы парообразования:
1. Испарение. Пар образуется только на свободной поверхности жидкости при различных температурах.
2. Кипение. Парообразование протекает по всему объёму жидкости при строго определённой температуре, когда давление насыщенного пара жидкости равно давлению среды.
Температура, при которой жидкость кипит под нормальным давлением (101325Па, 760мм рт.ст., 1атм), называется нормальной температурой кипения.
На процесс парообразования жидкости расходуется энергия, то есть необходим постоянный приток энергии.
Количество теплоты, необходимое для испарения 1 моль жидкости при нормальной температуре кипения называется нормальной молярной теплотой испарения Qисп.,m
Рассчитывается по правилу Троутона
Qm исп = 89,12 × Тк; [Дж/моль∙К]
где Тк – нормальная температура кипения.
Q = nּQm – формула для расчета нормальной теплоты растворения.
Твёрдое состояние вещества
Твёрдые тела могут быть кристаллическими и аморфными.
Кристаллические телаимеют кристаллическую решётку, строго определённую температуру плавления, кристаллизации. Амфорные – не имеют.
Свойства твёрдых кристаллических тел определяются типом кристаллических решёток:
1. Ионная кристаллическая решётка характерна для солей, оксидов
2. Атомная кристаллическая решётка (например, сера, кремний, алмаз)
3. Молекулярная кристаллическая решётка (-это органические твёрдые вещества, лед)
4. Металлическая кристаллическая решётка (это металлы).
Плазменное состояние
Плазма– это ионизированный газ, состоящий из нейтральных молекул и атомов, ионов, электронов и др. частиц. В целом она электронейтральна.
Осуществлением различных химических превращений в плазме занимается плазмохимия.
Примеры решения задач
Пример 1
При 17°С и давлении 104000Па масса 624см3 газа составляет 1,56г.
Определить молярную массу газа.
| M - ? | Cи +273 = 290K
624×10-6 м3 1,56×10-3кг | Задача на применение уравнения состояния идеального газа. PV = nRT M = mRT / PV
|
| t = 17°C P = 104000Па V = 624 cм3 m = 1,56 г R =8,314Дж/моль×К |
Пример 2
Привести объём газа к н.у., если при 22°С и 95940Па объём равен 20л.
| V0 - ? | Cи | Задача на приведение параметров к н.у. (применение уравнения состояния идеального газа)
|
| t1= 22°C P1 = 95940Па V1 = 20л Т0 = 273К Р0 = 101325Па | 295К 20×10-3м3 |
Пример 3
Масса 1м3 азота при 10°С и давлении 9,86×104Па равна 1,175кг. Какова масса этого же объёма азота под давлением 1,092×105 Па при изотермическом процессе.
| m2 - ? | Т.к. изотермический процесс, то задача основана на законе Бойля-Мариотта (следствие) r1/ r2 = Р1/Р2 r = m/ V т.к. V1= V2 Þ m1/ V1: m2/ V2 = P1/ P2 Þ m1/ m2 = P1/ P2; m2 = m1 × P2/P1. m2 = 1,175×1,092×105/9,86×104 » 1,3кг |
| m1 = 1,175 кг V1 = 1 м3 P1 = 9,86×104 Па V1= V2=1 м3 P2 = 1,092×105 Па T = const |
Пример 4
По уравнению Ван-дер-Ваальса вычислить температуру, при которой объём 1 кмоль метана станет равным 2м3 под давлением 2,0265×106 Па.
| T - ? | Си | Решение: |
| п = 1кмоль V = 2 м3 P =2, 0265×106 Па а = 2,28×10-1Дж×м3/моль в = 4,28×10-5 м3/моль | 1×103моль | Используем уравнение Ван-дер-Вальса (Р + а/ Vm 2 )( Vm - в) = RT Вначале рассчитали молярный объём. Vm = V /п, необходимые константы а, в возьмём из приложения 1 |
Vm = 2/(1×103) =2·10-3 м3/моль
Выражаем 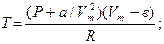


Пример 5
Определить парциальное давление этилбензола в смеси его с водяным паром на входе в реактор дегидрирования, если на 1 кг этилбензола (С8Н10) в смеси приходится 2,6кг воды, температура смеси 605°С, давление 780мм.рт.ст.
| Рэб - ? | Си | Решение: |
| m(эб) = 1кг mв = 2,6кг tсм = 605°С Рсм = 780мм.рт.ст M(в) = 18×10-3кг/моль М(эб) = 106×10-3кг/моль | 878 К 103991 Па |  Задача на определение парциального давления из закона Дальтона.
Задача на определение парциального давления из закона Дальтона.
|
Решение:
1. Р i = xi Pсм;
Р(эб) = x(эб) × Pсм
2. Чтобы определить Р(эб) необходимо знать молярную долю этилбензола.
х i = п i/п cм; хэб = п(эб)/(пэб + пв)
3. Определяем количество этилбензола пэб и количество воды пв по формуле
п= m/ M
пэб = mэб/ Mэб ; пв = mв / Mв
пэб = 1/(106 ×10-3) =9,34 моль
пв = 2,6/(18 ×10-3) = 144 моль
x(эб) =9,34/(9,34+144) = 6,09 ×10–2
Р(эб) =6,09 ×10 -3 × 103991 = 6,38 ×103Па
Пример 6
Определить плотность синтез - газа нижеприведённого состава при 400°С и
Р = 3МПа (Мега Па).
СО – 31,0; Н2 – 51,5; СО2 – 15,0; СН4 = 1,0; N2 – 1,5; %(об.)
| r - ? | Си | Плотность определяем по формуле По правилу смешения находим среднюю молярную массу газовой смеси: Мсм = х(СО) ×М(СО) + х(Н2) ×М(Н2) + М(СО2) ×х(СО2) + х(СН4) ×М(СН4) + + х( N2) ×М( N2) т.к. в газах j I = xi Þ V = п x(CO) = п (CO)/п cм . |
| φ(CO) = 31% φ (H2) =51,5% φ(CO2) = 15,0% φ(CH4) = 1,0% φ(N2) = 1,5% t = 400°C P = 3МПа R = 8,314Дж/моль×К | 0,31 0,515 0,15 0,01 0,015 673К 3×106Па |
Решение:
Находим молярные массы веществ:
M( CO) = 28 ×10-3 кг/моль; М( H2) = 2 ×10-3 кг/моль;
М( CO2) = 44 ×10-3 кг/моль;
М(С H4) = 16 ×10-3 кг/моль; М( N2) = 28 ×10-3 кг/моль.
М = (0,31 ×28+0,515 ×2+0,15 ×44+0,01 ×16+0,015 ×28) ×10-3 = 16,89 ×10-3 (кг/моль)
r = 3×10-6 ×16,89 ×10-3/(8,314 ×673) = 9,06кг/м3
Пример 7
При какой температуре будет происходить кипение гексана в аппарате, давление которого 600мм.рт.ст.
Решение:
По диаграмме (см. приложения) находим tк гексана. Она равна 61°С.
Пример 8
Динамическая вязкость бензола при нормальной Тк равна 0,317Па×с, а плотность 815 кг/м3. Какова его кинематическая вязкость.
| n - ? | n = h/ r n = 0,317/815 = 3,89 ×10-4 (м2/с) = 3,89Ст. |
| h = 0,317Па×с r = 815 кг/м3 |
Пример 9
Определить какое количество теплоты расходуется для очистки методом перегонки 25кг сероуглерода СS2, если tк = 46,3°С.
| Q - ? | Cи | 1. Используем правило Троутона для определения молярной теплоты испарения. Qm = 89,12 × Тк Qm = 89,12×319,3 =28456 Дж/моль » 28,5 кДж/моль 2. Определяем теплоту испарения Q = n×Qm ; n = m/M; n = 25/(76×10–3)»329 моль Q = 329×28,5 = 9376,5 кДж » 9,4МДж |
| tк = 46,3°С m = 25 кг М (СS2) = 76×10–3кг/моль | 319,3K |
Вопросы для самоконтроля
1. Проанализируйте и исправьте обнаруженные ошибки:
а) при V = const давление газа обратно пропорционально температуре;
б) при смешении газов свойство смеси определяется как сумма свойств её компонентов.
2. Назовите основные свойства, отличающие реальный газ от идеального.
3. Почему жидкости практически несжимаемы?
4. Почему для поддержания кипения воды необходим постоянный подогрев?
5. В чём состоит основное различие связей в кристаллах ионного и атомного типа.
Дата добавления: 2019-02-12; просмотров: 115; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

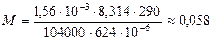 кг/моль
кг/моль 
 ;
;
