Полная энергия любой открытой системы называется энтальпией Н системы.
Н = U + PV; [ H] = Дж
I закон термодинамики имеет следующий вид:
DН = å Q - å W '
åW' – все немеханические работы (химическая, электрическая, адсорбции), исключая работу расширения системы.
Большинство аппаратов в химической технологии работают в режиме:
V, T = const (изохорно-изотермического процесса)
P, T = const (изобарно-изотермического процесса).
То при отсутствии работ поступающая теплота в систему численно равна теплоте, отводимой от системы.
å Qприход = - å Qрасход – формула теплового баланса.
Теплота, работа, внутренняя энергия, энтальпия относятся к термодинамическим функциям.
Рассмотрим эти функции в различных термодинамических процессах.
I Изохорный процесс
V = const P/ T = const – уравнение процесса
W = P D V, так как DV = 0 Þ WV = 0
Q = D U + W Þ QV = D UV
QV = CV D T; D UV = CV D T; D HV = Cp D T
II Изобарный процесс
Р = const V/T = const – уравнение процесса
Wp = P D V = п R D T
 D Hp = Cp D T
D Hp = Cp D T
Þ Qp = D Hp
Qp = Cp D T
D Up = CV D T
III Изотермический процесс
T = const PV = const – уравнение процесса.
Так как температура не изменяется Þ
D UT = 0 D HT = 0
Q = D U + W Þ QT = WT
QT = WT = nRTln( V2/ V1)
QT = WT = nRTln( P1/ P2)
IV Адиабатический процесс
– процесс, в котором система не принимает и не отдаёт тепло в окружающую среду.
 PV g = const
PV g = const
TV g -1= const уравнение процесса
TP1- g/ g = const
Qад = 0
Q = D U + W D Uад = - Wад
D Uад = С V D T
D Hад = Ср DТ
|
|
|

V Политропный процесс
- это реальные процессы, которые протекают в технологических процессах, являются промежуточными выше рассмотренных и в предельных случаях могут быть изохорным, изобарным, изотермическим и адиабатическом процессом.
 PVk = const уравнение процесса
PVk = const уравнение процесса
TVk-1 = const к – показатель политропы
TP(1-k)/ k = const 0 < к < ¥
Термохимия
Термохимия – раздел термодинамики, который изучает тепловые эффекты физических и химических процессов.
Любые процессы чаще всего сопровождаются выделением или поглощением теплоты, то есть тепловым эффектом.
Экзотермическая реакция – это реакция, протекающая с выделением теплоты от системы в окружающую среду (например: реакции окисления, галогенирования, полимеризации).
Эндотермическая реакция – это реакция, протекающая с поглощением теплоты из окружающей среды в систему (например: реакции восстановления, дегидрирования, пиролиз).
Для экзотермических реакций Q< 0
Для эндотермических Q > 0.
В термохимии используются такие понятия, как:
Изохорный тепловой эффект Qv = DU.
Изобарный тепловой эффект Qp = DH.
Взаимосвязь Qp и Qv выражается следующей формулой
Qp = Qv + Dп RT или
Qр = Qv + Р D V
|
|
|
Dп для реакции аА + bB ® сС + dD рассчитывается
D п = (с + d) – ( a + b), учитываются только газообразные вещества.
Для расчётов используют:
1) Стандартный тепловой эффект – теплота химического процесса при стандартных условиях (Т = 298К, Р = 101325 Па), с образованием 1 моль продукта реакции.
2) Стандартную теплоту образования – это тепловой эффект реакции образования 1 моль вещества из простых веществ при стандартных условиях.
Qр, m°,обр = DН m °,обр, так как Р = const.
DН m °,обр(простых веществ: О2, Al, S) = 0
3) Стандартную теплоту сгорания – это тепловой эффект реакции взаимодействия 1 моль вещества с газообразным кислородом при стандартных условиях, с образованием высших оксидов.
Qр, m°,сг = DН m °,сг, так как Р = const.
Эти величины – справочные, но можно рассчитать по формуле Коновалова.
DН m °,сг= -(408,4 n + 44,4 m + å x); кДж/моль
где n – количество кислорода (моль), необходимое для полного сгорания 1 моль вещества.
m – количество воды (моль), которое образуется в ходе реакции.
åх – сумма термических характеристик межатомных связей молекулы вещества (справочные величины). Приложение №2
Основной закон термохимии – закон Гесса:
Суммарный тепловой эффект реакции не зависит от промежуточных состояний и пути перехода, а зависит только от начального и конечного состояния системы.
|
|
|
Следствия:
1) Тепловой эффект реакции равен сумме теплот образования продуктов реакции минус сумма теплот образования исходных веществ с учётом коэффициентов всех участников реакции.
Например: для реакции в общем виде.
аА + bB = сС + dD
где А, В - исходные вещества;
С, D - продукты реакции.
a, b, c, d – коэффициентов в уравнении реакции.
Qp, x = D Hx = (с DН m °,обр С + d DН m °,обр D) – ( a DН m °,обр A + b DН m °,обр B)
2) Тепловой эффект реакции равен сумме теплот сгорания исходных веществ минус сумма теплот сгорания продуктов реакции с учётом коэффициентов всех участников реакции.
Qp, x = D Hx = (а DН m °,сг А + b DН m °,сг B) – ( c DН m °,сг С + d DН m °,сг D)
Тепловой эффект реакции зависит от температуры процесса. Эта зависимость описывается законом Кирхгофа:
DНх T = D H°х + D C° p ( T-298)
где DНх T - тепловой эффект реакции при заданной Т
D H°х – стандартный тепловой эффект
D C° p – изменение стандартной теплоёмкости системы или температурный коэффициент теплового эффекта реакции.
D C°р = (с С° m,р С + d С° m,р D) – ( a С° m,р A + b С° m,р B)
Проанализируем закон Кирхгофа:
Если DC°р>0, то тепловой эффект экзотермической реакции при увеличении температуры уменьшается;
|
|
|
Если DC°р<0, то тепловой эффект экзотермической реакции при увеличении температуры увеличивается;
Если DC°р=0, то тепловой эффект реакции не зависит от температуры.
Второй закон термодинамики
II закон термодинамики выражает качественную неэквивалентность теплоты и работы.
1. Постулат Клаузиуса. Невозможен самопроизвольный переход теплоты от холодного тела к горячему.
2. Постулат Томсона. Процесс, единственным результатом которого является превращение теплоты в работу, невозможен.
3. Первый постулат Планка. Невозможно построить периодически действующую машину, которая бы только охлаждала тепловой резервуар и совершала работу.
4. Второй постулат Планка. Любая форма энергии может полностью преобразоваться в теплоту, но теплота преобразуется в другие виды энергии лишь частично.
Одна из важнейших областей приложения 2-го закона термодинамики – анализ действия устройств, предназначенных для преобразования и передачи энергии: тепловых машин, теплообменников и т.д. Основной технической характеристикой является
КПД – коэффициент полезного действия h.
h = Епол/Езатр
где Епол - энергия, полученная или переданная
Езатр - использованная или затраченная.
КПД характеризует способность тепловой машины трансформировать теплоту в работу.
КПД можно рассчитать по формулам:
h = ( Q1- Q2)/ Q1 = W/ Q1
h = ( T1- T2)/ T1
T1, T2 – температуры теплоотдатчика (нагревателя) и теплоприёмника (холодильника)
Т1 > Т2
Q1 – теплота, отданная нагревателем рабочему телу.
Q2 – теплота, отданная рабочим телом холодильнику.
Q1 > Q2
W – разность теплот Q1 - Q2, преобразованных в работу.
0 £КПД <1
Все тепловые машины работают по циклу Карно.
Теплоту можно представить в виде произведения фактора интенсивности (температура) и фактора экстенсивности (приведённая теплота Q/ T)
Q = T × ( Q/ T)
Q/ T = D S
S – энтропия системы [S] = Дж/К
Она характеризует меру беспорядка в микроструктуре системы (чем хаотичнее система, тем S больше).
Sm – молярная энтропия, для 1 моль вещества Дж/(моль×К)
Sуд – удельная, для 1кг вещества Дж/(кг×К).
По изменению D S можно судить о направлении процесса, если в ходе реакции:
D S > 0 – самопроизвольный процесс (прямой);
D S < 0 – самопроизвольный процесс невозможен;
D S = 0 – равновесие.
Та часть внутренней энергии, которая не способна превращаться в работу называется связанной энергией.
Есвяз = Т × S
Рассмотрим изменение энтропии в некоторых термодинамических системах:
1) Изотермический процесс Т=const
D ST = п R ln(V2/V1)= п Rln(P1/P2)
2) Изобарный процесс Р=const D Sp = Cp ln( T2/ T1)
3) Изохорный процесс V=const D SV = CV ln( T2/ T1)
4) Адиабатический процесс D Sад = 0
5) При фазовом переходе D Sф.п. = DНф.п./ Тф.п.
Учитывая энтропию, можно записать объёдинённое выражение 1,2 закона термодинамики D U = T D S – W
Полезная работа (W') термодинамического процесса – это положительная работа, то есть работа над окружающей средой.
Wполная = Р D V + W '
P D V – работа против внешнего Р.
Только термодинамически обратимый самопроизвольный процесс сопровождается полезной немеханической работой и достигает мах значения, то есть 0 £ W ' £ W 'мах.
Для изохорно-изотермического процесса V, T = const W 'мах = - D F
Для изобарно-изотермического процесса W 'мах = - D G
F, G – сводные энергии системы, то есть энергии, которые превращаются в работу;
F – энергия Гельмгольца или изохорно - изотермический потенциал (Дж);
G – энергия Гиббса или изобарно-изотермический потенциал (Дж).
D F = D U - T D S.
D G = D H - T D S.
По изменению функций D F, D G можно судить о направлении процесса:
1) D F, D G < 0 – возможен самопроизвольный (прямой) процесс.
2) D F, D G > 0 – самопроизвольный процесс невозможен
3) D F, D G = 0 – равновесие.
При самопроизвольном процессе происходит убыль свободной энергии системы (F,G), то есть энергии, способной превращаться в работу и пределом течения таких процессов является минимум свободной энергии системы – этот закон называется принцип минимума свободной энергии.
Элементы термодинамики пара
Процесс парообразования – это переход жидкого состояния в парообразное при P=const.
Этот процесс состоит их трёх стадий:
1) Подогрев жидкости до температуры кипения.
2) Процесс кипения.
3) Перегрев пара.
В процессе кипения образуется влажный насыщенный пар, то есть пар, состоящий из смеси пара и капелек жидкости.
Процесс кипения протекает при T = const.
В конце процесса кипения, когда последняя капля жидкости превращается в пар, образуется сухой насыщенный пар – пар, не содержащий капелек воды.
Для характеристики сухого и влажного пара вводят специальную величину х – степень сухости пара – масса сухого пара, заключённая в 1кг влажного пара.
х = mсух.п./ mвл.п.
(1-х) – степень влажности – это отношение массы жидкости, содержащейся в 1кг влажного пара.
(1-х) = mводы/ mвл.п.
Для жидкости х = 0
Для сухого пара х = 1.
Пример для водяного пара х = 0,9, то есть в 1кг влажного пара содержится 0,9 кг сухого и 0,1кг воды.
Температуры влажного и сухого пара равны Т кипения жидкости.
Если и дальше к сухому пару подводить тепло, то образуется перегретый пар, то есть пар, который имеет более высокую температуру, чем сухой насыщенный пар того же давления.
Все три пара находят широкое применение а различных технологических процессах.
Примеры решения задач по теме:
«Основы термодинамики»
Пример 1
Воздух с исходной t° = 20°C и давлением 0,1МПа сжимается компрессором до 2,5МПа. Определить расход энергии на сжатие (компрессирование) и теплоотвод от компрессора при изотермическом процессе для 1кг.
| W - ? Q - ? | Си | При изотермическом процессе W = Q W =п· R · T · ln ( P 1 / P 2 ) Т.е найдя энергию (работу) найдём и теплоотвод (теплоту). W = 34,48×8,314·ּ293ln -271,36ּ103Дж=-271,36кДж Q= -271,36·ּ103Дж=-271,36кДж |
t° = 20°C
P1 = 0,1 МПа
P2 = 2,5 МПа
R = 8,314 Дж/(моль×К)
М(возд.) = 29ּ10-3 
| 293 K 0,1×106Па 2,5×106Па |
Пример 2
Вычислить расход тепла, необходимый для охлаждения 10кг кислорода от 200 до 0°C, если теплоёмкость его при Р=const в пределах от 0° до 1000°С выражается линейным уравнением Ср,m = 0,6525 + 2,5448×10-4T кДж/(моль×К)
| Q - ? | Си | |
m = 10кг
t1= 200°C
t2 = 0°C
М(О2)= 32ּ10-3 
| 473K 273K | Расход тепла рассчитываем по формуле: Q = C р D T |
Решение:
1) Рассчитываем среднюю молярную теплоёмкость в интервале температур 473 – 273К. Она дана в виде зависимости теплоёмкости от температуры в общем виде С = а + bT
C = 0,6525 + 2,5448×10-4T
Решение данной зависимости:
С = а + ( b( T1+ T2))/2
Cр,т = 0,6525 + (2,5448×10-4(473+273))/2 = 0,7476 (кДж/(кг×К))
2) Находим теплоёмкость системы
Ср = n × Cp, m


С p = 312 × 0,7476 = 234 (Дж/К)
3) Находим расход тепла:

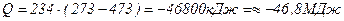
Пример 3
Навеску гидразина (N2H4) массой 1,50×10-3кг сожгли в калориметрической бомбе. Температура калориметра при этом повысилась на 5,85К. Теплоёмкость прибора равна 8,837кДж/К. Определить молярную теплоту.
| Qm - ? | Молярная теплота рассчитывается через молярную теплоёмкость Qm = Cm × D T 1) Находим С m через теплоёмкость системы. С = пС m ; Cm = С/п; п= m / M ; Cm = ( C × M )/ m . Cm = (8,837×32×10-3)/1,5×10-3 = = 188,52кДж/(моль×К) 2) Qm = Cm(T2-T1) Qm = 188,52×5,85 = 1102,86кДж/моль |
| m = 1,50×10-3 кг DТ = 5,85 кг С = 8,837 кДж/К М(N2H4) = 32×10-3кг/моль |
Пример 4
Температура газов пиролиза на входе в зону реакции (плазмотрона) равна 1600°С. Определить необходимый расход воды на закалку (быстрое охлаждение) этих газов в расчёте на 2кг их, если теплоёмкость равна 4,15 кДж/(кг×К). Температура на выходе из зоны закалки 150°С, а t(H2O) на входе в аппарат 20°С, на выходе 100°С. теплоёмкость воды равна 75,3Дж/(моль×К.
| mв - ? | Си | В данной задаче необходимо использовать формулу теплового баланса: Q прих = – Q расх. Q прих – теплота газов пиролиза; Q расх – теплота воды, которая идёт на охлаждение этих газов. Q прих = mг× c удг (Т2г – Т1г) Q расх = nв× cmв (Т2в – Т1в) mг× Судг(Т2г – Т1г) = – nв× cmв (Т2в – Т1в) nв = –( mг× Судг (Т2г – Т1г))/(Судв (Т2в–Т1в)) nв = – (2× 4,15×(423-1873))/( 75,3·10-3 ×(373-293)) » 2·10-3 моль пВ= m В / M В => m В = пВ· M В mВ=2·10-3 · 18·10-3=36кг |
| t1г = 1600°С t2г = 150°С mг = 2 кг Сгуд = 4,15 кДж/(кг×К) Т1воды = 20°С Т2в = 100°С Свm =75,3(Дж/(моль×К) = 75,3·10-3(кДж/(моль×К) М(Н2О)=18·10-3кг/моль | 1873К 423К 293К 373К |
Пример 5
Тепловой эффект образования метана из простых веществ при 25°С Qp0 = – 74,95кДж/моль. Определить изохорный тепловой эффект при той же температуре.
| QV -? | Си | Данная задача на взаимосвязь Qp и Qv |
| Qp = –74,95кДж/моль t = 25°C R = 8,314×10–3кДж/(моль·К) | 298К | Qp = QV + D nRT QV = Qp – D nRT |
Решение:
1) Запишем уравнение реакции Ств + 2Н2 ® СН4
2) Определяем Dп по реакции, учитывая только газообразные вещества.
Dп = п(СН4) – (п (Ств) + п(Н2))
Dп = 1 – (0 + 2) = – 1
QV = – 74,95 – (–1) ×8,314×10-3×298 = – 72,47 кДж/моль.
Пример 6
Пользуясь формулой Коновалова, рассчитать теплоту сгорания 500кг акролеина и определить как изменения теплота сгорания при смене изобарического процесса на изохорический при стандартных условиях.
О
//
СН2=СН-С + 3,5О2(г) ® 3СО2(г) + 2Н2О(ж)
\
Н(г)
| DНсг - ? Qv – Qp - ? | 1) Используем формулу Коновалова; x находим по приложению 2 |
| n = 3,5 моль О2 m = 2 моль Н2О х (дв.св) = 87,9 кДж/моль х (альдег. групп) = 75,3 кДж/моль М(акролеина) = 56×10-3 кг/моль Т = 298К m(акролеина)=500кг | D Н m ° сг = -(408,4 n + 44,4 m + å x ) å x = 87,9 + 75,3 = 163,2 кДж/моль D Н m = –(408,4×3,5 + 44,4×2 + 163,2) = –1681,4 кДж/моль 2) D Н = n D Н m n = m / M D Н=500×(–1681,4)/56×10–3 » 15012,5 (кДж) » 15,01 МДж 3) QV – Qp = – D п RT D п = 3 – (1+3,5) = –1,5 QV – Qp = –(–1,5)×8,314×298 = 3,78×103Дж = 3,78 (кДж) |
Пример 7
Определить теплоту образования сероуглерода C + 2S = CS2, если даны теплоты сгорания веществ.
| DН °,сг - ? | Используем следствие из закона Гесса №2 D Н °,сг= ( D Н m °,сг (С) + D Н m °,сг (S) ) – D Н m °,сг (CS2)) D Н °,сг = -394 + 2×(-297,5) – (-1109,9) = 120,9 (кДж). |
| DН m °,сг (С) = -394 кДж/моль DН m °,сг (S) = -297,5кДж/моль DН m °,сг (CS2)= -1109,9кДж/моль |
Пример 8
Дата добавления: 2019-02-12; просмотров: 99; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!


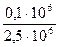 =
=