Модифицированный метод окрашивания по Цилю-Нильсену
Является методом специфической окраски ооцист кокцидий: криптоспоридиев и изоспор.
Необходимое оборудование и реактивы
Предметные стекла обезжиренные желательно с матированным краем
Стеклянные палочки или шпатели
Стеклянные стаканчики объемом 50 мл или контейнеры для окраски мазков на предметных стеклах в вертикальном положении
Мосты для окраски стекол в горизонтальном положении
Кюветы (эмалированные, нержавеющие или пластиковые)
Любая сыворотка
Краска карбол-фуксин
Метиленовый синий или малахитовый зеленый 5%-й раствор
Раствор серной кислоты 7%-й
Смесь Никифорова
Микроскоп
Подготовка к исследованию
1) Подготовка мазков:
1а) каплю жидких нефиксированных фекалий (кокцидии обычно встречаются в жидком или неоформленном стуле) нанести на обезжиренное предметное стекло и равномерно распределить с помощью стеклянной палочки или краем шлифованного стекла;
1б) осадок после формалин-эфирной седиментации суспендировать, каплю осадка смешать с каплей сыворотки для лучшего прилипания, распределить краем шлифованного стекла.
2) Мазки высушить.
3) Зафиксировать в смеси Никифорова (пропись - прилож.8) - 20-30 мин.
4) Окрашивать карбол-фуксином в вертикальном положении (п.1а) или горизонтальном (п.1б) - 30-40 мин для перекрашивания объектов.
5) Промыть мазки в нескольких сменах водопроводной воды в стаканчике!
|
|
|
6) Дифференцировать в растворе кислоты пока не перестанут отходить облачка краски.
7) Промыть дистиллированной водой.
8) На несколько секунд погрузить в раствор метиленового синего или малахитового зеленого для подкраски фона.
9) Повторить п.7.
10) Высушить мазки.
11) Микроскопировать препараты следует при большом увеличении: окуляр  10, объектив
10, объектив  40, предварительно находя похожие по размеру объекты при малом увеличении.
40, предварительно находя похожие по размеру объекты при малом увеличении.
Результаты окрашивания
Ооцисты криптоспоридий - очень мелкие округлые объекты около 3-5 мкм, окрашиваются в красный цвет, внутри определяются овально вытянутые, полукруглые образования - спорозоиты.
Примечание.
1. Микроскопировать постоянно окрашенные препараты можно только после полного высыхания бальзама или его искусственного заменителя! Если ситуация экстренная, можно препарат осторожно микроскопировать с водной иммерсией!
2. Диагностика крупных, имеющих характерную морфологию изоспор не представляет трудностей и возможна любым из рекомендованных методов.
3. Постоянно окрашенные препараты можно длительно хранить. Для этого нужно часть мазков после промывания провести через спирты возрастающей крепости - 50, 70, 95%, карбол-ксилол, ксилол и заключить в канадский бальзам под покровным стеклом.
|
|
|
4. Прописи растворов, реагентов, применяемых в методах исследований, и способы их приготовления приведены в прилож.8.
Диагностические признаки трофозоитов и цист кишечных простейших
Идентификация дизентерийной амебы
Амебиаз - единственная протозойная кишечная инфекция, при которой в процессе паразитирования дизентерийной амебы может возникать особая, доступная для диагностики, морфологическая форма, отражающая развитие патологического процесса в тканях и органах хозяина. Идентификация тканевой (именуемой еще как гематофаг) формы Е. histolytica в слизисто-гнойном, диффузно окрашенном кровью каловом экссудате с адекватностью свидетельствует о наличии специфических поражений кишечника при амебной дизентерии.
В случае подозрения на наличие в препарате каких-либо вегетативных амебных клеток, особенно при исследовании жидких фекалий, слизи с изъязвленного участка кишки при ректоскопии, биопсии и/или при вскрытии абсцесса необходимо провести микроскопию нативного мазка. Следует помнить, что амебы покидают активную зону воспаления и их можно обнаружить в краевых зонах язв или абсцесса. Одновременно с исследованием нативного мазка готовят постоянно окрашенный препарат и производят посев на среду Павловой. Готовые нативные препараты просматривают под микроскопом сначала с малым увеличением, а затем с большим (10  40) для оценки характера движения, выявления ядер и каких-либо включений в цитоплазме.
40) для оценки характера движения, выявления ядер и каких-либо включений в цитоплазме.
|
|
|
Если результат микроскопического изучения нативного мазка приводит к обнаружению трофозоитов, способных к поступательному передвижению путем быстрого формирования гиалиновых прозрачных цитоплазматических выростов (псевдоподий), а мелкозернистая цитоплазма не имеет других включений, кроме заглоченных эритроцитов, то это исследование рассматривается как диагностический критерий идентификации Е. histolytica - ее тканевой формы.
Просветная форма - основная форма существования E. histolytica в кишечнике может быть обнаружена в полуоформленных фекалиях реконвалесцента или носителя. Она никогда не фагоцитирует эритроцитов, в ее цитоплазме содержатся вакуоли с различным содержимым, включая бактерии, что подчеркивает ее комменсальный образ жизни. Движение трофозоитов замедленное благодаря образованию коротких прозрачных стекловидных псевдоподий.
|
|
|
На основе изучения постоянно окрашенных препаратов составлено представление о наиболее типичном распределении хроматина в ядрах трофозоитов и цист различных видов амеб (рис.10).

Рис.10. Схема строения ядер простейших кишечника (постоянно окрашенные препараты по Смиту в модификации Продеус)
В нативном мазке, окрашенном раствором Люголя, более отчетливо различается тонкая структура паразита, а именно проявление ядер, которые в мазке с физиологическим раствором не видны.
Ядерные структуры являются наиболее характерным диагностическим признаком:
 Трофозоит Е. histolytica обычно имеет одно ядро с равномерно распределенным хроматином по внутренней поверхности ядра и обычно центрально расположенной небольшой кариосомой.
Трофозоит Е. histolytica обычно имеет одно ядро с равномерно распределенным хроматином по внутренней поверхности ядра и обычно центрально расположенной небольшой кариосомой.
 Наиболее типичное расположение хроматина в ядрах трофозоитов и цист Е. histolytica и Е. hartmani в отличие от Е. coli представлено равномерным его распределением по внутренней стороне оболочки ядра с центрально расположенной кариосомой.
Наиболее типичное расположение хроматина в ядрах трофозоитов и цист Е. histolytica и Е. hartmani в отличие от Е. coli представлено равномерным его распределением по внутренней стороне оболочки ядра с центрально расположенной кариосомой.
 Ядра трофозоитов и цист I. buetschlii и Е. nana имеют большую, свободно расположенную в кариоплазме кариосому и не содержат хроматин на оболочке ядра.
Ядра трофозоитов и цист I. buetschlii и Е. nana имеют большую, свободно расположенную в кариоплазме кариосому и не содержат хроматин на оболочке ядра.
 Для ядер жгутиконосца D.fragilis характерна концентрация хроматина в виде гранул в центрально локализованной розетке.
Для ядер жгутиконосца D.fragilis характерна концентрация хроматина в виде гранул в центрально локализованной розетке.
Выявление цист Е. histolytica возможно при микроскопических исследованиях препаратов, приготовленных из оформленного кала и окрашенных раствором Люголя. Они представлены клеткой правильной, шарообразной формы с хорошо заметной оболочкой. Содержимое цист включает от 1 до 4 ядер (в зависимости от зрелости), хроматоидные тела (короткие, толстые палочки с округлыми концами) и гликоген, активно вкрапленный в цитоплазму или, реже, заключенный в вакуоль. Обнаружение в препарате четырехядерных цист, даже совместно с просветной формой паразита, характерно для состояния носительства.
В настоящее время общепринятым является положение о том, что Е. histolytica есть видовой комплекс с сохранением истинной патогенной формы, в то время как ее морфологический аналог Entamoeba dispar считается непатогенным эквивалентом. Известно также, что Е. histolytica способна вызвать иммунный ответ в организме хозяина, а Е. dispar нет. Поэтому во всех случаях морфологической идентификации паразита дополнительное проведение серологического теста (РИФ) является оптимальным для диагностики амебиаза.
Идентификация паразитических амеб
Сложность идентификации дизентерийной амебы может быть связана как с наслоением побочного действия антидиарейных и противомикробных препаратов, так и с присутствием в кишечнике других амеб идентичных (Е. dispar, E. moshkovskii) или сходных (Entamoeba coli, Entamoeba hartmanni) с Е. histolytica. Морфология основных видов амеб, паразитирующих в кишечнике человека, представлена на рис.11.
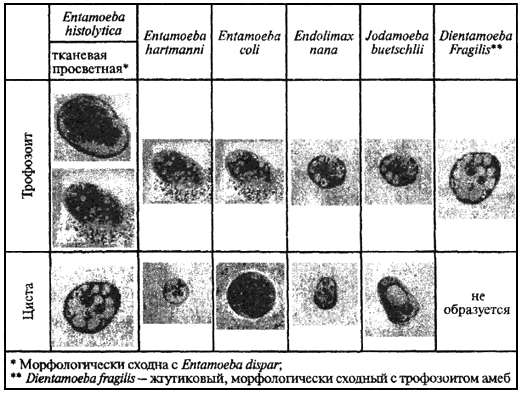
Рис.11. Морфология основных видов амеб кишечника человека*
_______________
* Морфология диагностируемых стадий амеб представлена рисунками Е.Н.Смирновой с препаратов, окрашенных железным гематоксилином.
Трофозоиты всех видов паразитических амеб за исключением тканевой формы Е. histolytica активно питаются бактериями, поэтому цитоплазма амеб весьма вакуолизирована и содержит заглоченные бактерии. Наиболее выраженный "фагоцитоз" характерен для Е. coli.
Вегетативные формы амеб значительно варьируют в размерах: от 8-10 мкм (Е. hartmanni, Е. nana) до 18-20 мкм и выше (Е. coli). Сходный размер с просветной формой Е. histolytica (13-18 мкм) имеют только Jodamoeba buetschli и Dientamoeba fragilis, однако они резко различаются по строению ядер. Таким образом, тканевая и просветная формы дизентерийной амебы могут быть с адекватностью идентифицированы.
Цистные формы амеб могут быть дифференцированы как по размеру, так и по строению ядер. Среди цист большого размера выделяется Е. coli (15-18 мкм). Цисты малого размера (5-8 мкм) - это Е. hartmanni и Е. nana, а Е. histolytica и J. buetschlii относятся к цистам среднего размера (10-13 мкм). Однако они существенно различаются по форме и строению ядра. Кроме того для цист J. buetschlii характерно наличие четко очерченной гликогеновой вакуоли, в то время как в цистах Е. histolytica гликоген чаще всего растворен вкраплениями в цитоплазму. А наличие у Е. histolytica хроматоидных тел характерного вида довершает дифференциальную картину идентификации цист Е. histolytica, морфологического комплекса, обозначаемого как Е. histolytica/E. dispar.
Идентификация паразитических жгутиконосцев
У человека паразитирует несколько видов жгутиковых преимущественно в толстом кишечнике, некоторые из них существуют только в вегетативной форме (Pentatrichomonas hominis). Идентификация вегетативных форм этих организмов осуществляется главным образом при исследовании нативного мазка при малом увеличении микроскопа - окуляр  10, объектив
10, объектив  10 - с последующим изучением препарата, окрашенного раствором Люголя при увеличении: окуляр
10 - с последующим изучением препарата, окрашенного раствором Люголя при увеличении: окуляр  10, объектив
10, объектив  40. Основные критерии идентификации: характер движения, форма и размер паразита с дальнейшей оценкой наличия специальных органелл внутренней структуры клетки. Основные морфологические признаки жгутиконосцев представлены на рис.12.
40. Основные критерии идентификации: характер движения, форма и размер паразита с дальнейшей оценкой наличия специальных органелл внутренней структуры клетки. Основные морфологические признаки жгутиконосцев представлены на рис.12.

Рис.12. Морфология кишечных жгутиконосцев 10 мкм
Pentatrichomonas hominis - кишечная трихомонада - сложно организованная клетка с характерным порхающим, толчкообразным движением за счет 5 жгутиков передней части тела, а также волнообразной перепонки - ундулирующей мембраны, вытянутой вдоль тела более чем на 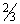 . Аксостиль - опорная нить, заканчивающаяся вне тела небольшим шипиком. Хорошо виден цитостом.
. Аксостиль - опорная нить, заканчивающаяся вне тела небольшим шипиком. Хорошо виден цитостом.
Chilomastix mesnili - как и кишечная трихомонада имеет варьирующие размеры и своеобразную спирально закрученную грушевидную форму тела с 4 жгутами. Организм способен совершать активные буравливающие продвижения внутри кишечного детрита. В препарате можно наблюдать наличие вегетативных форм и цист одновременно. Цисты по форме напоминают лимончик за счет наплыва толстой оболочки клетки. Эти организмы могут интенсивно размножаться при растительной диете человека, образуя массивную популяцию на фоне временных расстройств кишечника.
Lamblia intestinalis - запоминающийся организм с билатеральной симметрией и 4 парами жгутиков. Расширенная передняя часть сформирована своеобразной структурой - присасывательным диском, на фоне которого хорошо видны овальные 2 ядра с крупными, окруженными светлой зоной, эндосомами (рис.12). В отличие от трихомонад и хиломастикса у лямблий цитостом отсутствует. Они питаются осмотически, являясь паразитами тонкого кишечника, закрепляясь на его поверхности при помощи специальных органелл и синусоидального движения (биения) центральных жгутов, хорошо заметных в нативных прижизненных препаратах. Лямблий можно идентифицировать в диарейном, кашицеобразном и оформленном стуле. Отмечена периодичность их выделений в просвет кишечника, что требует повторного лабораторного исследования или использования накопительной пробы.
Идентификация бластоцистов
Blastocystis sp. - бластоцисты - полиморфный паразит толстого кишечника. Различают три существенно варьирующих в размерах формы бластоцистов (от 5 до 20 мкм и более).
Вакуолярная форма - наиболее часто встречаемая форма бластоцистов с четко выделенной центральной вакуолью, которая занимает большую часть клетки (рис.13а). В зоне периферической цитоплазмы располагаются 2-4, реже 6 ядер полулунного типа. Центральная вакуоль обычно содержит различный материал - еле заметные гранулы или хлопьевидный материал различной степени плотности.

Рис.13. Морфология бластоцистов Blastocystis sp.

Рис.13а. Морфология вакуолярных форм бластоцистов
Примечание. Иллюстрации простейших кишечника к разделу 2 приведены в прилож.5.
Гранулярная форма имеет сходные структуры с вакуолярной формой бластоцистов за исключением четко выраженных гранул, которые обнаруживаются как внутри периферического слоя цитоплазмы, так и внутри центральной вакуоли.
Амебоидная форма - редко обнаруживаемая форма бластоцистов. Это небольшого размера клетка от 5 до 8 мкм с одной или двумя псевдоподиями. Обладает вялопротекающими движениями. Содержит различные вакуоли с бактериями и без них, а также трудно дифференцируемые ядра.
Для выявления бластоцистов препараты кала, окрашенные раствором Люголя, микроскопируют сначала при малом, а затем при большом увеличении: окуляр  10, объектив
10, объектив  40. Бластоцисты вакуолярной и гранулярной форм довольно легко определяются. Затруднения могут вызвать бластоцисты амебоидной и переходных форм, которые следует отличать от цист паразитических амеб (рис.13).
40. Бластоцисты вакуолярной и гранулярной форм довольно легко определяются. Затруднения могут вызвать бластоцисты амебоидной и переходных форм, которые следует отличать от цист паразитических амеб (рис.13).
Дата добавления: 2019-02-12; просмотров: 533; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
