Лабораторная диагностика альвеолярного эхинококкоза
Отбор проб, необходимое оборудование и реактивы, подготовка к исследованию материала производятся по такой же методике, как и при цистном эхинококкозе (п.1.2.1).
Результаты исследований
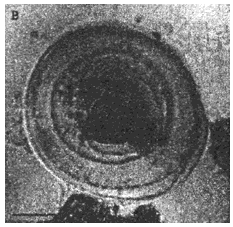
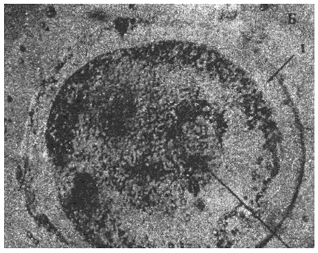
При альвеококкозе исследуют паразитарную ткань в зоне роста, прилежащие и отдаленные участки паренхимы печени, лимфатические узлы. Производят качественную и количественную оценку клеточных элементов воспалительного инфильтрата вокруг паразитарной ткани. Эти данные позволяют установить диагноз, определить характер роста возбудителя, его жизнеспособность и дать оценку состояния паренхимы пораженного органа. Паразитарная ткань при альвеококкозе представлена пузырьками различных размеров, окруженных зоной некроза и воспалительной инфильтрацией (рис.6 и 7).
Выявляется четкая зависимость между активностью роста возбудителя и ответной реакцией тканей хозяина.

А, Б - тонкостенные ацефалоцисты
В - ларвоциста с юным протосколексом и утолщенной хитиновой оболочкой

Г - ацефалоциста с утолщенной хитиновой оболочкой
Рис.4. Микроскопические дочерние ларвоцисты в пунктате из эхинококковых кист больных. Нативные препараты. Длина измерительной шкалы - 100 мкм

А - интактный протосколекс; толщина хитиновой оболочки (1) неравномерная, достигает 40 мкм
Б - тот же протосколекс после искусственной компрессии; видна деформированная корона крючьев (2). Устойчивая к разрыву хитиновая оболочка растянута и истончена ввиду ее прочности и эластичности
|
|
|
Рис.5. Новый тип зародышевых элементов цистного эхинококка: зрелый ввернутый протосколекс, атипично сформировавший утолщенную хитиновую оболочку, в пунктате из эхинококковой кисты в печени больной С. Нативные препараты. Длина измерительной шкалы 50 мкм
1 - хитиновая оболочка ларвоцист альвеококка (Л. А.); 2 - полость Л. А.; 3 - фрагменты герминативной оболочки в полости Л. А.
Рис.6. Альвеококкоз печени больной К. Окрашенные гистологические срезы паренхимы пораженных паразитом участков печени. Длина измерительной шкалы 100 мкм

1 - хитиновая оболочка ларвоцисты альвеококка; 2 - полость ларвоцисты альвеококка
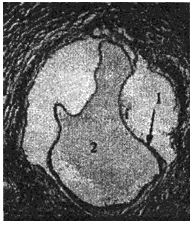
1 - хитиновая оболочка ларвоцисты альвеококка; 2 - полость ларвоцисты альвеококка
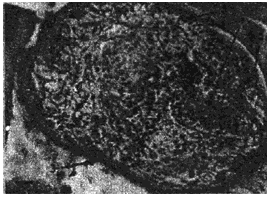
3 - тегумент зрелого протосколекса альвеококка; 4 - присоска протосколекса; 5 - известковые тельца в протосколексе
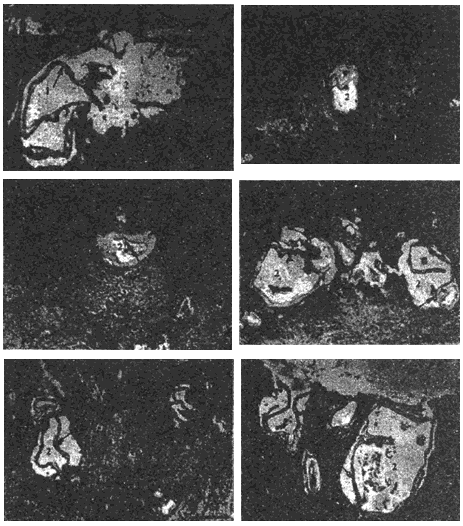
Рис.7. Структурные варианты популяции атипичного ларвального альвеококка печени больного К. (окрашенные гистологические препараты). Длина измерительной шкалы: А-В - 100 мкм; Г - 10 мкм
При малоактивном росте альвеококкоза выявляются крупные паразитарные пузырьки. Зона некроза вокруг пузырьков отсутствует. Пузырьки не контактируют непосредственно с тканью пораженного органа, отделены от нее четко выраженной реакцией фибропластического характера. Эозинофилы в клеточных инфильтратах отсутствуют или встречаются единичные клетки.
|
|
|
При активном росте альвеококка паразитарная ткань представлена мелкими и среднего размера пузырьками, среди которых видны последовательно почкующиеся формы. Кутикулярная оболочка слабо выражена. Зародышевый слой визуализируется не во всех пузырьках. Паразитарные пузырьки окружены зоной некроза, за которой располагается слабо выраженная воспалительная реакция альтернативно-инфильтративного характера. В клеточных инфильтратах преобладают лимфоциты, эпителиоидные клетки, плазмоциты и плазмобласты, большое число гигантских клеток и эозинофилов. Фибропласты содержатся в небольшом количестве.
При особо активном злокачественном росте альвеококка паразитарная ткань представлена мелкими почкующимися пузырьками, часть из которых некротизирована. Кутикулярная оболочка тонкая, зародышевый слой слабо выражен. Пузырьки окружены широкой зоной некроза, содержащей обломки эозинофилов. За зоной некроза располагается неширокая зона воспалительной реакции альтернативного характера. В клеточных инфильтратах преобладают эозинофилы, эпителиоидые клетки, макрофаги, лимфоциты и плазматические клетки. В отдельных случаях инфильтраты состоят почти из одних эозинофилов, небольшого числа лимфоцитов и плазмоцитов. У больных в терминальной стадии заболевания даже при активном росте альвеококка в воспалительных инфильтратах исчезают эозинофилы.
|
|
|
Во всех случаях альвеококкоза человека, за крайне редким исключением, паразитарные ларвоцисты не содержат протосколексов.
Установление жизнеспособности паразита
При снижении жизнеспособности паразита или его гибели наблюдаются некротические изменения паразитарной ткани, отложение в ней солей кальция вплоть до полной кальцификации пузырьков. Погибшие пузырьки окружаются мощной рубцовой тканью.
Для определения жизнеспособности ацефалоцисты выделяют из паразитарного материала следующим образом:
1) Биоптат измельчают ножницами до гомогенного состояния.
2) Полученный гомогенат процеживают через мельничный газ, промывая одновременно физиологическим раствором.
|
|
|
3) Фильтрат помещают в стакан и через 10-15 мин отстаивания удаляют надосадочную жидкость, замещают ее свежим физиологическим раствором.
4) Эту операцию повторяют несколько раз до тех пор, пока надосадочная жидкость не станет прозрачной.
5) Приготовление инокулята завершают удалением надосадочной жидкости и добавлением к осадку концентрированного раствора антибиотиков.
Результаты исследования
Наличие и жизнеспособность ацефалоцист в инокуляте определяются при микроскопии проб осадка, помещенных в чашки Петри или между двумя предметными стеклами.
Идентифицируют следующие признаки живых нативных ацефалоцист альвеококка:
 крупные ларвоцисты (диаметром 0,4-0,8 мм) имеют преимущественно неправильную форму; сниженный тургор; хитиновая оболочка неплотно прилегает к фиброзной капсуле, прозрачная, бесцветная, слоистая;
крупные ларвоцисты (диаметром 0,4-0,8 мм) имеют преимущественно неправильную форму; сниженный тургор; хитиновая оболочка неплотно прилегает к фиброзной капсуле, прозрачная, бесцветная, слоистая;
 мелкие ацефалоцисты (диаметром 0,1-0,3 мм) имеют преимущественно круглую или овальную форму; хитиновая оболочка прозрачная, бесцветная, однослойная, плотно прилегает к фиброзной капсуле;
мелкие ацефалоцисты (диаметром 0,1-0,3 мм) имеют преимущественно круглую или овальную форму; хитиновая оболочка прозрачная, бесцветная, однослойная, плотно прилегает к фиброзной капсуле;
 герминативный (паренхимный) слой ацефалоцист очень тонкий и визуализируется в виде легкой зернистости у всех ацефалоцист в нативных неокрашенных препаратах.
герминативный (паренхимный) слой ацефалоцист очень тонкий и визуализируется в виде легкой зернистости у всех ацефалоцист в нативных неокрашенных препаратах.
1.2.3. Метод исследования жизнеспособности паразита in vivo (биопроба)
Применяется в специализированных научно-исследовательских лабораториях.
Для определения жизнеспособности и штаммовых особенностей возбудителя проводят исследование по имплантации паразитарной ткани в брюшную полость лабораторных животных, восприимчивых к альвеококкозу. Проведение такого исследования стало возможным после первого внутрибрюшного успешного заражения хлопковых крыс изолированными микроскопическими ацефалоцистами из паразитарного "узла" в печени оперированного больного альвеококкозом. Получению тех же изолированных ацефалоцист альвеококкоза способствует использование недавно выявленного феномена сниженной адгезии хитиновой оболочки ларвоцист альвеококка к окружающей соединительнотканной капсуле в печени у человека. Это свойство обеспечило возможность выделения из малых фрагментов пораженной альвеококком печени больного (постоперационный материал) большого количества ацефалоцист альвеококка, пригодных для диагностического и экспериментального исследований (рис.8).

1 - хитиновая оболочка; 2 - полость ларвоцисты альвеококка
Рис.8. Структурные варианты популяции ларвоцист типичного альвеококка из печени больной Я. Нативные препараты, полученные при фракционировании свежего постоперационного материала. Длина измерительной шкалы 100 мкм
Отбор проб
В качестве паразитарного материала используют выделенный в день операции альвеококковый "узел" с прилежащими участками печени.
Необходимое оборудование и материал
Инокулят из пораженного органа
Хлопковые крысы
Подготовка к исследованию
С помощью полученного инокулята осуществляют имплантацию ацефалоцист инъекционно в брюшную полость хлопковых крыс обоего пола в возрасте 1,0-1,5 месяцев. Доза инвазированного материала составляет 200-500 ацефалоцист на одно животное.
Особенности течения вторичного альвеококкоза у хлопковых крыс (скорость пролиферации, созревания ларвоцист, прироста биомассы паразита) определяют при вскрытии животных в разные сроки после заражения (рис.9).

Рис.9. Экспериментальный вторичный альвеококкоз хлопковых крыс, 86 дней после внутрибрюшинного заражения животных ацефалоцистами альвеококка из резецированного фрагмента печени больного К. Передняя брюшная стенка удалена
Результаты исследования биопробы позволяют:
 оценить жизнеспособность паразита у больного;
оценить жизнеспособность паразита у больного;
 выявить штаммовые особенности исследуемого изолята возбудителя (морфология, скорость роста и созревания как на ларвальной, так и на имагинальной стадиях развития), что представляется важным как в эпидемиологическом аспекте (выявление новых природных очагов альвеококкоза), так и в тактике консервативного лечения больных (необходимость применения прозиквантеля в сочетании с карбаматбензилендазолами при лечении больных, в паразитарных кистах которых обнаружены протосколексы альвеококка).
выявить штаммовые особенности исследуемого изолята возбудителя (морфология, скорость роста и созревания как на ларвальной, так и на имагинальной стадиях развития), что представляется важным как в эпидемиологическом аспекте (выявление новых природных очагов альвеококкоза), так и в тактике консервативного лечения больных (необходимость применения прозиквантеля в сочетании с карбаматбензилендазолами при лечении больных, в паразитарных кистах которых обнаружены протосколексы альвеококка).
Дата добавления: 2019-02-12; просмотров: 245; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
