Определение операбельности пациента
Не существует методов, которые позволяли бы с высокой долей достоверности прогнозировать возможность восстановления перфузии легочной ткани после оперативного лечения. Дистальнее места окклюзии или стеноза часто не удается четко определить состояние периферических ветвей и микроциркуляторное русло. Поэтому для определении операбельности пациенты должны быть обследованы по трем направлениям:
1. Тип и степень нарушения перфузии различных отделов легких.
2. Параметры центральной гемодинамики.
3. Характер и распространенность поражения легочных артерий.
Хирургической бригаде важно определить соответствуют ли конкретные дефекты перфузии стенотическим изменениям в сегментарных и долевых легочных ветвях. Если в большинство дефектов перфузии не имеют конкретного патологического субстрата в виде обструкции ветви ЛА, операбельность больного может быть поставлена под сомнение. Точно также, несоответствие гемодинамических расстройств перфузионным и стенотическим изменениям, заставляет задуматься об ином характере патологии. Исследованиями было установлено, что при предоперационном ЛСС более 1200 дин.с-5 операции ТЭЭ сопровождаются большей частотой осложнений и летальности. В этой группе наблюдается также более высокий уровень ДЛА и ЛСС после операции. Несмотря на это, даже более высокие цифры ЛСС не рассматриваются большинством хирургов как абсолютное противопоказание к операции. Отчетливый проксимальный характер поражения, даже при высоком ЛСС, свидетельствует о потенциальной эффективности и безопасности операции.
|
|
|
Более простой способ определения операбельности больного основан на подсчете проксимально пораженных ветвей, доступных хирургии, и количества соответствующих им сегментов. Фактически, производится подсчет сегментов, кровообращение в которых может быть восстановлено. Восстановление кровообращения в 10-12 сегментах (по 5-6 в каждом легком или эквивалентно) обычно приводит к значительному регрессу ЛГ. Меньшее количество открытых сегментов может быть недостаточным для получения оптимального результата и ЛГ может рецидивировать.
Оценка операбельности пациента должна проводиться мультидисциплинарным консилиумом с обязательным участием хирурга, имеющего опыт проведения операций ТЭЭ или прошедшего обучение в хирургическом экспертном центре с участием в принятии решения по 15-20 больным ХТЭЛГ. При принятии решения о неоперабельности, больной должен быть консультирован другим аналогичным мультидисциплинарным консилиумом.
Дифференциальная диагностика
|
|
|
Вследствие того, что ХТЭЛГ является потенциально излечимой патологией аболеванием, ее следует отличать от других заболеваний, сопровождающихся присутствием тромботических, фиброзных и иных изменений в легочных артериях. Прежде всего необходимо провести дифференциальный диагноз ХТЭЛГ и всех микроваскулярных форм ЛГ (таблица 10). Значительные трудности, при этом, представляют больные с возможным вторичным тромбообразованием как осложнением высокой ЛГ. Отсутствие указаний на перенесенную ТЭЛА, несоответствие изменений крупных легочных сосудов величине ЛСС, диффузное снижение перфузии легочной ткани по периферии обоих легких, могут свидетельствовать в пользу тромбозов in situ. Решающую роль в решении этого вопроса играет качественно проведенная ангиопульмонография и катетеризация. Повышение ЛСС более 1600дин/см/с-5 более свойственно микроваскулярным формам ЛГ, чем ХТЭЛГ.
Таблица 10. Дифференциальная диагностика ХТЭЛГ в зависимости от локализации поражений легочных артерий
| 1.Прекапиллярная ЛГ • острая ТЭЛА • ЛАГ • тромбоз in situ (при ВПС) • медиастинальный фиброз • васкулиты • саркоидоз • ангиосаркома • нетромботические эмболии (опухоли, паразиты, гистоплазмоз, инородные тела (тальк) • болезнь Ослера-Рандю • атрезия легочных сосудов • синдром Суайра-Джеймса • болезнь Реклингхаузена • гемоглобинопатии | 2. Поражение легочных капилляров легочный капиллярный гемангиоматоз | 3. Посткапиллярная ЛГ • легочная вено-окклюзионная болезнь • медиастинальный фиброз • шистосомоз |
|
|
|
Другим признаком поражения микрососудистого русла является отсутствие перфузии в кортикальных слоях легких. ХТЭЛГ следует отличать от более редкого заболевания- васкулита легочных артерий. При васкулите в период обострения наблюдаются признаки воспаления и утолщения стенки сосуда, а в отсроченную фазу – деформации с формированием стенозов и тромбозов. Подтверждением воспалительного генеза заболевания могут служить изменения сосудов большого круга кровообращения, сходные с изменениями при синдроме Такаясу.
Схожую с ХТЭЛГ ангиографическую картину имеет ангиосаркома ЛА. Опухоль растет по интиме легочной артерии и имеет неровную поверхность, что делает ее очень похожей на крупный пристеночный тромб. Характерным отличием опухоли от тромба является преимущественно центральное расположение в просвете сосуда. Поражение легочного клапана и ствола легочной артерии типично для ангиосаркомы и редко наблюдается при ХТЭЛГ. Со временем опухоль может прорастать в дистальные ветви ЛА. Во многих случаях возможно удаление опухоли оперативным путем с последующими курсами химиотерапии, однако риск рецидива опухоли крайне высок. Экстравазальная компрессия легочных сосудов редко приводит к развитию ЛГ и обычно вызвана онкологическими заболеваниями. Лечение подобных состояний выходит за рамки данных рекомендаций и описано в соответствующей литературе. Среди незлокачественных заболеваний, вызывающих ЛГ и требующих оперативного лечения, следует отметить фиброзирующий медиастинит. Эта болезнь характеризуется разрастанием соединительной ткани в средостении с компрессией легочных сосудов. Легочные артерии обычно поражаются во вторую очередь, после того, как процесс охватит полые или легочные вены. КТ позволяет с уверенностью диагностировать состояния, приводящие к экстравазальной компрессии ЛА.
|
|
|
Глава 6. Лечение
6.1. Немедикаментозные (общие) рекомендации
Общие меры и стандартное лечение у неоперабельных или ожидающих операцию больных ХТЭЛГ подобны таковым при ЛАГ. Соблюдение общих мероприятий позволяет уменьшить риск возможного ухудшения течения заболевания вследствие воздействия внешних факторов
Физическая активность
Больные с ХТЭЛГ должны выполнять нагрузки в пределах той физической активности, которая возможна, исходя из уровня функциональных нарушений и выраженности клинической симптоматики. В повседневной жизни пациенты должны избегать возникновения выраженной одышки, синкопе, болей в груди. Запрещаются физические нагрузки после еды, при неблагоприятном температурном режиме. В то же время больным следует поддерживать адекватное состояние скелетной мускулатуры за счет выполнения ежедневных дозированных физических нагрузок, что способствует улучшению качества жизни и клинической симптоматики. Показана роль специальных программ по реабилитации больных в улучшении показателей физического статуса. Необходимым условием является постоянный контроль медицинского персонала за проведением комплекса реабилитации.
Беременность, роды, заместительная гормонотерапия в постменопаузальном периоде связаны с повышенным риском ухудшения течения заболевания и смертности. Беременность противопоказана неоперабельным больным и больным с ризидуальной ХТЭЛГ, так как материнская смертность составляет 30-50%. Всем пациенткам репродуктивного возраста должны быть рекомендованы соответствующие методы контрацепции. Предпочтительно использование эстроген-несодержащих контрацептивов, барьерных методов контрацепции, проведение хирургической стерилизации. При оценке мер контрацепции важно подчеркнуть, что барьерные методы безопасны, но не обеспечивают надежного контрацептивного эффекта. Препараты прогестерона (медроксипрогестерона ацетат, этоногестрел) эффективны и безопасны в связи с отсутствием потенциального риска, связанного с применением эстрогенов, которые ранее применялись в оральных контрацептивах. Бозентан может снижать эффективность оральных контрацептивов, поэтому для достижения надежного эффекта целесообразно сочетать два метода контрацепции. Возможно применение интравагинальных препаратов. В случае беременности больная должна быть предупреждена о высоком риске фатального исхода и необходимости прерывания беременности.
Заместительная гормональная терапия показана пациенткам с ХТЭЛГ в постменопаузе только при выраженных климактерических симптомах при условии достижения адекватной гипокоагуляции в результате антикоагулянтной терапии.
Путешествия
Гипоксия усугубляет вазоконстрикцию, поэтому во время полетов на авиатранспорте больным ХТЭЛГ с ФК III-IV при парциальном давлении О2 в артериальной крови менее 8кПа (60 мм рт.ст.) необходимо проводить дополнительную кислородотерапию. Скорость 2 л/мин. достаточна для повышения давления кислорода до уровня соответствующего уровню моря. Всем пациентам, совершающим авиаперелеты в другие страны, важно рекомендовать иметь при себе медицинские документы, данные о местонахождении ближайшего местного центра ЛГ, контактную информацию.
Психологическая поддержка и помощь
Информация о тяжести заболевания, полученная больными из немедицинских источников, приводит к повышенной тревоге или депрессии, что существенно снижает качество жизни таких пациентов. Часто диагноз становится причиной социальной изоляции, поэтому мотивация больных участвовать в сообществах больных крайне важна для повышения уверенности в себе, улучшения настроения и общего состояния. Для адаптации пациентов в жизни и обществе, понимания своей болезни показана помощь психолога или психиатра, а также поддержка других пациентов и их близких.
Профилактика инфекционных заболеваний
Возникновение пневмонии усугубляет течение заболевания, всегда требует проведения быстрой диагностики и немедленного начала эффективного лечения. Следует рекомендовать пациентам вакцинирование от гриппа и пневмококковой инфекции.
Хирургическая помощь
Предпочтительным видом анестезиологического пособия является местная, проводниковая или эпидуральная анестезия, которая переносится лучше, чем общая анестезия. Необходимо заблаговременно осуществлять перевод больных с пероральной антикоагулянтной терапии на подкожноеили внутривенное введение препаратов. Хирургические вмешательства связаны с повышенным риском, особенно при ФК IV, а также в случае торакальной или абдоминальной операции. В периоперационном периоде обязательно проводится терапия гепарином.
Контроль уровня гемоглобина
Пациенты крайне чувствительны к снижению уровня гемоглобина в крови, поэтому даже невыраженная анемия требует быстрого эффективного лечения. Гемоэксфузии больным ХТЭЛГ не показаны.
6.2. Оперативное лечение: л егочная тромбэндартерэктомия
С начала 60-х годов ХХ века для лечения ХТЭЛГ применяют операцию двусторонней тромбэндартерэктомии (ТЭЭ) из легочной артерии, или легочной эндартерэктомии. Эта операция стала стандартом лечения заболевания и, как показали данные регистра ХТЭЛГ, является залогом благоприятного прогноза. После успешного оперативного лечения у большинства больных удается значительно снизить ЛСС и уменьшить риск развития декомпенсации ПЖ. ТЭЭ является методом выбора при лечении ХТЭЛГ.
6.2.1. Показания и противопоказания
Абсолютными п оказаниями к оперативному вмешательству являются:
-Верифицированный диагноз ХТЭЛГ.
-Доказанный тромбоэмболический генез ЛГ при соответствующих изменениях легочных артерий.
-ЛСС> 300 дин/см/с-5, при этом ДЛАср. > 25 мм рт. ст . (при физической нагрузке > 30–35 мм рт. ст.
В клиниках экспертного уровня ТЭЭ выполняются при более низких показателях ЛСС (ЛГ при нагрузке, больной не удовлетворен качеством жизни), когда верифицированный диагноз ХТЭЛГ и доказанный тромбоэмболический генез ЛГ рассматриваются в качестве относительного показания.
Противопоказания:
· Недоступное операции поражение легочных артерий – наиболее значимое, частое противопоказание к операции, поскольку обусловливает высокий риск рецидива ЛГ в раннем послеоперационном периоде. Может быть установлено только в экспертном центре, имеющем опыт операций ТЭЭ. Степень доступности поражения должна определяться хирургом, исходя из опыта клиники.
· Тяжелая дисфункция правого желудочкаможет стать причиной критической сердечной недостаточности после операции, особенно при резидуальной ЛГ. На высокий риск указывают размеры ПЖ, трикуспидальная регургитация 3—4 ст, скорость и амплитуда движения кольца трикуспидального клапана, высокий уровень BNP, анасарка, асцит, гидроторакс. Пока не разработаны критерии оценки периоперационного риска, основанные на функции ПЖ. Считается, что даже при выраженной дисфункции ПЖ выполнение операции возможно, и в таких случаях следует ориентироваться на ЛСС.
· Заболевания легочной ткани- интерстициальные и обструктивные заболевания легочной ткани тяжелой и средней степени тяжести (альвеолиты, интерстициальные пневмонии, ХОБЛ, бронхиальная астма), сопровождающиеся выраженными изменениями вентиляционных показателей- способствуют нарушению вентиляционно-перфузионного соотношения в послеоперационном периоде.
· Риск развития посткапиллярной легочной гипертензии в послеоперационном периоде имеется при некорригируемой патологии левых отделов сердца, редко - при обструкции легочных вен.
· Риск развития полиорганной недостаточности - тяжелая дисфункция печени, почечная недостаточность, сопровождающиеся изменениями биохимических показателей.
· Риск кровотечения в послеоперационном периоде. Больной должен получать лечебные дозы антикоагулянтов сразу после операции и далее в течение всей жизни. Кровохаркание, язвы желудочно-кишечного тракта, дисфункция печени, тромбоцитопения, антифосфолипидный синдром могут стать причиной жизнеугрожающего кровотечения после операции
· Другие противопоказания к проведению искусственного кровообращения с циркуляторным арестом- острые расстройства коронарного и мозгового кровообращения, выраженные стенотические изменения брахиоцефальных артерий, острые расстройства коагуляции и другие тяжелые заболевания.
Основными факторами, влияющими на прогноз после операции ТЭЭ являются: ФК, степень резидуальной ЛГ, риск повторной ТЭЛА. Зарубежные регистры позволили установить, что 40% больных ХТЭЛГ являются неоперабельными в силу наличия противопоказаний, дистального поражения легочного сосудистого русла или тяжести гемодинамических нарушений. Ведущей клиникой по хирургическому лечению ХТЭЛГ г.Сан-Диего (США) была разработана хирургическая классификация заболевания с выделением по анатомическому принципу 4 групп (таблица 11).
Таблица 11. Хирургическая классификация тромботических поражений при ХТЭЛГ
| Тип | Характер поражения |
| I | Свежие тромбы в основных и долевых ветвях ЛА |
| II | Утолщения и фиброз интимы проксимальнее мест отхождения сегментарных ветвей |
| III | Поражение исключительно сегментарных ветвей |
| IV | Дистальная артериолярная васкулопатия без визуальных признаков тромбоэмболического поражения |
Пожилой возраст пациента не является противопоказанием к операции. Высокие показатели ЛСС и выраженная дисфункция правого желудочка также не являются противопоказаниями к выполнению легочной ТЭЭ при наличии операбельного проксимального поражения легочных артерий. Следует подчеркнуть, что по мере накопления клиникой опыта в лечении больных ХТЭЛГ возможно постепенное сужение круга противопоказаний к операции. Эффективное устранение стенотических изменений легочных артерий и хорошие показатели циркуляции после операции ТЭЭ обычно являются гарантами гладкого послеоперационного периода.
6.2.2. Подготовка к операции
Несмотря на отсутствие единого мнения, процедура имплантации кава-фильтра перед операцией не является общепризнанной.
Перед операцией большинство больных с ХТЭЛГ достаточно длительно получают вазодилататоры и диуретики. Следует стремиться к уменьшению проявлений застойной сердечной недостаточности, почечной и печеночной дисфункции. При признаках выраженной дисфункции ПЖ возможно проведение курса ЛАГ-специфической терапии (риоцигуат, силденафил, бозентан) в течение 1—3 месяцев (см. раздел 6.3.2. Специфическая терапия). Лечение антикоагулянтами пациенты должны получать вплоть до момента операции. С этой целью больного переводят на лечение гепарином или низкомолекулярными гепаринами.
6.2.3. Оснащение операционной
Проведение операции ТЭЭ требует от бригады врачей возможностей проведения торакальных и сердечно-сосудистых операций. Необходимы средства инвазивного мониторирования давления в полостях сердца и гемодинамики. Для оценки состояния сердца применяется чреспищеводная ЭхоКГ. В распоряжении бригады должны быть системы для бронхоскопии, бронхоокклюзии, для подачи оксида азота и ингаляции простаноидов. Рекомендуется иметь в распоряжении систему для проведения экстракорпоральной мембранной оксигенации (ЭКМО) и специалистов по работе с ней.
6.2.4. Оперативное вмешательство
Классический вариант операции ТЭЭ из легочных артерий проводится с использованием искусственного кровообращения в условиях глубокой гипотермии и кардиоплегии. Для наиболее полного удаления тромботического материала применяются периоды полной остановки кровообращения, не превышающие общепринятые лимиты безопасности. Операции проводятся из срединной стернотомии. Подключается аппарат искусственного кровообращения по схеме полые вены-восходящая аорта и начинается охлаждение больного. Доступ к левой ЛА обычно осуществляется от основного ствола, к правой ЛА — в промежутке между верхней полой веной и восходящей аортой. Во избежание перегрузки полостей давлением дренируется полость левого желудочка и ЛА. Для остановки сердца применяется кардиоплегический раствор.
Практически во всех случаях операция проводится в варианте двусторонней эндартерэктомии. Проведение операций в другом формате и условиях может сопровождаться высоким количеством осложнений или быть низкоэффективным. Основным принципом операции является удаление старого тромботического материала вместе с интимо-медиальным слоем. Эта методика позволяет выполнить наиболее полное устранение обструктивных изменений в артериях. Эффективность удаления тромботического материала зависит как от степени квалификации оперирующей бригады, так и от особенностей материала. Оценка таких параметров как плотность интимы легочных артерий, толщина фиброзного слоя и его способность к отделению не может быть проведена до операции, что не позволяет точно оценить эффект и риски оперативного лечения. При интенсивном поступлении крови из дистальных отделов легочного русла, может быть использована остановка искусственного кровообращения, продолжительность которой определяется степенью гипотермии. При этом хирург получает возможность завершить эндартерэктомию в условиях сухого поля. С контралатеральной стороны вмешательство проводится аналогичным образом. При необходимости возможно выполнение дополнительных вмешательств на сердце – ушивание открытого овального окна или ДМПП, коронарное шунтирование, пластика трикуспидального клапана и др. Относительная трикуспидальная регургитация в большинстве случаев коррекции не требует и уменьшается по мере уменьшения объема ПЖ. При подозрении на резидуальную ЛГ с профилактической целью вводят легочные вазодилататоры. После окончания искусственного кровообращения проводится расчет показателей гемодинамики. При сниженном СВ показано введение легочных вазодилататоров (простаноиды и окись азота) и адреномиметиков. Для нормализации сниженного периферического сосудистого сопротивления и увеличения наполнения ПЖ нередко требуется продленная инфузия вазопрессоров.
6.2.5. Послеоперационный период и возможные осложнения
Ранний послеоперационный период характеризуется повышенным ЛСС и признаками низкого наполнения левого желудочка. Это вызвано тем, что у большинства больных в результате ИК возникает обратимое повреждение микрососудистого русла, которое при нормальном течении имеет тенденцию к постепенному разрешению в ближайшие 12-24ч. После снижения ЛСС возникает резкое снижение постнагрузки ПЖ, которое при недостаточной волюмической поддержке может привести к синдрому малого выброса. В раннем послеоперационном периоде необходимо начать терапию прямыми антикоагулянтами под соответствующим лабораторным контролем. Особое внимание уделяется больным с АФС-синдромом, у которых показатели АВС и АЧТВ могут давать ложно-завышенные результаты. Снижение ЛСС через 10-12ч после операции ниже 300 дин/см/с-5 обычно свидетельствует о хорошем прогнозе и возможности экстубации пациента. При сохранении признаков повышенного ЛСС более 400—500 дин/см/с-5 может потребоваться более длительный восстановительный период. Показана длительная седативная терапия и щадящие методы искусственной вентиляции. Через несколько суток происходит адаптация легочного капиллярного русла к новым условиям и риск реперфузионного повреждения уменьшается. В этот период 1—2 раза в сутки следует проводить рентгенографию легких. Появление инфильтративных теней на рентгенограмме должно насторожить врачей из-за высокого риска развития труднообратимых изменений легочной ткани и, как следствие, поддержания порочного круга: реперфузионный отек – прирост ЛСС – повышение ДЛА – реперфузионный отек. Крайняя степень выраженности реперфузионного повреждения сопровождается тяжелой гипоксемией, резидуальной ЛГ, снижением СВ. В таких ситуациях единственным средством поддержания нормальной оксигенации и гемодинамики может стать экстракорпоральная мембранная оксигенация (ЭКМО). Легочное кровотечение относится к наиболее опасным осложнениям операции и обычно возникает сразу после восстановления кровотока в легочных артериях. Основной причиной является локальная перфорация ЛА или диффузное пропотевание крови через истонченную стенку сосуда. Для остановки такого кровотечения применяют эндобронхиальную окклюзию, прямое лигирование сосуда, резекцию соответствующих сегментов легкого и разгрузку легочного русла при помощи вено-артериального ЭКМО. Однако, даже при применении всех современных методов, летальность при легочном кровотечении может достигать 50%. Послеоперационный период может осложниться развитием правожелудочковой недостаточности. При развитии этого осложнения нормальные показатели ДЛА могут дезориентировать врача. Поэтому необходим строгий контроль не только показателей давления в полостях сердца, но и СВ. Лечение правожелудочковой недостаточности проводится согласно общепринятым рекомендациям. Наиболее эффективен в таких случаях оксид азота, который обычно приходится сочетать с кардиотоническими и вазотоническими препаратами. При недостаточной эффективности антикоагулянтов может развиться тромбоз или тромбоэмболия легочных артерий. Диагноз этого состояния труден и может быть поставлен только после проведения КТ-ангиопульмонографии. При крайней степени выраженности тромбоза может потребоваться оперативное извлечение тромбов или тромболитическая терапия.
Пневмоторакс, ателектазы, пневмонии и другие острые заболевания легочной паренхимы радикальным образом могут отражаться на течении послеоперационного периода, поэтому врачебная бригада должна быть в состоянии максимально быстро, а иногда и с некоторым опережением, принимать необходимые меры по профилактике и лечению подобных осложнений.
Применение длительного искусственного кровообращения и остановки циркуляции потенциально опасно развитием органной дисфункции. Среди таких осложнений наиболее значимы поражения ЦНС. Однако при соблюдении всех принципов проведения операций с остановкой ИК, риск подобных осложнений невелик и составляет около 1-2%. Восстановление больных после операции легочной ТЭЭ требует длительного времени. Считается, что эффект операции достигается лишь к 3—6 мес. послеоперационного периода. ДЛА может снижаться в течение полугода после операции, что связано с обратным ремоделированием сердца и легочных сосудов, что возможно оценить с помощью ЭхоКГ. Уменьшение правых отделов сердца, купирование трикуспидальной недостаточности и одновременная нормализация левых отделов свидетельствуют о хорошем объемном кровотоке в легких. Контрольная КПОС для определения дальнейшей стратегии ведения больного показана через 6—12 мес. после ТЭЭ. Однако при хорошей переносимости умеренных и интенсивных физических нагрузок достаточным является неинвазивный контроль (Тест 6мх, ЭКГ, BNP, ЭхоКГ, МРТ или КТ- ангиопульмонографии).
6.2.6. Отдаленные результаты операции ТЭЭ
Госпитальная летальность при проведении ТЭЭ по данным экспертных центров составила 1-5%. Показатели зависят от опыта центра. Выживаемость пациентов к 10-му году после операции ТЭЭ, по данным разных авторов, составляет 75-85% и, в дальнейшем, существенно не отличается от популяционных показателей. Как и в отношении ранних результатов, основными факторами, влияющими на отдаленный прогноз, являются тяжесть остаточной ЛГ, ФК сердечной недостаточности и риск повторных тромбоэмболических событий.

6.3. Лекарственная терапия
Следует выделить два раздела лекарственной терапии у больных ЛГ: поддерживающая терапия (оральные антикоагулянты и дезагреганты, диуретики, сердечные гликозиды, оксигенотерапия) и специфическая терапия, включающая антагонисты кальция, простаноиды, антагонисты рецепторов эндотелина, ингибиторы фосфодиэстеразы типа 5, стимуляторы гуанилатциклазы (таблица 12).
6.3.1. Поддерживающая терапия
Оральные антикоагулянты составляют основу медикаментозной терапии, назначаются пожизненно, в том числе у оперированных пациентов. Препаратом выбора является антагонист витамина К варфарин. Новые антикоагулянты не рекомендуются в связи с отсутствием доказательной базы. При назначении варфарина целевыми уровнями международного нормализованного отношения (МНО) являются 2,5-3,5. В качестве альтернативы варфарину у ряда пациентов с ЛГ с нестабильным МНО, повышенным риском кровотечений или плохой переносимостью препарата, рекомендовано использовать низкомолекулярные гепарины. Наиболее доступными низкомолекулярными гепаринами являются надропарин 15000 UAXaIC 2 раза в сутки и эноксапарин 1мг/кг веса 2 раза в сутки. Диуретики рекомендуются во всех случаях развития декомпенсации ПЖ, позволяют улучшить клиническое состояние больных. Дозы диуретиков должны аккуратно титроваться во избежание резкого падения объема циркулирующей крови и снижения артериального давления. Применяются петлевые диуретики: фуросемид 20-120мг/сутки, этакриновая кислота 50-100мг/сутки, торасемид 5-20мг/сутки. Целесообразно присоединение антагонистов адьдостерона: верошпирон 25-150мг, эплеренон 25-50 мг. Во всех случаях назначения диуретиков необходимо тщательно контролировать уровни электролитов крови, а также состояние функции почек. Оксигенотерапия рекомендуется всем больным при наличии значительной десатурации в покое – SaO2 < 90%. Оксигенотерапия также рекомендуется больным с сопутствующей хронической обструктивной болезнью легких на протяжении не менее 15 часов в сутки. В амбулаторных условиях оксигенотерапия необходима для улучшения клинической симптоматики, коррекции десатурации при физической нагрузке.
Сердечные гликозиды и инотропные препараты
Снижение сократительной способности ПЖ является одним из важнейших механизмов прогрессирования сердечной недостаточности у больных с ХТЭЛГ. Назначение дигоксина 0,25мг/сутки рекомендуется для урежения желудочкового ритма при наджелудочковых тахиаритмиях. Добутамин назначается в терминальной стадии заболевания и, в ряде случаев, позволяет достичь стабилизации состояния.
6.3.2. Специфическая терапия
Применение постоянной ЛАГ- специфической терапии требуется в 3-х группах больных с ХТЭЛГ:
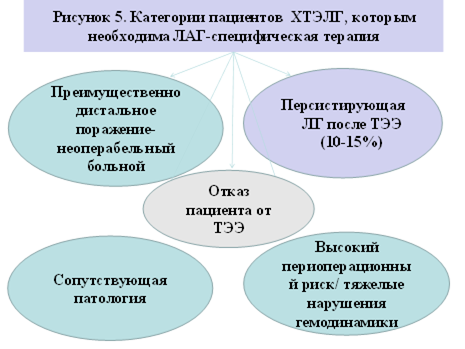
1. Больные с ХТЭЛГ, которым отказано в проведении операции (неоперабельная форма) (рисунок 5).
2. Больные, перенесшие операцию тромбэндартерэктомии, но имеющие остаточную ЛГ (резидуальная/ персистирующая форма).
3. Больные с ХТЭЛГ, отказавшиеся от предложенного оперативного лечения.
Теоретическая база в пользу применения ЛАГ-специфической терапии при ХТЭЛГ основывается на физиологических, патоморфологических, а также функциональных сходствах этих форм ЛГ. Помимо обструкции проксимального русла морфологическая картина ХТЭЛГ характеризуется поражением микрососудистого русла легких, что служит обоснованием для применения препаратов, используемых для лечения ЛАГ. Так, при анализе гистологической картины дистальных легочных артерий у больных ХТЭЛГ в неокклюзированных областях могут развиваться неотличимые от ЛАГ проявления легочной артериопатии, в том числе плексиформные поражения. Как при ЛАГ, у больных ХТЭЛГ определяются повышенные уровни эндотелина-1 в плазме крови, нарушения в системе тромбоксан/ простациклин, нарушение продукции оксида азота, которые тесно коррелируют с показателями гемодинамики и клинической тяжестью заболевания. Современные ЛАГ- специфические препараты обладают не только вазодилатирующей способностью, но и рядом дополнительных свойств – цитопротективных, антипролиферативных, антиагрегационных и т.д. Они воздействуют на мишени патогенеза заболевания- избыточную активацию системы эндотелина (антагонисты рецепторов эндотелина), дефицит эндогенного простациклина (аналоги простациклина (простаноиды) и оксида азота (ингибиторы фосфодиэстеразы 5 типа, стимуляторы гуанилатциклазы). Патогенетическая терапия направлена на улучшение и стабилизацию клинического состояния, переносимости физических нагрузок и гемодинамических показателей, позитивную динамику качества жизни больных, замедление темпов прогрессирования заболевания, снижение потребности в госпитализациях, а также улучшение прогноза больных. Однако у больных с ХТЭЛГ имеется очевидный дефицит доказательной базы. За последние 10 лет было проведено несколько пилотных и рандомизированных клинических исследований (РКИ), которые продемонстрировали возможность различных ЛАГ-специфических препаратов у пацинетов с ХТЭЛГ в плане улучшения толерантности к физическим нагрузкам и гемодинамических параметров.
Стимуляторы гуанилатциклазы
Риоцигуат – представитель нового класса лекарственных препаратов, стимуляторов растворимой гуанилатциклазы. Препарат имеет двойной механизм действия, так как, с одной стороны, он напрямую, независимо от эндогенного оксида азота, стимулирует растворимую гуанилатциклазу, с другой стороны-повышает чувствительность растворимой гуанилатциклазы к эндогенному NO. За счет повышения уровня цГМФ риоцигуат приводит к вазорелаксации, подавлению пролиферативного, воспалительного и фиброзного эффектов, что было показано на экспериментальных моделях ЛГ. В РКИ фазы II риоцигуат у больных с ХТЭЛГ вызывал достоверное снижение ЛСС к 12 неделе терапии, а также значительный прирост дистанции в Т6МХ.
РКИ фазы III CHEST-1 (ChronicThomboembolicPulmonaryHypertensionSolubleGuanylateCyclaseStimulatorTrial-1) стало первым знаковым исследованием по оценке эффективности и безопасности лекарственной терапии у больных с неоперабельными и резидуальными формами ХТЭЛГ, в котором были получены убедительные позитивные результаты. 261 пациент с неоперабельной формой ХТЭЛГ или персистирующей (резидуальной) ЛГ после ТЭЭ (27% больных), ранее не получавших ЛАГ-специфические препараты, были рандомизированы для получения риоцигуата или плацебо в соотношении 2:1.
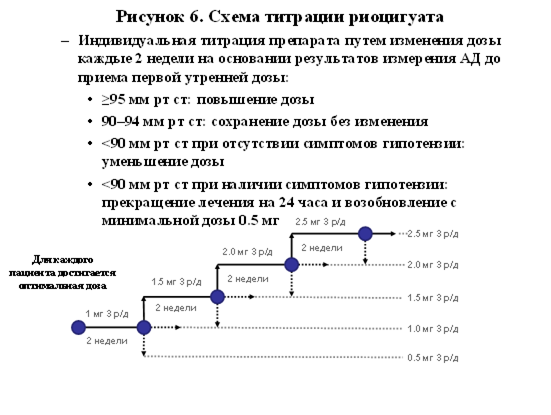
Стартовая доза риоцигуата составляла 1мг три раза в сутки. Каждые 2 недели в зависимости от уровня АД и симптоматики осуществлялась титрация дозы до максимальной- 2,5мг Х 3 раза в сутки. Алгоритм титрации представлен на рисунке 6. В исследовании максимальная разовая доза риоцигуата 2,5 мг была достигнута у 77% больных. К 16 неделе лечения риоцигуат обеспечивал прирост дистанции в Т6МХ на 46м по сравнению с плацебо (первичная конечная точка) (p<0.001). Причем улучшение результатов Т6МХ было достоверным как в группе неоперабельных больных (+54м), так и при резидуальных формах заболевания (+27м). При изучении вторичных конечных точек позитивные, высокодостоверные результаты были получены при оценке динамики гемодинамических показателей (ЛСС, ДЛАср., СИ), мозгового Na-уретического пептида, ФК, индекса одышки по Боргу, показателей качества жизни. Не было отмечено достоверных различий между группами по влиянию на время до развития клинического ухудшения.
В открытом исследовании CHEST-2 при оценке долгосрочной эффективности и безопасности риоцигуата данные 2-х летнего наблюдения за больными, получавшими риоцигуат, доказали стабильный положительный эффект терапии: у 86% пациентов не отмечалось признаков клинического ухудшения, выживаемость пациентов составила 96%. Наиболее частыми побочными эффектами были диспепсия, головокружения, головные боли.
С учетом результатов РКИ CHEST-1 /2 риоцигуат следует рассматривать в качестве препарата первого выбора у больных с неоперабельными или резидуальными формами ХТЭЛГ. С 2014г. риоцигуат одобрен в нашей стране для лечения не только ЛАГ, но и при неоперабельных и резидуальных формах ХТЭЛГ.
Простаноиды- перспективная группы препаратов, которые помимо вазодилатирующего эффекта, обладают антиагрегационным, противовоспалительным, антипролиферативным действием. Простациклин (простагландин I2)- мощный эндогенный вазодилататор с антиагрегационным, антипролиферативным и цитопротективным свойствами, которые направлены на предотвращение ремоделирования легочных сосудов: уменьшение повреждения эндотелиальных клеток и гиперкоагуляции. У больных с ХТЭЛГ показано нарушение продукции простациклина, о чем свидетельствует снижение экспрессии простациклинсинтазы в легочных артериях и уменьшение синтеза простациклина. Илопрост - химически стабильный аналог простациклина, единственный зарегистрированный в нашей стране препарат в ингаляционной форме, рекомендованный для лечения среднетяжелой и тяжелой форм ЛАГ и неоперабельных форм ХТЭЛГ. Ингаляционная форма илопроста обеспечивает большую селективность препарата в отношении легочной циркуляции. В рандомизированном, плацебо-контролируемом исследовании AIR-1 эффективность илопроста оценивалась у 203 больных с ЛАГ различной этиологии, 57 из них имели ХТЭЛГ (неоперабельные формы). Повторные ингаляции в течение дня проводились 6-9 раз по 2,5-5 мкг на ингаляцию (в среднем до 45 мкг в сутки). Илопрост улучшал клиническую симптоматику, толерантность к физическим нагрузкам, достоверно снижал ЛСС и частоту клинических событий. При использовании УЗ-небулайзеров длительность ингаляции составляет 5-10 мин. Илопрост отличается хорошей переносимостью. Наиболее частыми побочными эффектами были приливы и боли в челюсти. С 2010г ингаляционный илопрост одобрен для лечения среднетяжелой и тяжелой форм ЛАГ и неоперабельных форм ХТЭЛГ в нашей стране. В настоящее время ингаляционный илопрост является препаратом 2-й линии для постоянного лечения пациентов с ХТЭЛГ при наличии неоперабельной ХТЭЛГ или резидуальной формы после проведенной ТЭЭ. Препарат рекомендуется для назначения в виде моно- и комбинированной терапии. Ингаляционный илопрост рекомендуется для применения в раннем послеоперационном периоде: при сохранении резидуальной ЛГ (ЛСС > 500 дин/с/см-5 ) целесообразно назначение по схеме: 2 мл (1 ампула, 10 мкг) каждые 2-3 часа через контур ИВЛ – до 9 ингаляций в сутки.
Антагонисты рецепторов эндотелина (АРЭ)
Эндотелин-1 (ЭТ-1)- пептид эндотелиального происхождения, характеризующийся мощным вазоконтрикторным и митогенным свойствами в отношении гладкомышечных клеток. Эффекты ЭТ-1 реализуются за счет воздействия на два типа рецепторов- типа А (ЭТА), локализующиеся на гладкомышечных клетках и типа В (ЭТВ), локализующимися на эндотелиальных и гладкомышечных клетках. Активация ЭТА- и ЭТВ-рецепторов гладкомышечных клеток оказывает вазоконстрикторный и митогенный эффект. Стимуляция ЭТВ-рецепторов способствует клиренсу ЭТ-1 в легких, увеличению продукции оксида азота и освобождению простациклина. Активация системы эндотелина у больных ЛГ является обоснованием для использования антагонистов рецепторов к эндотелину, блокирующих ЭТА- рецепторы или одновременно оба типа рецепторов- ЭТА и ЭТВ. Бозентан - первый препарат из класса АРЭ неселективного действия, блокирующий оба типа рецепторов. В рандомизированном, плацебо-контролируемом исследовании BENEFIT (Bosentan Effects in inoperable Forms of chronic thromboembolic pulmonary hypertension) изучалась безопасность и эффективность бозентана у пациентов с неоперабельной ХТЭЛГ. У 157 больных с неоперабельной ХТЭЛГ терапия бозентаном в течение 16 недель по сравнению с плацебо приводила к улучшению таких показателей легочной гемодинамики, как ЛСС и сердечный индекс. При этом влияние препарата на дистанцию в Т6МХ (+2м) оказалось недостоверным. ФК и время до развития клинического ухудшения в результате терапии бозентаном по сравнению с плацебо существенно не менялись. Повышение уровня трансаминаз отмечается примерно у 10% больных дозозависимо и обратимо после уменьшения дозы или отмены препарата. Наиболее вероятным механизмом гепатотоксичного эффекта бозентана является дозозависимая конкуренция с переносчиком желчных кислот, что приводит к их задержке в гепатоцитах. Терапия бозентаном требует ежемесячного контроля уровня трансаминаз в крови. Рекомендуется назначение препарата в стартовой дозе 62,5мг дважды в сутки с последующим увеличением дозы до 125мг два раза в день под тщательным ежемесячным контролем ферментов печени. Бозентан может вызывать развитие анемии, что требует контроля уровней гемоглобина и гематокрита крови, а также задержку жидкости с появлением периферических отеков. У женщин, принимающих бозентан, необходима адекватная контрацепция с учетом возможного тератогенного эффекта.
Амбризентан- несульфонамидный АРЭ, производное пропаноевой кислоты, селективный антагонист рецепторов эндотелина типа А. В настоящее время препарат изучается в РКИ у больных ХТЭЛГ. АРЭ (бозентан, амбризентан) являются препаратами для лечения ХТЭЛГ 3-й линии:
• Бозентан 62,5мг х 2 раза (стартовая дозировка), рекомендуется повышение дозы до 125мг х 2 раза в сутки через 4 недели под контролем уровня трансаминаз.
• Амбризентан 5-10мг 1 раз в сутки.
Ингибиторы фосфодиэстеразы типа 5
Силденафил- мощный селективный ингибитор цГМФ- зависимой фосфодиэстеразы (тип 5), предотвращая деградацию цГМФ, вызывает снижение ЛСС и перегрузки ПЖ. Ингибиторы фосфодистеразы типа 5 (ИФДЭ-5) обладают антипролиферативным эффектом. В нашей стране с 2011г. для лечения больных ЛГ одобрен силденафил. К настоящему времени накоплены данные, демонстрирующие его хорошую переносимость и эффективность у больных с ЛГ различной этиологии. В неконтролируемых клинических исследованиях силденафил применялся при ИЛГ, ЛГ, ассоциированной с СЗСТ, ВПС, при ХТЭЛГ в разовых дозах 25-75мг 2-3 раза в сутки и вызывал улучшение гемодинамики, толерантности к физическим нагрузкам. Описаны редкие побочные эффекты препарата- головная боль, заложенность носа, приливы, нарушения зрения, диспепсия. В РКИ SUPER-1 включались только больные с ЛАГ (n=278), которые получали силденафила цитрат в дозах 20, 40, 80мг 3 раза в сутки, что приводило к улучшению клинической симптоматики, гемодинамики, толерантности к физическим нагрузкам. Одобренная доза составляет 20мг 3 раза в сутки. Однако стабильный эффект лечения отмечался только при применении дозы 80мг 3 раза в сутки. У больных с ХТЭЛГ в РКИ эффективность и безопасность силденафила не изучались (назначение off-label).
Антагонисты кальция могут назначаться больным с ХТЭЛГ в редких случаях при положительной ОФП по данным КПОС, что указывает на присутствие вазоспастического компонента. Препаратами выбора являются дигидропиридиновые производные или дилтиазем (при склонности к тахокардии). Однако эффективность антагонистов кальция в высоких дозах при ХТЭЛГ не доказана. В качестве дополнительной терапии этот класс препаратов востребован при сопутствующей АГ или ИБС.
6.4. Баллонная ангиопластика легочных артерий
Развитие эндоваскулярных технологий направлено на разработку альтернативной методики лечения неоперабельных пациентов с ХТЭЛГ. Баллонная ангиопластика может рассматриваться у ряда пациентов с ХТЭЛГ в случае невозможности оперативного лечения или резидуальной ЛГ после операции легочной ТЭЭ, хотя надежная доказательная база пока отсутствует. Тем не менее, в рекомендациях, принятых Европейским обществом кардиологов и Европейским респираторным обществом в 2015 году, ангиопластика при дистальном типе поражения легочных артерий вошла в структуру алгоритма лечения ХТЭЛГ с уровнем доказательности IIb. Баллонная ангиопластика ЛА при ХТЭЛГ представляет собой сложное многоэтапное вмешательство, требующее специальной подготовки бригады. Фиброзирующее поражение множества сегментарных ветвей, распространение поражения до уровня субсегментарных артерий, высокое давление в легочной артерии затрудняют выполнение вмешательства и могут приводить к развитию различных осложнений. К этому следует добавить трудности катетеризации дистальных ветвей ЛА и опасности введения больших объемов контрастного вещества. Требуется тщательная подготовка больного к процедуре, в том числе медикаментозная, а во время вмешательства должен постоянно присутствовать анестезиолог или специалист по интенсивной терапии. К настоящему времени в ряде стран, включая Россию, накоплен определенный позитивный опыт, демонстрирующий улучшение функционального и гемодинамического статуса у пациентов с дистальной формой заболевания. У большинства больных удается снизить ДЛА и ЛСС, снизить уровень NT-proBNP. В среднем, для достижения позитивных результатов требуется проведение двух и более сессий с перерывами 14-21 дней.
. Основной проблемой, как и при операциях ТЭЭ, является реперфузионный отек легких. По данным японских авторов, частота тяжелого реперфузионного отека, требующего применения методов вспомогательной или полной искусственной вентиляции легких, составила 6%. Факторами риска реперфузионного повреждения при ангиопластике являются: степень повышения ДЛА и ЛСС, большое количество открытых в результате одной процедуры сосудов (больше 2-х сегментарных артерий), первая выполненная у пациента процедура. Методами профилактики реперфузионного повреждения легких являются: поэтапное баллонирование пораженной артерии 2-мя или 3-мя баллонами, начиная с баллона минимального диаметра, до баллона, соответствующего референсному диаметру артерии. Форсированный диурез после вмешательства, использование СРАР-терапии и горизонтальное нахождение больного на контралатеральной стороне (на боку) в течение 12-и часов после вмешательства. В ряде случаев может потребоваться поддержка ЭКМО. Редким, но достаточно опасным осложнением процедурыявляется кровохаркание, развивающееся вследствие перфорации артерии проводником. В случае невозможности купирования осложнения введением протамин-сульфата, предпринимается эндоваскулярное окклюзирование поврежденной артерии, которое в большинстве случаев купирует состояние.
6.5. Трансплантация легких/комплекса сердце-легкие
Трансплантация легкого/легких или комплекса сердце-легкие может рассматриваться в качестве возможного варианта лечения у пациентов с неоперабельной ХТЭЛГ или с тяжелой резидуальной ЛГ. С трансплантацией связаны такие проблемы, как дефицит донорских органов, пожизненное применение иммуносупрессантов, хронические инфекции. Риск осложнений значительно выше у пациентов, которым была проведена ТЭЭ с развитием резидуальной ЛГ. В лист ожидания не включаются пациенты с ожидаемой продолжительностью жизни менее 1 года при функциональном классе III-IV с недавно развившимся ухудшением в виде тяжелой одышки или гемодинамической нестабильности. Общий уровень смертности после трансплантации у пациентов с ХТЭЛГ составляет около 20%, независимо от типа трансплантации (односторонняя, билатеральная или комбинация [сердце-легкие] с 5-летней выживаемостью- примерно 50%.
6.6. Алгоритм ведения пациентов
· После установления диагноза ХТЭЛГ начальные мероприятия связаны с соблюдением общих рекомендаций и назначением поддерживающей терапии.
· Пациенты с верифицированным диагнозом ХТЭЛГ должны пожизненно получать антикоагулянты (рисунок 7). Препаратом выбора является антагонист витамина К варфарин с достижением целевого МНО 2,5-3,5.
· Решение о выборе лечебной тактики у пациентов с ХТЭЛГ должно приниматься в Экспертном центре по проблеме ХТЭЛГ в результате междисциплинарного консилиума, включающего терапевтов, рентгенологов, хирургов, обладающих достаточным опытом оперативного лечения ХТЭЛГ (таблица 13).
· Легочная тромбэндартерэктомия показана всем пациентам с ХТЭЛГ, которые оцениваются в экспертном центре как операбельные.
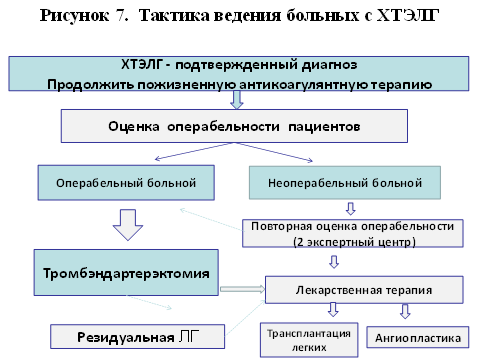
· В случае признания пациента неоперабельным требуется повторная оценка операбельности во 2-ом экспертном центре.
· ЛАГ-специфическая терапия, может быть назначена в Экспертном центре по проблеме ЛГ после проведения соответствующих диагностических процедур.
· Предоперационная подготовка больного может включать назначение ЛАГ-специфической терапии сроком до 2 мес.
· Интраоперационно и в раннем послеоперационном периоде по усмотрению оперирующей бригады профилактически могут быть назначены ЛАГ-специфические препараты с парентеральным и ингаляционным путем введения. При наличии признаков резидуальной ЛГ может быть назначена постоянная ЛАГ-специфическая терапия.
· После операции ТЭЭ пациенты должны получать терапию лечебными дозами антикоагулянтов пожизненно. Предпочтительно назначение непрямых антикоагулянтов с целевым МНО 2,5-3,5. Эффективность других антикоагулянтов не доказана или находится в процессе исследования.
· Через 6-12 мес после операции ТЭЭ все пациенты должны быть оценены на предмет ризидуальной легочной гипертензии, с использованием, при необходимости, инвазивных методов
· Препаратом первого выбора для лечения больных с неоперабельными или резидуальными формами ХТЭЛГ является стимулятор гуанилатциклазы риоцигуат.
· Ингаляционный илопрост, как средство 2-й линии, можно рекомендовать в виде моно- и комбинированной терапии. АРЭ и силденафил рассматриваются в качестве лекарственных препаратов 3-й линии.
· Через 6 месяцев после назначения препарата целесообразно оценить его эффективность и принять решение о необходимости продолжения лечения.
· Баллонная ангиопластика может рассматриваться у ряда пациентов с ХТЭЛГ в случае невозможности оперативного лечения или резидуальной ЛГ после операции легочной ТЭЭ.
· Трансплантация легкого/ легких или комплекса сердце-легкие показана больным с ХТЭЛГ при неадекватном клиническом эффекте всех доступных методов лечения и должна проводиться только в экспертных центрах.
Таблица 13. Рекомендации по лечению пациентов с ХТЭЛГ
Дата добавления: 2019-01-14; просмотров: 302; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
