Задачи для самостоятельного решения
3.1. Растворимость CaCO3 при 35оС равна 6,9∙10–5 моль/л. Вычислить произведение растворимости этой соли.
3.2. Вычислить произведение растворимости PbBr2 при 25 оС, если растворимость соли при этой температуре равна 1,32∙10–2 моль/л.
3.3. В 500 мл воды при 18 оС растворяется 0,0166 г Ag2CrO4. Чему равно произведение растворимости этой соли?
3.4. Для растворения 1,16 г PbI2 потребовалось 2 л воды. Найти произведение растворимости соли.
3.5. Исходя из произведения растворимости карбоната кальция, найти массу CaCO3, содержащуюся в 100 мл его насыщенного раствора.
3.6. Найти массу серебра, находящегося в виде ионов в 1 л насыщенного раствора AgBr.
3.7. Вычислить объем воды, необходимый для растворения при 25оС 1г BaSO4.
3.8. В каком объеме насыщенного раствора Ag2S содержится 1 мг растворенной соли?
3.9. Во сколько раз растворимость (в моль/л) Fe(OH)2 в воде больше растворимости Fe(OH)3 при 25 оС?
3.10. Образуется ли осадок сульфата серебра, если к 0,02 М раствору AgNO3 добавить равный объем 1 н. раствора H2SO4?
3.11. К 50 мл 0,001 н. раствора HCl добавили 450 мл 0,0001 н. раствора AgNO3. Выпадет ли осадок хлорида серебра?
3.12. Образуется ли осадок хлорида свинца, если к 0,1 н. раствору Pb(NO3)2 добавить равный объем 0,4 н. раствора NaCl?
3.13. Во сколько раз уменьшится концентрация ионов серебра в насыщенном растворе AgCl, если прибавить к нему столько соляной кислоты, чтобы концентрация ионов Cl- в растворе стала равной 0,03 моль/л?
3.14. Вычислить растворимость (в моль/л) CaF2 в воде и в 0,05 М растворе CaCl2. Во сколько раз растворимость во втором случае меньше, чем в первом?
|
|
|
3.15. Во сколько раз растворимость AgCl в 0,001 н. растворе NaCl меньше, чем в воде?
3.16. В каком из указанных случаев раствор электролита МХ ненасыщен: а) [Mz+][Xz-] < ПР; б) [Mz+][Xz-] = ПР; в) [Mz+][Xz-] > ПР?
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ.
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
Примеры решения задач
Пример 1. Концентрация ионов водорода в растворе равна 4∙10–3 моль/л. Определить рН раствора.
Решение: рН = -lg(4∙10–3) = -(lg4 + lg10-3)=3-0,6=2,4
Пример 2. Определить концентрацию [H+] в растворе, рН которого равен 4,60.
Решение: рН = -lg[H+] = 4,6; Перенесем знак минус lg[H+]=-рН=-4,6; чтобы мантисса логарифма стала положительной величиной, произведем следующее действие 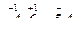 следовательно, [H+] = 2,5∙10–5 моль/л.
следовательно, [H+] = 2,5∙10–5 моль/л.
Пример 3. Чему равна концентрация [OH–] в растворе, рН которого равен 10,80?
Решение: Из соотношения рН + рОН = 14 имеем рОН = 14 – рН = 3,20.
Отсюда -lg[OH–] = 3,2; lg[OH–] = -3,20= 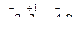 .
.
Этому значению логарифма соответствует значение
[OH–] = 6,31∙10–4 моль/л.
Пример.4. Определить концентрацию HCO3– и CO32– в 0,01М растворе H2CO3, если рН этого раствора равен 4,18.
Решение: Найдем концентрацию [H+] в растворе
-lg[H+] = 4,18; 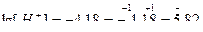
[H+] = 6,61∙10–5 моль/л
|
|
|
H2CO3  H++HCO3– диссоциация по первой ступени
H++HCO3– диссоциация по первой ступени
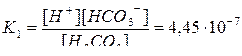
Подставляя значения [H+] и [H2CO3], находим
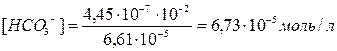
HCO3– 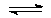 H++CO32– диссоциация по второй ступени
H++CO32– диссоциация по второй ступени
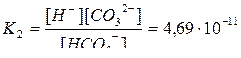
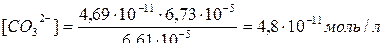 .
.
Задачи для самостоятельного решения
4.1. Найти молярную концентрацию ионов H+ в водных растворах, в которых концентрация гидроксид-ионов (в моль/л) составляет:
а) 10-4; б) 3,2∙10-6; в) 7,4∙10-11.
4.2. Найти молярную концентрацию ионов OH– в водных растворах, в которых концентрация ионов водорода (в моль/л) равна:
а) 10-3; б) 6,5∙10-8; в) 1,4∙10-12.
4.3. Вычислить рН растворов, в которых концентрация ионов H+ (в моль/л) равна: а) 2∙10-7; б) 8,1∙10-3; в) 2,7∙10-10.
4.4. Вычислить рН растворов, в которых концентрация ионов OH– (в моль/л) равна: а) 4,6∙10-4; б) 5∙10-6; в) 9,3∙10-9.
4.5. Вычислить рН 0,01 н. раствора уксусной кислоты, в котором степень диссоциации кислоты равна 0,042.
4.6. Определить рН раствора, в 1 л которого содержится 0,1 г NaOH. Диссоциацию щелочи считать полной.
4.7. Во сколько раз концентрация ионов водорода в крови (рН = 7,36) больше, чем в спинномозговой жидкости (рН = 7,53)?
4.8. Определить [H+] и [OH–] в растворе, рН которого равен 6,2.
4.9. Вычислить рН следующих растворов слабых электролитов: а) 0,02 М NH4OH; б) 0,1 М HCN; в) 0,05 н. HCOOH; г) 0,01 М CH3COOH.
4.10. Чему равна концентрация раствора уксусной кислоты, рН которого равен 5,2?
|
|
|
4.11. Вычислить значения 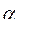 и
и 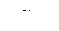 в 0,2 н. растворе NaOH, считая
в 0,2 н. растворе NaOH, считая 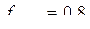 .
.
4.12. Используя данные табл. 3 Приложения, найти 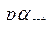 0,005 н. раствора HCl, содержащего, кроме того, 0,015 моль/л NaCl.
0,005 н. раствора HCl, содержащего, кроме того, 0,015 моль/л NaCl.
4.13. Степень диссоциации слабой одноосновной кислоты в 0,2 н. растворе равна 0,03. Вычислить значения [H+], [OH–] и pOH для этого раствора.
4.14. Рассчитать рН раствора, полученного смешением 25 мл 0,5 М раствора HCl, 10 мл 0,5 М раствора NaOH и 15 мл воды. Коэффициенты активности ионов принять равными единице.
4.15. Вычислить рН 0,1 н. раствора уксусной кислоты, содержащего, кроме того, 0,1 моль/л CH3COONa. Коэффициенты активности ионов считать равными единице.
4.16. Как изменится рН, если вдвое разбавить водой: а) 0,2 М раствор HCl; б) 0,2 М раствор CH3COOH; в) раствор, содержащий 0,1 моль/л CH3COOH и 0,1 моль/л CH3COONa?
4.17. Указать, какие из рядов перечисленных ниже кислот соответствуют возрастанию рН в растворах одинаковой молярной концентрации: а) HCN, HF, HOCl, HCOOH, CH2ClCOOH; б) HNO3, HNO2, CH3COOH, HCN; в) HCl, CH2ClCOOH, HF, H3BO3.
4.18. В 0,01 н. растворе одноосновной кислоты рН = 4. Какое утверждение о силе этой кислоты правильно: а) кислота слабая; б) кислота сильная.
4.19. Как изменится кислотность 0,2 н. раствора HCN при введении в него 0,5 моль/л KCN: а) возрастает; б) уменьшится; в) не изменится?
|
|
|
4.20. Как надо изменить концентрацию ионов водорода в растворе, чтобы рН раствора увеличился на единицу: а) увеличить в 10 раз; б) увеличить на 1 моль/л; в) уменьшить в 10 раз; г) уменьшить на 1 моль/л?
4.21. Сколько ионов водорода содержится в 1 мл раствора, рН которого равен 13: а) 1013; б) 60,2∙1013; в) 6,02∙107; г) 6,02∙1010?
4.22. Как изменится рН воды, если к 10 л ее добавить 10–2 моль NaOH: а) возрастет на 2; б) возрастет на 3; в) возрастет на 4; г) уменьшится на 4?
Дата добавления: 2018-11-24; просмотров: 505; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
