ТЕМПЕРАТУРА КИПЕНИЯ И ЗАМЕРЗАНИЯ РАСТВОРОВ.
ЭБУЛЛИОСКОПИЧЕСКИЙ И КРИОСКОПИЧЕСКИЙ ЗАКОНЫ РАУЛЯ
Примеры решения задач
Пример 1.
Определите температуру кипения и замерзания раствора, содержащего 1 г нитробензола C6H5NO2 в 10 г бензола. Эбулиоскопическая и криоскопическая константы равны 2,57 и 5,1 °С. Температура кипения чистого бензола
80,2 °С, температура замерзания –5,4°С.
Решение:
По закону Рауля:


где ∆tзам и ∆tкип – соответственно понижение температуры замерзания и повышение температуры кипения раствора; Кк и Кэ – соответственно криоскопическая и эбуллиоскопическая константы растворителя; g- масса растворенного вещества, г; G- масса растворителя, г; Мr- молекулярная масса растворенного вещества; Mr(С6H5NO2)= 123,11.
Повышение температуры кипения раствора нитробензола в бензоле:

Температура кипения раствора: tкип=80,2+2,09=82,29 °C.
Понижение температуры замерзания раствора нитробензола в бензоле:
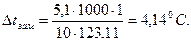
Температура замерзания раствора tзам= 5,4 – 4,14 =1,26 °C.
Пример 2 Раствор камфоры массой 0,522 г в 17 г эфира кипит при температуре на 0,461 ºС выше, чем чистый эфир. Эбуллиоскопическая константа эфира 2,16 ºС. Определите молекулярную массу камфоры.
Решение:
Молекулярную массу камфоры определяем, пользуясь соотношением
Mr= 
Молекулярная масса камфоры равна 155,14.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
6.1. Вычислить повышение температуры кипения раствора, содержащего 0,488 г бензойной кислоты С7Н6О2 в 50,0 г хлороформа Ехлороформа=3, 88 град. Ответ: 0,31 град.
6.2. Вычислить температуру кипения раствора, содержащего 0,5 моль растворенного вещества в 1000 г ацетона. Eацетона=1,5 град; температура кипения ацетона 56,0 град. Ответ: 56,75 град.
6.3. Вычислить температуру кипения раствора анилина в этиловом эфире, содержащего 12 г анилина С6Н5NH2 в 200 г раствора. Еэфира=2,12 град; температура кипения эфира 35,6 град. Ответ: 37°С.
6.4. В каком количестве сероуглерода нужно растворить 0,1 моль вещества, чтобы раствор кипел при 47°С? Температура кипения сероуглерода46,3°С;ЕCS2 =2,29 град.Ответ: 327 г.
6.5. Температура кипения эфира 35,6°С, Еэфира=2,12 град. Вычислить молекулярную массу бензойной кислоты, если 10%-ный раствор ее в эфире кипит при 37,53°С. Ответ: 122.
6.6. Раствор, содержащий 4,6 г глицерина С3Н5(ОН)3 в 200 г ацетона, кипит при 56,73°С. Чистый ацетон закипает при 56,3°C. Вычислить эбуллиоскопическую константу ацетона. Ответ: 1,72°.
6.7. Сколько граммов глюкозы С6Н12О6 растворено в 500 г воды, если раствор закипает при 100,258°С? Ответ: 45,35 г.
6.8. Сколько глицерина С3Н5(ОН)3 надо взять на 2 л воды, чтобы получить раствор с температурой кипения 106°С? Ответ: 2,156 кг.
6.9. 5 г некоторого вещества растворено в 200 г воды. Температура кипения раствора 100,432°С. Вычислить молекулярную массу растворенного вещества. Ответ: 29,6.
6.10. Температура кипения раствора 0,36 г фосфора в 60 г сероуглерода (Е=2,4 град) на 0,12°С выше, чем у чистого растворителя. Чему равна молекулярная масса фосфора в растворе? Сколько атомов фосфора заключается в одной молекуле?
Ответ: Р4.
6.11. Температура кипения раствора 12,8 г серы в 250 г бензола (Е=2,57 град.) на 0,514°С выше, чем у чистого растворителя. Вывести молекулярную формулу серы в растворенном состоянии. Сколько атомов серы входит в состав одной молекулы этого вещества? Ответ: S8.
6.12. Определите температуру кипения 10%-ного водного раствора глюкозы С6Н12O6. Ответ: 100,32°C.
6.13. Определите температуру кипения раствора 1 г нафталина С10Н8 в 20 г эфира, если температура кипения эфира равна 35,6°С, а Е=2,16°. Ответ: 36,44 °С.
6.14. Раствор, состоящий из 9,2 г иода и 100 г метилового спирта, закипает при 65,0°С. Сколько атомов входит в состав молекулы иода, находящегося в растворенном состоянии? Температура кипения спирта 64,7°С, а E=0,84°. Ответ: I 2.
6.15. Вычислить температуру кипения раствора, содержащего 100 г сахара С12Н22О11 в 750 г воды. Ответ: 100,2°С.
6.16. Вычислить процентное содержание сахара С12Н22O11 в растворе, температура кипения которого 100,13°С. Ответ: 7,88%.
6.17. В каком количестве воды следует растворить 23 г глицерина С3Н8О3, чтобы получить раствор с температурой кипения 100,104°С? Ответ: 1250 г.
6.18. Какая часть моля сахара C12H22O11приходится на 1 моль воды в растворе, температура кипения которого 100,039°С? Ответ: 1,35∙10-3 моль.
6.19. В скольких молях воды следует растворить 0,02 моля некоторого неэлектролита для получения раствора с температурой кипения 100,026°С? Ответ: 22,2 моль.
6.20. Температура кипения ацетона 56,1°С, а Е=1,73°. Вычислить температуру кипения 8%-ного раствора глицерина С3Н803 в ацетоне. Ответ: 57,73°С.
6.21. Температура кипения эфира 34,5°С, а Е=2,16°. Вычислить молекулярную массу бензойной кислоты, если известно, что 5%-ный раствор этой кислоты в эфире кипит при 35,53°С. Ответ: 122.
6.22. Температура кипения разбавленного раствора сахара C12H22O11 100,065°С. Вычислить осмотическое давление раствора при 0°С. Плотность раствора принять равной единице. Ответ: 271,5 кПа.
6.23. Раствор 55,4 г неэлектролита в 2,5 л воды кипит при 100,16°С. Чему равна молекулярная масса неэлектролита? Ответ: 72,0.
6.24. Повышение температуры кипения раствора 0,94 г фенола С6Н5ОН в 50 г этилового спирта (Е=1,16 град) 0,232°С. Найти молекулярную массу фенола. Ответ:94.
6.25. Раствор 15г хлороформа в 400г диэтилового эфира (Е=2,02 град) кипит при температуре, превышающей температуру кипения растворителя на 0,635°C. Вычислите молекулярную массу хлороформа. Ответ: 119,3.
6.26. При какой температуре должен кипеть раствор, содержащий 0,062 моль неэлектролита в 200 мл воды? Ответ: 100,16°С.
6.27. Раствор, содержащий 2,3 г С3Н8О3 в 100г ацетона (Ткип.=56,30С), кипит при 56,730С. Найдите Е для ацетона. Ответ: 1,720С.
6.28. Сколько граммов сахара С12H22O11 надо растворить в 100 г воды, чтобы а) повысить температуру кипения на 1 градус? б) Понизить температуру замерзания на 1 град? Ответ: а) 65,8 г; б) 18,4 г.
6.29. При растворении 13 г неэлектролита в 400 г диэтилового эфира (С2Н5)2O температура кипения повысилась на 0,453 градуса. Определить молекулярную массу растворенного вещества. Ответ: 145.
6.30. Температура кипения водного раствора сахара C12H22O11 равна 101,4°С. Вычислить моляльность раствора. При какой температуре замерзает этот раствор? Ответ: 2 моль/кг; -3,72°С.
6.31. Вычислить понижение температуры замерзания раствора, содержащего 0,2 моль растворенного вещества в 750 г бензола (К=5,12 град). Ответ: 1,365 град.
6.32. Температура замерзания уксусной кислоты 16,65°С, а К=3,9 град. Вычислить температуру замерзания раствора, содержащего 0,1 моль растворенного вещества в 150 г уксусной кислоты. Ответ: 14,05 °С.
6.33. Вычислить температуру замерзания 10%-ного водного раствора глюкозы С6Н12О6. Ответ: -1,048 °С.
6.34. Температура замерзания бензола 5,5°С Криоскопическая константа 5,12 град. Сколько молей растворенного вещества содержится в 125 г бензола, если раствор замерзает при 4,99 °С? Ответ: 0,012 моль.
6.35. Сколько глицерина С3Н803 нужно растворить в 200 г воды, чтобы раствор замерзал при -1 °С? Ответ: 9,9 г.
6.36. Водный раствор сахара замерзает при -1,05°С. Сколько процентов сахара содержит этот раствор, если молекулярная масса сахара 342?
Ответ: 16,2%
6.37. Раствор, содержащий 1,74 г растворенного вещества в 45,0 г воды, замерзает при -1,2°С. Вычислить молекулярную массу растворенного вещества. Ответ: 60.
6.38. Антифризы - жидкости с пониженной температурой замерзания, применяемые в системах охлаждения двигателей. Вычислить количество этиленгликоля С2Н4(ОН)2 которое необходимо прибавить к 1 кг воды для приготовления антифриза с температурой замерзания -15°С. Ответ: 500 г.
6.39. При растворении 0,502 г ацетона (СН3)2 CO в 100 г уксусной кислоты температура замерзания понижается на 0,339° C. Вычислить криоскопическуго константу уксусной кислоты. Ответ: 3,92 град.
6.40. Сколько граммов нафталина С10Н8 содержится в 3 кг бензола, если раствор замерзает при 4,55°С? Т.зам. бензола 5,5°С, а К=5,1 град. Ответ: 71,5 г.
6.41. В 250 г воды растворено 1,6 г некоторого неэлектролита. Температура замерзания раствора -0,2°С. Вычислить молекулярную массу неэлектролита.
Ответ: 59,5.
6.42. Раствор, содержащий 6 г мочевины в 50 г воды, замерзает при -3,72°С. Вычислить молекулярную массу мочевины. Ответ: 60.
6.43. Для приготовления охлаждающей жидкости на 20 л воды взято 6 л глицерина С3Н803. Чему равна температура замерзания приготовленной смеси? Плотность глицерина равна 1,26 г/мл. Ответ: -7,56°С.
6.44. Формалин, уксусная кислота и глюкоза имеют одинаковый элементарный состав: С - 39,97%; Н - 6,73% и О - 53,30%. Приготовлены три раствора: по 1,5 г каждого из перечисленных веществ на 25 г воды. Температура замерзания растворов равны: первого - 3,72 °C, второго -1,86°С и третьего - 0,62°С, Вывести молекулярные формулы указанных веществ. Ответ: Формалин СН2O; уксусная кислота СН3СOOН; глюкоза С6Н12O6.
6.45. Раствор 1,05 г неэлектролита в 30 г воды замерзает при -0,7°С. Вычислите молекулярную массу неэлектролита. Ответ: 92,5.
6.46. Какова температура замерзания раствора неэлектролита, содержащего 2,02∙1023 молекул в литре воды? Ответ: -0,62°С.
6.47. Определите формулу вещества, содержащего 39,34% углерода, 8,20% водорода и 52,46% серы, если раствор 0,2 г этого вещества в 26 г бензола замерзает при температуре на 0,318° ниже, чем чистый бензол. Oтвет: C4H10S2.
6.48. Понижение температуры замерзания раствора 0,052 г камфоры в 26 г бензола равно 0,067°C . Рассчитайте молекулярную массу камфоры. Ответ: 152,2.
6.49. Для приготовления охлаждающей жидкости на 30 л воды взято 9 л глицерина С3Н8О3. Чему равна температура замерзания приготовленного раствора? Плотность глицерина равна 1,261 г/мл. Ответ: 7,6°С.
6.50. При какой температуре будет замерзать 25%-ный раствор этилового спирта С2Н5ОН в воде? Ответ: -13,4°С.
6.51. При какой температуре будет замерзать раствор, содержащий в 4 л воды 500 г этиленгликоля С2Н4(ОН)2? Ответ: -3,73°C.
6.52. Сколько граммов нафталина С10Н8 находится в 8 кг бензола, если этот раствор замерзает при 3,4 5°С? Температура замерзания чистого бензола 5,40 °С. Ответ: 392 г
6.53. Вычислить процентное содержание сахара С12Н22О11 в водном растворе, температура замерзания которого -0,41°С. Ответ: 7%.
6.54. Вычислить температуру замерзания водного раствора мочевины СО(NH2)2, в котором на 100 молей воды приходится 1 моль растворенного вещества. Ответ: -1,033°С.
6.55. Раствор сахара С12H22O11 оказывает при 27°C осмотическое давление, равное 156 кПа. Принимая плотность раствора равной единице, вычислить температуру его замерзания. Ответ: -0,119°С.
6.56. В каком количестве воды следует растворить 0,5 кг глицерина С3H8O3 для получения раствора с температурой замерзания - 3°С? Ответ: 3,37 кг.
6.57. При растворении 0,4 г некоторого вещества в 10 г воды температура замерзания раствора понижается на 1,24°C. Вычислить молекулярную массу растворенного вещества. Ответ: 60.
6.58. Водный раствор глицерина замерзает при температуре -2,79°С. Вычислить число молей глицерина, приходящихся на каждые 100 молей воды, и давление пара раствора при 20°С. Давление пара воды при 20°С равно 2,34 кПа Ответ: 2,7 моля.
6.59. Раствор сахара в воде показывает повышение температуры кипения на 0,312 °С. Вычислить величину понижения температуры замерзания этого раствора. Ответ: 1,116°С.
6.60. Давление пара водного раствора глицерина составляет 98% от давления пара воды при той же температуре. Вычислить процентное содержание глицерина в растворе и температуру кристаллизации раствора. Ответ: 9,44%; -2,1°С.
Дата добавления: 2018-11-24; просмотров: 8342; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
