Варианты заданий для самостоятельной работы
| Номер варианта | Номера задач | |||||||
| 1 | 1.1 | 2.1 | 2.31 | 3.1 | 4.1 | 5.1 | 6.1 | 6.31 |
| 2 | 1.2 | 2.2 | 2.32 | 3.2 | 4.2 | 5.2 | 6.2 | 6.32 |
| 3 | 1.3 | 2.3 | 2.33 | 3.3 | 4.3 | 5.3 | 6.3 | 6.33 |
| 4 | 1.4 | 2.4 | 2.34 | 3.4 | 4.4 | 5.4 | 6.4 | 6.34 |
| 5 | 1.5 | 2.5 | 2.35 | 3.5 | 4.5 | 5.5 | 6.5 | 6.35 |
| 6 | 1.6 | 2.6 | 2.36 | 3.6 | 4.6 | 5.6 | 6.6 | 6.36 |
| 7 | 1.7 | 2.7 | 2.37 | 3.7 | 4.7 | 5.7 | 6.7 | 6.37 |
| 8 | 1.8 | 2.8 | 2.38 | 3.8 | 4.8 | 5.8 | 6.8 | 6.38 |
| 9 | 1.9 | 2.9 | 2.39 | 3.9 | 4.9 | 5.9 | 6.9 | 6.39 |
| 10 | 1.10 | 2.10 | 2.40 | 3.10 | 4.10 | 5.10 | 6.10 | 6.40 |
| 11 | 1.11 | 2.11 | 2.41 | 3.11 | 4.11 | 5.11 | 6.11 | 6.41 |
| 12 | 1.12 | 2.12 | 2.42 | 3.12 | 4.12 | 5.12 | 6.12 | 6.42 |
| 13 | 1.13 | 2.13 | 2.43 | 3.13 | 4.13 | 5.13 | 6.13 | 6.43 |
| 14 | 1.14 | 2.14 | 2.44 | 3.14 | 4.14 | 5.14 | 6.14 | 6.44 |
| 15 | 1.15 | 2.15 | 2.45 | 3.15 | 4.15 | 5.15 | 6.15 | 6.45 |
| 16 | 1.16 | 2.16 | 2.46 | 3.16 | 4.16 | 5.16 | 6.16 | 6.46 |
| 17 | 1.17 | 2.17 | 2.47 | 3.17 | 4.17 | 5.17 | 6.17 | 6.47 |
| 18 | 1.18 | 2.18 | 2.48 | 3.18 | 4.18 | 5.18 | 6.18 | 6.48 |
| 19 | 1.19 | 2.19 | 2.49 | 3.19 | 4.19 | 5.19 | 6.19 | 6.49 |
| 20 | 1.20 | 2.20 | 2.50 | 3.20 | 4.20 | 5.20 | 6.20 | 6.50 |
| 21 | 1.21 | 2.21 | 2.51 | 3.21 | 4.21 | 5.21 | 6.21 | 6.51 |
| 22 | 1.22 | 2.22 | 2.52 | 3.22 | 4.22 | 5.22 | 6.22 | 6.52 |
| 23 | 1.23 | 2.23 | 2.23 | 3.23 | 4.23 | 5.23 | 6.23 | 6.53 |
| 24 | 1.24 | 2.24 | 2.54 | 3.24 | 4.24 | 5.24 | 6.24 | 6.54 |
| 25 | 1.25 | 2.25 | 2.55 | 3.25 | 4.25 | 5.25 | 6.25 | 6.55 |
| 26 | 1.26 | 2.26 | 2.56 | 3.26 | 4.26 | 5.26 | 6.26 | 6.56 |
| 27 | 1.27 | 2.27 | 2.57 | 3.27 | 4.27 | 5.27 | 6.27 | 6.57 |
| 28 | 1.28 | 2.28 | 2.58 | 3.28 | 4.28 | 5.28 | 6.28 | 6.58 |
| 29 | 1.29 | 2.29 | 2.59 | 3.29 | 4.29 | 5.29 | 6.29 | 6.59 |
| 30 | 1.30 | 2.30 | 2.60 | 3.30 | 4.30 | 5.30 | 6.30 | 6.60 |
Список рекомендуемой литературы
|
|
|
1. Л.М.Романцева, З.Л.Лещинская, В.А.Суханова. Сборник задач и упражнений по общей химии.- М.: Высшая школа, 1991.288с.
2. Н.Л. Глинка. Задачи и упражнения по общей химии.- М.: Интеграл-пресс, 2006. 240с.
3. З.Е. Гольбрайх, Е.И. Маслов.- Сборник задач и упражнений по химии.- М.: Астрель, 2004.382с.
4. Н.В. Коровин. Задачи и упражнения по общей химии.- М.: Высшая школа, 2004.255с.
5. Ю.М. Корнеев и др. Задачи и вопросы по общей и неорганической химии,- М.: Мир, 2004.367с.
ЗАДАНИЕ №5
по теме: "РАСТВОРЫ ЭЛЕКТРОЛИТОВ"
ВЫЧИСЛЕНИЕ СТЕПЕНИ ДИССОЦИАЦИИ СЛАБЫХ ЭЛЕКТРОЛИТОВ
Примеры решения задач
Пример 1. Степень диссоциации уксусной кислоты (α) в 0,1 М растворе равна 1,32∙10–2. Найти константу диссоциации кислоты (К) и значение рК.
Решение: Подставим данные задачи в уравнение закона разбавления Оствальда
К = α2CM/(1–α) = 1,77∙10–5 pK = -lg K = 4,75
Пример 2. Вычислить концентрацию ионов водорода в 0,1 М растворе хлорноватистой кислоты HClO (K=5∙10-8).
Решение: Найдем степень диссоциации HClO(α)
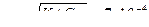 . Отсюда [H+] = α∙CM = 7∙10–5 моль.
. Отсюда [H+] = α∙CM = 7∙10–5 моль.
Задачу можно решить и другим способом, используя соотношение
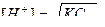 тогда [H+] = 7∙10–5 моль/л.
тогда [H+] = 7∙10–5 моль/л.
Пример 3. Во сколько раз уменьшится концентрация ионов водорода в 0,2 М растворе HCOOH (K = 0,8∙10–4), если к 1 л этого раствора добавить 0,1 моль HCOONa. Считать, что соль полностью диссоциирована.
|
|
|
Решение: HCOOH  H+ + НCOO–
H+ + НCOO–
HCOONa → HCOO– + Na+
Исходная концентрация ионов водорода:
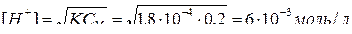 .
.
Концентрацию ионов водорода в растворе после добавления соли обозначим х. Тогда концентрация недиссоциированных молекул кислоты равна (0,2-х). Концентрация же ионов HCOO– слагается из двух величин: из концентрации, создаваемой диссоциацией молекул кислоты, и концентрации, обусловленной присутствием в растворе соли. Общая концентрация ионов HCOO– равна, следовательно, (0,1+х). Подставляем в формулу константы равновесия
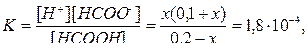 откуда х = 3,6∙10–4 моль/л.
откуда х = 3,6∙10–4 моль/л.
Сравнивая исходную концентрацию ионов водорода с найденной, находим, что прибавление соли HCOONa вызвало уменьшение концентрации ионов [H+] в 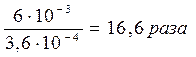
Подставляем в формулу константы равновесия
Задачи для самостоятельного решения
1.1. Константа диссоциации масляной кислоты C3H7COOH 1,5∙10–5. Вычислить степень её диссоциации в 0,005 М растворе.
1.2. Найти степени диссоциации в 0,2 н. растворах: а) HClO; б)HF; в)HCN; г)CH3COOH.
1.3. Степень диссоциации муравьиной кислоты HCOOH в 0,2 н. растворе равна 0,03. Определить константу диссоциации кислоты и значение рК.
|
|
|
1.4. Степень диссоциации угольной кислоты H2CO3 по первой ступени в 0,1 н. растворе равна 2,11∙10–3. Вычислить К1.
1.5. При какой концентрации раствора степень диссоциации азотистой кислоты HNO2 будет равна 0,2?
1.6. В 0,1 н. растворе степень диссоциации уксусной кислоты равна 1,32∙10–2. При какой концентрации азотистой кислоты HNO2 ее степень диссоциации будет такой же?
1.7. Сколько воды нужно прибавить к 300 мл 0,2 М раствора уксусной кислоты, чтобы степень диссоциации кислоты удвоилась?
1.8. Чему равна концентрация ионов водорода H+ в водном растворе муравьиной кислоты, если степень диссоциации α = 0,03?
1.9. Вычислить [H+] в 0,02 М растворе сернистой кислоты. Диссоциацией кислоты по второй ступени пренебречь.
1.10. Вычислить [H+], [HSe–] и [Se2–] в 0,05 М растворе H2Se.
1.11. Во сколько раз уменьшится концентрация ионов водорода, если к 1 л 0,005 М раствора уксусной кислоты добавить 0,05 моля ацетата натрия?
1.12. Рассчитать концентрацию ионов CH3COO– в растворе, 1 л которого содержит 1 моль CH3COOH и 0,1 моля HCl, считая диссоциацию последнего полной.
Дата добавления: 2018-11-24; просмотров: 717; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
