Какой объем занимают 100 моль ртути?
Дано: μ = 0,2кг/моль, ρ = 13600 кг/м3, v = 100 моль. Найти: V
Решение:
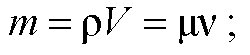
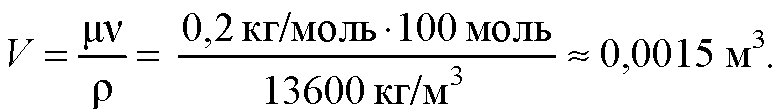
Ответ: V ≈ 0,0015 м3.
Задания для самостоятельного решения
1 Определите массу молекулы воды.
2 В баллоне находится 600 г водорода. Какое количество вещества это составляет?
3 Средняя кинетическая энергия молекул идеального газа увеличилась в 4 раза. Как при этом изменилось давление газа на стенки сосуда?
4 Как отличаются при одинаковой температуре среднеквадратичная скорость молекул кислорода и среднеквадратичная скорость молекул водорода?
5 Сравните массы аргона и азота, находящиеся в сосудах, если сосуды содержат равные количества веществ.
6 В сосуде А находится 14 г молекулярного азота, в сосуде В – 4 г гелия. В каком сосуде находится большее количество вещества?
7 Внутренняя энергия одноатомного идеального газа в закрытом сосуде увеличилась в 4 раза. Как меняется при этом температура газа?
8 Объём 12 моль азота в сосуде при температуре 300К и давлении 105 Па равен V1. Чему равен объём 1 моля азота при таком же давлении газа и вдвое большей температуре?
9 Определите массу воздуха в классной комнате размерами 5х12х3 м при температуре 250 С. Принять плотность воздуха равной 1,29 кг/м3 .
10 Если положить овощи в солёную воду, то через некоторое время они становятся солёными. Какое явление объясняет этот факт?
Литература:
1 Дмитриева В.Ф., Физика для профессий и специальностей технического профиля: учебник для образовательных учреждений начального и среднего профессионального образования,/ В.Ф. Дмитриева – М.: 2014 450с.
|
|
|
2 Дмитриева В.Ф., Физика: учебник для студентов образовательных учреждений среднего профессионального образования,/ В.Ф. Дмитриева – М.: 2012 135с.
3 Дмитриева В.Ф., Физика для профессий и специальностей технического профиля. Сборник задач: учебное пособие для образовательных учреждений начального и среднего профессионального образования – М.: 2014 450с.
4 Дмитриева В.Ф., Физика для профессий и специальностей технического профиля. Сборник задач: учебное пособие для образовательных учреждений начального и среднего профессионального образования – М.: 2013 320с.
Практическое занятие №7
по теме « Основное уравнение МКТ. Уравнение Клапейрона-Менделеева»
Цель: У своить основные законы молекулярно-кинетической теории газов научиться применять их при решении задач.
Теория:
Всякая система может находиться в различных состояниях, отличающихся температурой, давлением, объёмом и т.д.
Величины p, V, T и др. характеризующие состояние системы, называются параметрами состояния.
Если какой-либо из параметров меняется внутри системы от точки к точке, то такое состояние называется неравновесным. Если параметры системы во всех точках одинаковы при неизменных внешних условиях, то такое состояние называется равновесным.
|
|
|
 Всякий процесс, т.е. переход системы из одного состояния в другое связанно с нарушением равновесия системы. Однако бесконечно медленный процесс будет состоять из последовательности равновесных состояний. Такой процесс называется равновесным. При достаточно медленном протекании реальные процессы могут приближаться к равновесному. Равновесный процесс является обратимым, т.е. система переходит из состояния 1 в состояние 2 и обратно 2 - 1, проходя через одни и те же промежуточные состояния.
Всякий процесс, т.е. переход системы из одного состояния в другое связанно с нарушением равновесия системы. Однако бесконечно медленный процесс будет состоять из последовательности равновесных состояний. Такой процесс называется равновесным. При достаточно медленном протекании реальные процессы могут приближаться к равновесному. Равновесный процесс является обратимым, т.е. система переходит из состояния 1 в состояние 2 и обратно 2 - 1, проходя через одни и те же промежуточные состояния.
Процесс, при котором система, пройдя ряд промежуточных состояний, возвращается в исходное состояние, называется круговым процессом или циклом: процесс 1-2-3-4-1 на рисунке.
Связь между параметрами состояния называется уравнением состояния: f(p,V,T)=0
Клапейрон, используя законы Бойля-Мариотта и Шарля вывел уравнение состояния идеального газа.

 1 – 1’: T = const – закон Бойля – Мариотта: p1V1 = p1’ V2;
1 – 1’: T = const – закон Бойля – Мариотта: p1V1 = p1’ V2;
1’ – 2: V = const – закон Шарля: 


т.к. состояния 1и 2 выбраны произвольно, то для данной массы газа величина 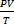 остается постоянной
остается постоянной 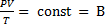 – уравнение Клапейрона
– уравнение Клапейрона
|
|
|
В- газовая постоянная, различая для различных газов.
Менделеев объединил уравнение Клапейрона с законом Авогадро
(  ) Vm- молярный объём
) Vm- молярный объём
 Уравнение Менделеева-Клапейрона
Уравнение Менделеева-Клапейрона
R- универсальная (молярная) газовая постоянная.



p = const;  ;
; 

Физический смысл R: численно равна работе, совершаемой газом при изобарическом (p = const) нагревании одного моля газа (  ) на один Кельвин (∆Т=1 К)
) на один Кельвин (∆Т=1 К)
Введем постоянную Больцмана 
тогда  =
=  ,
, 
 , p=nkT
, p=nkT
p- давление идеального газа при данной температуре прямо пропорционально концентрации его молекул (или плотности газа). При одинаковых p и T все газы содержат в единице объёма одинаковое число молекул.
n - концентрация молекул (число молекул в единице объёма ). Число молекул, содержащихся при нормальных условиях в 1 м3называется числом Лошмидта
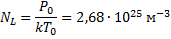 ,
,  - основное уравнение МКТ,
- основное уравнение МКТ,
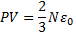
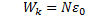

Из уравнения Менделеева - Клапейрона:
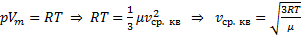

Задача1. Какое количество вещества содержится в газе, если при давлении 200кПа и температуре 240К его объем равен 40л?
Дано: СИ Решение:
Р=200кПа  Воспользуемся уравнением состояния идеального газа,
Воспользуемся уравнением состояния идеального газа,
|
|
|
Т=240К поскольку в задаче идет речь о состоянии газа.
V=40л 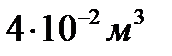
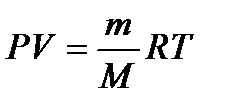 Зная, что количество вещества определяется
Зная, что количество вещества определяется
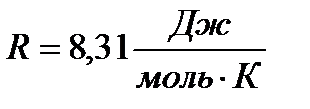
 , подставим в исходную формулу:
, подставим в исходную формулу:
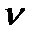 -?
-?  , выразим
, выразим 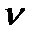 и получим:
и получим: 

Ответ: 4 моль
Задача 2. Газ при давлении 0,2МПа и температуре 150С имеет объем 5л. Чему равен объем этой массы газа при нормальных условиях?
Дано: СИ Решение:
Р=0,2МПа  Для решения воспользуемся уравнением
Для решения воспользуемся уравнением
Клапейрона, поскольку в задаче речь идет
о изменении макропараметров без изменении
массы газа.
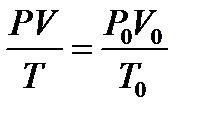
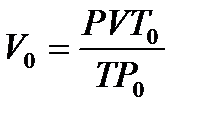
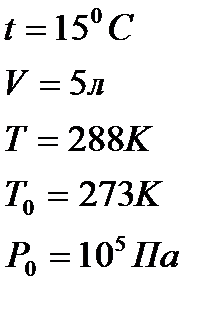 Выразим
Выразим 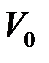 из уравнения Клапейрона:
из уравнения Клапейрона:

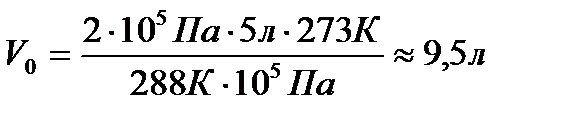
Дата добавления: 2018-11-24; просмотров: 478; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
