Гиперфункция передней доли гипофиза
Избыточная секреция соматотропного гормона (гормон роста). Избыточная секреция этого гормона наблюдается чаще всего при эозинофильной аденоме гипофиза.
Клинически это проявляется развитием акромегалии и гигантизма (рис. 20-10). Акромегалия - заболевание у людей с закончившимся ростом, проявляющееся диспропорциями скелета, мягких тканей (увеличение размеров кистей, стоп, носа, ушей, нижней челюсти) (рис. 20-11), кифосколиозом, спланхномегалией (увеличение размера внутренних органов). Избыточная секреция СТГ в детском возрасте приводит к развитию гигантизма, сопровождающегося увеличением роста более 190 см в сочетании с признаками акромегалии. В 90% случаев развитие акромегалии и гигантизма связано с наличием гормонально-активной эозинофильной адено мы гипофиза. В ряде случаев опухоль не обнаруживается, а развитие гиперплазии гипофиза может быть объяснено, по-видимому, либо избыточной секрецией соматолиберина, либо недостаточной секрецией соматостатина, возникающей в результате повреждения гипоталамуса. Такими повреждениями могут быть травмы (в том числе родовые), инфекции (вирусные инфекции, скарлатина, сыпной тиф, туберкулез, сифилис), нарушения кровообращения. Увеличенное образование СТГ приводит к нарушению обмена белков, углеводов и жиров.
Нарушения белкового обмена. Усиление роста свидетельствует об активации синтеза белков или торможении их разрушения. Действительно, введение СТГ животным вызывает задержку азота в организме, положительный азотистый баланс и понижение распада белков. При этом установлено увеличение включения разных аминокислот в белки тканей и снижение отношения остаточного азота к белковому.
|
|
|
Считается, что действие СТГ опосредовано действием пептидных ростовых факторов - инсулиноподобных факторов роста (ИФР), синтезируемых в тканях и прежде всего в печени. Именно с их действием связывают такие анаболические эффекты, как:
1) стимуляция включения SO4 в протеогликаны;
2) стимуляция включения тимидина в ДНК;
3) стимуляция синтеза РНК;
4) стимуляция синтеза белка СТГ.
Анаболический эффект СТГ обусловливают два момента:
1. Наличие инсулина. На фоне экспериментального диабета у животных и сахарного диабета у людей СТГ обычно не усиливает синтеза белков. Очевидно, это связано с тем, что инсулин активирует обмен углеводов и стимулирует синтез белка.
2. Концентрация глюкокортикоидов. Малые их дозы способствуют реализации анаболического эффекта СТГ, а большие дозы, наоборот, тормозят анаболический эффект СТГ и задерживают рост, что может быть связано с тем, что кортизол в больших дозах угнетает образование ИФР. У больных с эозинофильной аденомой гипофиза часто усилена продукция глюкокортикоидов. Не исключено, что это один из компенсаторных процессов, направленных на ограничение эффекта избыточных количеств СТГ.
|
|
|
Нарушение углеводного обмена. Это нарушение имеет различную степень выраженности. В своей крайней форме проявляется в виде сахарного диабета. Механизм этих нарушений сложен и включает участие следующих факторов:
а) СТГ активирует выход глюкозы из печени за счет активации секреции глюкагона альфа-клетками островков поджелудочной железы, который усиливает гликогенолиз;
б) в поджелудочной железе СТГ стимулирует продукцию инсулина, что усиливает утилизацию глюкозы тканями, однако на уровне клеток тканей СТГ совместно с глюкокортикоидами выступает как антагонист инсулина, т.е. тормозит поглощение глюкозы. Механизм торможения связан с активацией ингибирующей активности β-липопротеиновой фракции сыворотки крови, которая угнетает гексокиназную реакцию, являющуюся пусковой в углеводном обмене;
в) СТГ активирует инсулиназу печени, расщепляющую инсулин. Конечный результат влияния СТГ на углеводный обмен зависит от всех указанных факторов.
|
|
|
Нарушение жирового обмена. СТГ активирует липолиз в жировой ткани, что ведет к увеличению содержания свободных неэстерифицированных жирных кислот в крови, их накоплению в печени и окислению. Усиление окисления выражается, в частности, в увеличении образования кетоновых тел. Этот катаболический эффект осуществляется в присутствии небольших концентраций глюкокортикоидов. Увеличение их количества тормозит мобилизацию жира и его окисление СТГ.
Избыточная секреция адренокортикотропного гормона. Повышенная секреция АКТГ гипофизом приводит к развитию болезни Иценко-Кушинга, которая проявляется двусторонней гиперплазией надпочечников и повышенной секрецией гормонов коры надпочечников. От болезни Иценко-Кушинга следует отличать синдром Иценко-Кушинга, имеющий аналогичную клиническую картину, но обусловленный гормонально-активной аденомой или аденокарциномой коры надпочечников, а также злокачественными опухолями вненадпочечниковой локализации, продуцирующими АКТГ-подобные пептиды (например, бронхогенный рак легких).
В 1924 г. Н.М. Иценко опубликовал наблюдение за больными со следующими признаками: изменение очертаний лица (ожирение его нижней части), перераспределение жира (ожирение туловища при отсутствии ожирения конечностей), мраморность кожных покровов, стрии (багрово-синюшные полосы) на передней стенке живота и бедрах, атрофия мышц конечностей и увеличение живота, повышение артериального давления, остеопороз, нарушение половых функций. Патологоанатомически Н.М. Иценко в ряде случаев определял изменения в гипоталамусе, что и позволило ему связать наблюдаемую клиническую картину с этими изменениями.
|
|
|
В 1932 г. Кушинг описал ту же клиническую картину, связав ее с базофильной аденомой гипофиза. В настоящее время вопрос этиологии болезни Иценко-Кушинга все еще не решен. Было установлено, что данное заболевание возникает на фоне развития стресса, нейроинфекций, травм мозга, абортов, родов, полового созревания и чрезмерной физической нагрузки. По-видимому, действие этих факторов опосредуется через центральные нейромедиаторы (ацетилхолин, серотонин, норадреналин и др.), которые, в свою очередь, регулируют секрецию кортиколиберина в гипоталамусе. В патогенезе болезни Иценко-Кушинга может иметь значение невосприимчивость нейронов мозга к ингибирующим влияниям механизма обратной связи, развивающаяся и закрепляющаяся в результате повреждения гипоталамуса и высших отделов ЦНС. Так или иначе продукция кортиколиберина в гипоталамусе увеличивается, что приводит к гиперплазии базофильных клеток гипофиза, вырабатывающих повышенные количества АКТГ. Если причина, вызвавшая повышение продукции кортиколиберина, сохраняется длительно, то гиперплазия превращается в микроаденому, а затем и в аденому. Повышенный уровень АКТГ при этом заболевании
сочетается с повышением уровня и других продуктов проопиомеланокортина.
Избыточно образующийся АКТГ оказывает свое действие двояко: а) через надпочечники и б) вненадпочечниковым путем.
В надпочечниках АКТГ стимулирует пучковую и (в меньшей степени) сетчатую зону, усиливая образование главным образом кортизола и кортикостерона, выражением чего является гиперкортизолизм.
Избыточная секреция глюкокортикоидов, в свою очередь, приводит к развитию гипергликемии, поскольку она угнетает утилизацию глюкозы на периферии и усиливает глюконеогенез. Следствием этого является повышенная секреция инсулина, чувствительность к которому в тканях снижается. Усиливая образование кортизола, АКТГ тем самым увеличивает катаболизм белка. С повышенным распадом белка связано развитие ряда симптомов заболевания, таких, как остеопороз (деградация белковой матрицы кости), мышечная слабость (атрофия мышц), стрии.
Избыток кортизола приводит помимо этого к задержке натрия и воды, а также синергически с катехоламинами кортизол действует на периферические сосуды, что вызывает их спазм. Все это приводит к развитию артериальной гипертонии. Повышенное выведение калия способствует развитию мышечной слабости. Избыток кортизола может быть в некоторой степени причиной развития гирсутизма (избыточного оволосенения) у больных женщин.
Вненадпочечниковое действие АКТГ на некоторые обменные процессы отличается от его действия на эти же процессы через усиление секреции кортизола. Так, АКТГ способен увеличивать активность тирозиназы в меланоцитах, что приводит к такому нередкому клиническому признаку заболевания, как гиперпигментация. На жировой обмен АКТГ воздействует следующим образом: добавление его непосредственно к жировой ткани стимулирует ее липолитическую активность (распад жира) и тем самым мобилизацию жира с образованием свободных высших неэстерифицированных жирных кислот. Однако усиливая образование кортизола, АКТГ оказывает следующее влияние: а) тормозит мобилизацию жира; б) активирует глюконеогенез и тем самым способствует образованию жира; в) тормозит действие СТГ, активирующее окисление жира. Очевидно, конечный результат зависит от соотношения надпочечникового и вненадпочечникового действия гормона.
Избыточная секреция тиреотропного гормона. Избыточное образование ТТГ стимулирует функцию щитовидной железы, что приводит к усиленному образованию тиреоидных гормонов, развитию так называемого вторичного гипертиреоза и тиреотоксикоза (см. ниже). Кроме того, ТТГ увеличивает содержание кислых мукополисахаридов в коже, мышцах и ретроорбитальной клетчатке как интактных, так и тиреоидэктомированных животных. Причиной данного нарушения могут выступать аденомы из базофильных клеток, секретирующих тиротропин. Они являются редкой формой опухолей передней доли гипофиза. В этом случае к симптоматике гипертиреоза и токсикоза прибавляются и офтальмологические нарушения (изменение полей зрения и глазного дна), возникающие вследствие сдавливания опухолью перекреста зрительного нерва при выходе ее за пределы турецкого седла.
Избыток кортизола приводит помимо этого к задержке натрия и воды, а также синергически с катехоламинами кортизол действует на периферические сосуды, что вызывает их спазм. Все это приводит к развитию артериальной гипертонии. Повышенное выведение калия способствует развитию мышечной слабости. Избыток кортизола может быть в некоторой степени причиной развития гирсутизма (избыточного оволосенения) у больных женщин.
Вненадпочечниковое действие АКТГ на некоторые обменные процессы отличается от его действия на эти же процессы через усиление секреции кортизола. Так, АКТГ способен увеличивать активность тирозиназы в меланоцитах, что приводит к такому нередкому клиническому признаку заболевания, как гиперпигментация. На жировой обмен АКТГ воздействует следующим образом: добавление его непосредственно к жировой ткани стимулирует ее липолитическую активность (распад жира) и тем самым мобилизацию жира с образованием свободных высших неэстерифицированных жирных кислот. Однако усиливая образование кортизола, АКТГ оказывает следующее влияние: а) тормозит мобилизацию жира; б) активирует глюконеогенез и тем самым способствует образованию жира; в) тормозит действие СТГ, активирующее окисление жира. Очевидно, конечный результат зависит от соотношения надпочечникового и вненадпочечникового действия гормона.
Избыточная секреция тиреотропного гормона. Избыточное образование ТТГ стимулирует функцию щитовидной железы, что приводит к усиленному образованию тиреоидных гормонов, развитию так называемого вторичного гипертиреоза и тиреотоксикоза (см. ниже). Кроме того, ТТГ увеличивает содержание кислых мукополисахаридов в коже, мышцах и ретроорбитальной клетчатке как интактных, так и тиреоидэктомированных животных. Причиной данного нарушения могут выступать аденомы из базофильных клеток, секретирующих тиротропин. Они являются редкой формой опухолей передней доли гипофиза. В этом случае к симптоматике гипертиреоза и токсикоза прибавляются и офтальмологические нарушения (изменение полей зрения и глазного дна), возникающие вследствие сдавливания опухолью перекреста зрительного нерва при выходе ее за пределы турецкого седла.
Избыточная секреция гонадотропных гормонов. К их числу относятся: а) ФСГ (фоллитропин); б) ЛГ (лютропин), или ГСИК; в) пролактин, или лактотропный гормон. Их секреция тесно связана с функцией гипоталамуса. В гипоталамусе выделяются соответствующие либерины, которые, спускаясь в гипофиз, стимулируют там образование ФСГ и ЛГ (ГСИК). Образование же пролактина при этом тормозится. Повреждение срединного возвышения, как и гипофизэктомия, ведет к уменьшению секреции ГТГ и к атрофии половых желез. Наоборот, повреждение задних образований гипоталамуса вызывает усиление секреции ГТГ и в детском возрасте приводит к преждевременному половому созреванию. Определенное значение в патогенезе одного из видов преждевременного полового созревания - макрогентосомии придают нарушению функции шишковидной железы, так как считают, что в физиологических условиях она до определенного возраста тормозит секрецию ГТГ, поскольку мелатонин, секретируемый эпифизом, угнетает секрецию гонадотропинов. Преждевременное угнетение функции этой железы (гипопинеализм) растормаживает секрецию ГТГ и приводит к раннему половому созреванию. Согласно другим представлениям, имеют значение опухоли подбугорья вообще, которые каким-то образом стимулируют секрецию ГТГ гипофизом. Секреция ГТГ увеличивается и при первичном выпадении инкреторной активности половых желез, однако это не ведет к повышению продукции половых гормонов.
Избыточное образование пролактина отмечено у больных синдромом лактореи - аменореи, возникающим в связи с первичным повреждением гипоталамуса. При этом нередко находят опухоль гипоталамуса или хромофобную аденому гипофиза.
201. Патология надпочечниковых желез. Виды нарушения, проявления. Острая и хроническая недостаточности. Моделирование. Этиология, патогенез, роль иммунных факторов. Механизмы нарушения обмена веществ и физиологических функций.
Надпочечники - важнейший участник экстренной адаптации метаболизма и физиологических функций к условиям нагрузки и к гипоксии
Основное описание патологии приводится в сравнении со стрессом,.
Удаление надпочечников смертельно, однако, при введении минералокортикоидов адреналэктомированным животным они избегают острой гибели и живут в условиях глубоких метаболических нарушений. Виды нарушений включают нарушения образования и работы собственно продуктов синтеза надпочечников, как то гиперальдостеронизм и гипоальдостеронизм при нарушении образования минералокортикоидов; гиперкортицизм и гипокортицизм при нарушении образования глюкокортикоидов и андрогенитальные синдромы при нарушении секреции половых гормонов. И известны нарушения баланса образования катехоламинов мозгового вещества.
Все патологии надпочечников также можно разделить на состояния, характеризующиеся гиперадренализмом и гипоадренализмом. Оба могут быть тотальными, т.е. изменение выработки во всех участках надпочечников, так и парциальными, сводящимися к избирательной недостаточности. Тотальный гиперадренализм фактически представляет собой гиперкортицизм. Тотальный гипоадренализм известен и в форме гипокортицизма, и в форме пониженной функции мозгового и коркового вещества (апоплексия надпочечников=синдром Уотерхауса-Фредериксена). Проявления данных нарушений соотносятся с изменениями количественной продукций гормонов, что рассмотрено для каждого отдельного состояния в последующих билетах.
Недостаточности.
Моделирование. Острую надпочечниковую недостаточность мы моделировали в эксперименте "Течение кислородного голодания у мышей с искусственно измененной антигипоксической резистентностью". 5 мышей, первая - контрольная. Вторая - за сутки до эксперимента получившая дексаметазон (0,5мг внутрибрюшинно), третья - голодающая (голодание с водой в течение суток), четвертая - за час и за 10 минут до эксперимента получившая внутрибрюшинно 0,5мл 10% глюкозы, пятая - за 15 минут до опыта плававшая в течение 5 минут. Затем мышек сажают под колпак и подвергают острой гипобарии. Голодание уменьшает устойчивость к стрессу, как и введение дексаметазона, обеспечение специфического субстрата (глюкозы) и активация процессов, обеспечивающих образование специфического субстрата (стресс) увеличивают стойкость организма. Дексаметазон по принципу обратной связи угнетает образование АКТГ, в результате чего надпочечники не выделяют глюкокортикоиды.
Моделирование болезни Аддисона, хронической надпочечниковой недостаточности, можно осуществить введением соответствующей специфической цитотоксической антисыворотки, в результате чего моделируется аутоиммунный адреналит.
Также моделировать острую надпочечниковую недостаточность можно воссоздавая апоплексию надпочечников, т.е. прекращая кровоток к ним, перевязывая сосуды. При этом проявления близки к тяжелому аддисоническому кризу (см ниже), возникает гипогликемия, гипотензия.
Тотальный гипокортицизм может быть первичным, собственно разрушением ткани надпочечников, или вторичным, вызванным нарушением регуляции выработки регуляторных гормонов. Хроническая первичная недостаточность надпочечников - болезнь Аддисона, или бронзовая болезнь. Чаще всего её причиной является аутоаллергия. Наиболее часто мишенью аутоиммунитета служат стероидные ферменты, в первую очередь 21-стероидгидроксилазе (60% больных). Антитела нарушают переход прогестерона в дезоксикортикостерон, а также служат эффекторами цитотоксического процесса, разрушающего адренокортикоциты. Обнаруживается аутоиммунный адреналит - иммунопатологическое воспаление. Наблюдается деструкция, фиброз, лимфоцитарная инфильтрация коры. Также возможно развитие гипергонадотропного гипогонадизма, т.к. возможно появление других актител, тропных к стероидпродуцирующим клеткам гонад.
Часто болезнь Аддисона комбинирована с другими аутоиммунными синдромами, наиболее известен синдром Шмидта, сочетание аддисоновой болезни, аутоиммунного тиреоидита, инсулиннезависимого сахарного диабета. Часто болезнь Аддисона сочетается с наличием аутоантител к клеткам слизистой желудка, в результате чего возникает атрофический гастрит и анемия Аддисона-Бирмера (аутоиммунная мегалобластическая пернициозная анемия).
Вторая по значимости причина болезни Аддисона - инфекционные адреналиты, в первую очередь туберкулез.
Также гипокортицизм могут вызвать различные лекарственные препараты, блокирующие ферменты стероидогенеза, например кетоконазол. И наследственные заболевания, например врожденная гиперплазия коры надпочечников, вызванная ферментативными дефектами стероидогенеза.
Патогенез аддисоновой болезни связан с дефицитом различных кортикостероидов. Длительно, до тех пор пока не разрушится 90% ткани, очевидных симптомов не наблюдается. Затем возникают симптомы гипоальдостеронизма (потери натрия, хлоридов, обезвоживание, гиперкалиемия), а также гипогликемия, слабость, анорексия. Компенсаторно повышается АКТГ, его предшественних прополигормон ПОМК, в результате развивается гиперпигментация кожи, слизистых, усиленная пигментация в области складок, участках действия солнечных лучей. Темнеют соски, локти, колени, ногтевые ложа. Наблюдается стойкое понижение уровня глюкозы натощак, уменьшение содержание гликогена в печени и мышцах. Гипогликемия может вызвать кому и быть причиной смерти. Недостаток глюкокортикоидов определяет гипопротеинемию, снижение синтеза печёночных протеинов, уменьшается мышечная масса. Характерна эозинофилия и лимфоцитоз, так как срок жизни этих клеток увеличивается.
Нарушается липидный обмен, так как в условиях гипогликемии и изменения инсулин-глюкагонового соотношения в пользу глюкогона усиливается липолиз, одновременно у больных понижен аппетит.
При болезни Аддисона больные соль-зависимые, при исключении её из пищи наступает смерть. Имеется гиповолемия, при водной нагрузке усугубляется гипонатриемия, плюс имеется гипервазопрессинемия, из-за чего легко развивается гипергидратация и "водное отравление". Имеется выраженная гиперкальциемия. Инфузии глюкозы могут провоцировать данные изменения! Глюкоза захватывается клетками, освобождается вода, дополнительно разводится гипонатриемичная плазма, клетки гипоталамуса набухают, их раздражение, активация термостатического центра, лихорадка, коллапс, смерть.
Наблюдается умеренный ацидоз, повышенный уровень бикарбонатов. Гипотензия, частые ортостатические коллапсы, аритмии из-за гиперкалиемии. Гипорегенераторная анемия из-за недостаточной стимуляции эритропоэза.
Эоционально больной становится раздражительным, неспособным к длительной концентрации, апатия.
В развитии вторичного гипокортицизма сменяются 3 стадии. 1 стадия - продукция и уровень кортизола нормальны, но ответ на стресс резко снижен, так как мала центральная стимуляция кортикостероидогенеза. На второй секреция АКТГ и КРФ угнета.ются, снижается базальный уровень кортизола. На третьей наблюдается вторичная атрофия коры надпочечников. При вторичном не наблюдается гиперпигментации, а может быть даже наоборот белый аддисонизм, основные проявления связаны с гипоглюкоркортикоидными проявлениями, а не с гипоальдостероновыми или гипоандрогенизмом.
Пик проявлений гипокортицизма - острый аддисонический криз. Вызван резким несоответствием между потребностью кортикостероидов и их поставкой, провоцируется стрессорами. Может быть дебютом проявления, т.к. у аддисоновой болезни длительная латентная стадия. Характеризуется быстрым развитием глубоких гипонатриемий, внеклеточного обезвоживания, гиповолемии, гиперкалиемии, гиперкальциемии, на фоне прогрессирующей гипогликемии. Клетки мозга и других органов набухают, возникают симптомы водного отравления. Проявляется лихорадкой, болями в мышцах и суставах, растяжением органов брюшной полости с признаками "острого живота", прострацией, тошнотой, рвотой, аритмией, гипотензией, комой. Картина комы схожа с проявлениями комы кетоацидотической, что может привести к смертельной попытке лечения инсулином.
Первично острое течение надпочечниковой недостаточности при септическом синдроме Уотерхауза-Фредериксена, апоплексии гипофиза, кровоизлиянии в надпочечники дает аналогичную картину, но без предвестников. Синдром Уотерхауза-Фредериксена возникает при апоплексии надпочечников, чаще всего из-за ДВС-тромбообразования. Большое значение играют генерализованные инфекции, бактериемии и вирусемии, наиболее часто менингококковый сепсис.
Возможны комбинированные проявления парциального гипо и гиперкортицизма, см 554 страницу "Основы патохимии"
Билет №202.
Гиперфункция коркового вещества надпочечников. Парциальные и тотальные формы гиперкортицизма. Этиология, патогенез, механизм нарушений обмена веществ и физиологических функций. Роль аутоиммунных факторов.
Гиперкортикостероидизм (гиперкортицизм) - такие изменения в организме, которые соответствуют усилению функции коры надпочечников.
Наиболее часто встречаются следующие виды гиперкортикостероидизма: гиперкортизолизм, альдостеронизм и адреногенитальные синдромы.
Гиперкортицизм
Тотальный Парциальный
Нарушение работы всех Нарушение работы
зон коры определенной зоны коры
1. Гиперкортизолизм
Это комплекс таких изменений в организме, которые вызываются:
* избыточным образованием кортизола в пучковой зоне коры надпочечников (при опухоли пучковой зоны одного из надпочечников, называемой глюкостеромой) – первичный гиперкортизолизм.
*повышением активности кортизола за счет уменьшения связывания его транскортином
* нарушением центральных механизмов регуляции гипоталамогипофизарно-надпочечниковой системы:
- опухоль передней доли гипофиза (базофильная аденома) – вторичный гиперкортизолизм
- усиливается образование кортиколиберина и, следовательно, секреция АКТГ – третичный кортизолизм
* избыточной продукцией адренокортикальных стимуляторов вне гипоталамо- гипофизарного аппарата (синдром эктопической продукции АКТГ)
* экзогенным введением кортикостероидов (ятрогенный гиперкортицизм)
Хронический гиперкортизолизм
· Синдром Иценко-Кушинга
хронический первичный или вторичный гиперкортицизм (гиперкортизолизм, не связанный с адренокортикотропиномой гипофиза)
Этиология:
- Кортикостерома
первичный гиперкортицизм
- Избыточная продукция стимуляторов коры надпочечников в гипоталамо-гипофизарном нейросекреторном аппарате
вторичный гиперкортицизм
- Избыточная продукция адренокортикальных стимуляторов вне гипоталамо-гипофизарного аппарата
синдром эктопической продукции АКТГ
Для синдрома Иценко-Кушинга типична триада:
гипертензия - гипернатриемия - гипергликемия.
· Болезнь Иценко-Кушинга
Хронический вторичный гиперкортицизм, вызванный адренокортикотропиномой (АКТГ-продуцирующей аденомой гипофиза)
Нарушение обмена при гиперкортизолизме
Углеводный обмен
Гиперкортизолизм - гипергликемия:
· усиление глюконеогенеза из глюкогенных аминокислот
· торможение перехода глюкозы в жир
· торможение декарбоксилирования пирувата - увеличение способности пирувата ресинтезироваться в глюкозу
· повышение активности глюкозо-6-фосфатазы в печени - переход глюкозы в кровь
Одновременно в связи с усиленным образованием глюкозы увеличивается образование в печени гликогена.
Гипергликемия - усиление образования инсулина островковым аппаратом поджелудочной железы (в случаях функциональной неполноценности инсулярного аппарата его гиперфункция сменяется истощением и развитием сахарного диабета (так называемый стероидный диабет)).
Белковый обмен
Усиливается катаболизм белков и тормозится их синтез преимущественно в мышцах и мезенхимальных элементах, что выражается в повышении выделения азота с мочой.
В костной ткани в связи с нарушением образования белкового каркаса тормозится отложение солей кальция и развивается остеопороз.
Жировой обмен
Избыточное отложение жира вызвано:
· гипергликемия - активация синтеза триацилглицеролов, увеличение образования инсулина в поджелудочной железе - усиление липогенеза
· увеличение количества гликогена в печени - торможение действия СТГ (активирует окисление жира) - уменьшение окисления жирных
Водно-солевой обмен
Кортизол и кортикостерон обладают некоторыми минералокортикоидными свойствами.
Гиперкортизолизм ведет к:
· усиление реабсорбции ионов натрия в канальцах почек - задержк этих ионов в организме - некоторое увеличение их концентрации в экстрацеллюлярной жидкости.
· уменьшение реабсорбции ионов калия в почках - некоторая потеря калия в организме.
В результате:
· повышается содержание воды в экстрацеллюлярном депо - увеличивается объем крови.
· нарушается обмен кальция:
- тормозится его всасывание в кишечнике
- усиливается экскреция с мочой
Это ведет к вторичному гиперпаратироидизму – активация перехода стволовых клеток кости в остеокласты, торможение перехода в остеобласты - резорбция костной ткани - остеопороз
Сердечно-сосудистая система
Гиперкортизолизм приводит к повышению кровяного давления в результате:
· увеличения объема крови
· повышения чувствительности сосудистой стенки к адреналину и норадреналину:
- увеличение содержания натрия в сосудистой стенке
- пермиссивная активность глюкокортикоидов
· усиления процесса возбуждения в ЦНС:
повышение концентрации аммиака в головном мозге - усиление тонуса сосудодвигательного центра.
Другие проявления
· Слабость, повышенная утомляемость
· Повышение аппетита
· Ожирение с преимущественным отложением жира на лице («лунообразное лицо» с ярким румянцем на щеках), в области шеи («загривок буйвола») и затылка, над ключицами, в области спины и живота.
· На коже живота, груди, бёдер и плеч появляются полосы растяжения (стрии) багрового или фиолетового цвета и гипертрихоз.
· Повышение диуреза:
повышение кровяного давления - увеличение фильтрации в клубочках почек, торможение реабсорбции воды (блокада действия АДГ)
· Лейкоцитоз, эритроцитоз
Активация развития эритроцитов и нейтрофилов
· Лимфопения, эозинопения
Торможение развития лимфоцитов и эозинофилов, активация процессов, ведущих к их апоптозу
2. Альдостеронизм (более подробно – билет 203)
Первичный альдостеронизм (синдром Конна)
Этиология:
гормонально-активная аденома клубочковой зоны (альдостерома), которая секретирует избыточное количество альдостерона.
Патогенез:
- усиление реабсорбции натрия в канальцах почек - натрий задерживается в организме - увеличение концентрации натрия в экстрацеллюлярных депо.
- конкурентное торможение реабсорбции калия - значительная потеря калия из клеток организма - компенсация потери калия вхождением в клетки ионов натрия и водорода.
Проявления альдостеронизма:
* повышение кровяного давления:
- повышение тонуса артериол (увеличение концентрации ионов натрия в клетках, что усиливает реакцию клеток на симпатические импульсы и потенцирует действие норадреналина)
- гиперволемия
* развитие мышечной слабости и временных параличей в связи с потерей калия
* полиурия:
снижение концентрации калия в клетках - уменьшение реакции канальцевого эпителия почек на АДГ.
Возможно, полиурия является одной из причин того, что при первичном альдостеронизме, несмотря на задержку натрия, не бывает отеков в отличие от вторичного альдостеронизма.
* гипокалиемический алкалоз
некомпенсированный алкалоз - развитие тетании
* потеря ионов хлора (вместе с ионами калия)
- компенсаторное увеличение в экстрацеллюлярном депо бикарбонатов (связывание избытка натрия)
Вторичный альдостеронизм
Развивается на фоне первичных процессов, протекающих вне надпочечников:
недостаточность правого сердца, циррозы печени, злокачественная гипертония и др.
3. Андрогенитальные синдромы
Изменения в организме, которые развиваются при избыточной секреции андрогенов или эстрогенов сетчатой зоной коры надпочечников. Характер изменения зависит в значительной степени от пола, возраста больного и вида секретируемых гормонов.
Синдромы:
1) гетеросексуальный
избыточное образование у данного пола половых гормонов противоположного пола
2) изосексуальный
раннее или избыточное образование половых гормонов, присущих данному полу.
Избыточное образование андрогенных стероидов:
андростендион и адреностерон - слабые андрогены, способные в периферических тканях превращаться в тестостерон.
Этиология: опухоль сетчатой зоны коры надпочечников (андростерома) или ее гиперплазией.
По механизму обратной связи они тормозят синтез гонадотропных гормонов, что приводит к атрофии половых желез.
Женщины:
Действие андрогенов:
· атрофия женских первичных и вторичных половых признаков
· развитие мужских вторичных половых признаков:
- вирилизм/ маскулинизация
Вирильные синдромы:
1) Врожденный
Действие андрогенов реализуется уже на этапе внутриутробного развития и при рождении проявляется формированием урогенитального синуса и гипертрофией клитора (ложный женский гермафродитизм).
Период полового созревания начинается рано (в 6-7 лет) и протекает по гетеросексуальному типу (мужское телосложение, увеличение мышечной массы в результате анаболического действия гормонов, отсутствие молочных желез, аменорея, акне, низкий тембр голоса).
2) Постпубертатный
- олиго/аменорея
- нередко бесплодие
- атрофия молочных желез, уменьшением размеров матки и яичников
- гирсутизм:
избыточный рост терминальных (или стержневых) волос в андрогензависимых зонах (над верхней губой, на подбородке, щеках, верхней части груди, спины, живота) по мужскому типу.
Мужчины
Избыток андрогенов не сопровождается клиническими проявлениями, поскольку основной андрогенный эффект во взрослом мужском организме оказывает вырабатываемый яичками тестостерон.
У мальчиков чрезмерная секреция андрогенов надпочечниками (изосексуальный тип адреногенитального синдрома) проявляется ускоренным ростом, преждевременным появлением вторичных половых признаков, полового влечения, эрекции, увеличением размеров полового члена и мошонки.
Избыточное образование эстрогенов: эстрогены
Женщины
У девочек это вызывает преждевременное половое и физическое развитие.
Мужчины
Развивается феминизация, в процессе которой исчезают мужскиевторичные половые признаки и появляются женские.
Отмечаются изменения телосложения, голоса, отложения жировой ткани по женскому типу.
Билет №203
Гипер и гипопродукция минералкортикоидов. Этиология и патогенез нарушений обмена веществ и физиологических функций. Гипоальдостеронизм. Гиперальдостеронизм. Патофизиология системы ренин-ангиотензин-альдостерон.
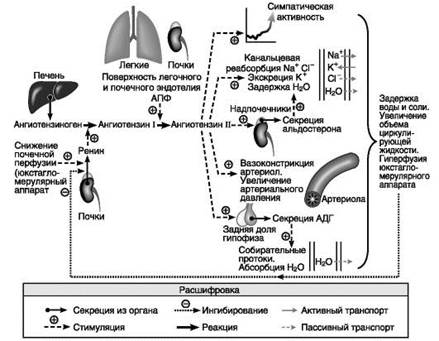
Минералокортикоиды – в основном альдостерон и дезоксикортикостерон - регуляторы калий-натриевого гомеостаза и объема внеклеточной жидкости.
Регуляторы секреции
1. Ангиотензин II
компонент системы ренин- ангиотензины - главный регулятор синтеза и секреции а.;
этот пептид стимулирует выброс а.,
Действие гипо- и гипернатриемии осуществляется через систему ренин- ангиотензины – АДГ
2. Атриопептин
ингибирует синтез
3. Гиперкалиемия
стимулирует секрецию
4. Гипокалие-мия
тормозит секрецию минералокортикоидов
5. ПГБ1а и ПГБ2а
тормозят секрецию минералокортикоидов
6. Травмы и стрессовые состояния
увеличивают секрецию
Функция минералокортикоидов
Поддерживают баланс электролитов в жидкостях организма:
влияют на реабсорбцию ионов в почечных канальцах:
- увеличивают реабсорбцию Na+ (задержка натрия приводит к увеличению содержания воды в организме и повышению АД) и экскрецию К+ (потеря калия вызывает гипокалиемию);
- увеличивает реабсорбцию Cl-, бикарбоната и почечную экскрецию Н+.
Рецептор альдостерона - внутриклеточный полипептид с Mr 107 кД, связывает а. (также глюкокортикоиды) и активирует транскрипцию генов.
Минералокортикоиды выраженно действуют также на желудочно-кишечный тракт, на потовые и слюнные железы.
Гиперальдостеронизм
1. Первичный гиперальдостеронизм (первичный альдостеронизм, альдостерома, синдром Кона)
– заболевание вследствие гиперсекреции альдостерона при аденоме или гиперплазии коры надпочечника.
При всех формах первичного альдостеронизма и при псевдоальдостеронизме имеет место низкая активность ренина.
Этиология:
· Солитарная аденома – альдостерома
Исходит их клубочковой зоны, могут быть в яичнике, кишечнике, щитовидной железе.
Минералокортикоиды не ингибируют продукцию АКТГ – нет атрофии остальной коры надпочечников.
· Глюкокортикоид-подавляемые минералокортикоид-продуцирующие аденомы
Гибридный химерический онкобелок CYPIIB1-CYPIIB2 сохраняет активность ключевого фермента биосинтеза альдостерона, но приобретает сильную зависимость от cтимуляции АКТГ.
Снижение синтеза минералокортикоидов при большими дозами глюкокортикоидов.
Патогенез
Гиперсекреция альдостерона:
1. Усиление реабсорбции натрия в канальцах почек - натрий задерживается в организме (его концентрация в экстрацеллюлярных депо в большинстве случаев увеличивается) – задержка воды в организме – повышение АД - уменьшение в плазме крови концентрации ренина и ангиотензина-II
2. Конкурентно тормозится реабсорбция калия - значительная потеря калия из клеток организма
* компенсация потерь за счет вхождения в клетки ионов натрия и водорода
- усиление реакции клеток на симпатические импульсы, потенциация действия норадреналина - повышение тонуса артериол – повышение АД
* снижается сократимость мышц - развитие мышечной слабости и временных параличей
* уменьшает реакцию канальцевого эпителия почек на АДГ - полиурия
Возможно, полиурия является одной из причин того, что при первичном альдостеронизме, несмотря на задержку натрия, не бывает отеков в отличие от вторичного альдостеронизма. Определенную роль играет и отсутствие застоя в венозной системе;
* гипокалиемический алкалоз
* потеря ионов хлора (вместе с ионами калия) - снижение их уровня в крови - компенсаторное увеличение в экстрацеллюлярном депо бикарбонатов (связывание избытка натрия)
Алкалоз может стать некомпенсированным и привести к развитию тетании.
Также могут быть:
- головная боль
- жажда
- быстрая утомляемость
2. Вторичный гиперальдостеронизм,
Встречается чаще
Протекает с высоким уровнем ренина (ренинизм) и активной ренин-ангиотензиновой стимуляцией минералокортикоидного стероидогенеза.
Этиология:
· Ишемия почек вследствие атеросклероза и артериосклероза бассейна почечных артерий
- хронические гипертензии
- диабетический гломерулосклероз (синдром Киммельстиля-Уилсона)
· Снижение объёма внутрисосудистой жидкости
- застойная сердечная недостаточность
- нефротический синдром
- хроническая печёночная недостаточность
- голодание, другие гипопротеинемические состояния
- передозировка мочегонных и слабительных
· Гипонатриемия и усиленные потеринатрия
- хроническая почечная недостаточность
- почечный канальцевый ацидоз
· Первичная гиперплазия юкста-гломерулярного аппарата
- синдром Бартера
- избыток простагландина Е2
· Рениномы
– опухоли, секретирующие ренин автономно (юкстагломерулярной и, редко – овариальной локализации).
· Беременность
эстрогены стимулируют продукцию ангиотензиногена и ренина, а прогестины снижают эффективность действия альдостерона («физиологический вторичный гиперальдостеронизм»).
При вторичном гиперальдостеронизме из-за гиперактивности РАС невозможен прессорный натрийурез, поэтому имеются гипернатриемия, гипокалиемия, системные отеки.
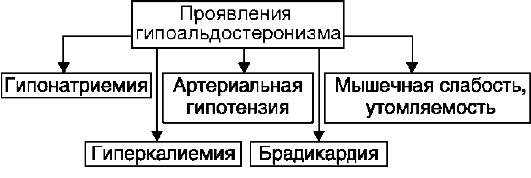
Гипоальдостеронизм
- патологическое состояние вследствие недостаточной продукции альдостерона.
- Первичный гипоальдостеронизм
Этиология: - У грудных детей
недостаточность двух ферментных систем: 18-оксидазы и 18-гидроксилазы. - Потеря натрия, артериальная гипотензия
повышение продукции ренина (гиперренинемический г.).
- Вторичный гипоальдостеронизм
Этиология:
· Недостаточная продукция ренина почками или снижение его активности
у взрослых, (гипоренинемический г.).
· Часто осложняет течение СД и хронического нефрита с почечно-канальцевым ацидозом с поражением сосудов почек.
· Дефицит инсулина
влияет на уменьшение синтеза альдостерона.
· Снижение адренергической активности и
ПГЕ1 и ПГЕ2, стимулирующих активность ренина
обусловливает уменьшение активности ренина.
· Длительный прием некоторых ЛС (гепарин натрия, индометацин и другие НПВС, р-адреноблокаторы и ингибиторы АПФ).
· После удаления альдостеромы одного из надпочечников в результате
трофии клубочковой зоны другого.
В обоих случаях недостаточность альдостерона приводит к снижению реабсорбции натрия и воды в почечных канальцах и повышению реабсорбции калия и хлора с развитием артериальной гипотензии и метаболического ацидоза.
Псевдогипоальдостеронизм
Этиология:
- Генетика:
- Псевдогипоальдостеронизм типа I (*264350, мутации генов MLR, MCR, 4q31.1, р или 9?).
- Псевдогипоальдостеронизм типа II (*145260, 9{).
наследуемая гиперкалиемия в сочетании с артериальной гипертензией, гиперхлоремическим ацидозом и гипоренинемией. - На фоне других заболеваний
- серповидно-клеточная нефропатия,
- СКВ,
- амилоидоз
- интерстициальное поражение почек
- обструктивная нефропатия
- применение триамтерена или спиронолактона.
Нарушение функций мозгового слоя надпочечников. Этиология, патогенез, формы. Особенности этиологии, патогенеза и видов хромаффином, острой и хронической симпато-адреналовой недостаточности. Синдром Уотерхауза-Фредериксена. Отрицательные эмоции, их связь с нейроэндокринной системой и последствия увеличенного выделения адреналина и норадреналина. Понятие о пермиссивном действии глюкокортикоидов на эффект катехоламинов.
► Острая недостаточность надпочечников – это угрожающее жизни состояние в результате быстро наступающих снижения или полного прекращения всех функций коркового и мозгового вещества надпочечников. Синонимы: острая адреналовая недостаточность, острый гипокортицизм, острый гипоадренализм, гипоадреналовый криз, аддисоновый криз, молниеносная пурпура (purpura fulminans), синдром Уотерхауза-Фридериксена.
► Распространенность. Острая недостаточность надпочечников может возникать в любом возрасте, но чаще – у детей и у рожениц.
► Сопровождается острой гипогликемией, гипотензией и гипонатриемией, обезвоживанием.
► Развивается при острой септицемии, обычно менингококкового происхождения.
► Патогенез: связан с аллергоидной реакцией по типу феномена Санарелли-Шварцмана* и гиперэкспрессией молекул клеточной адгезии на эндотелии сосудов.
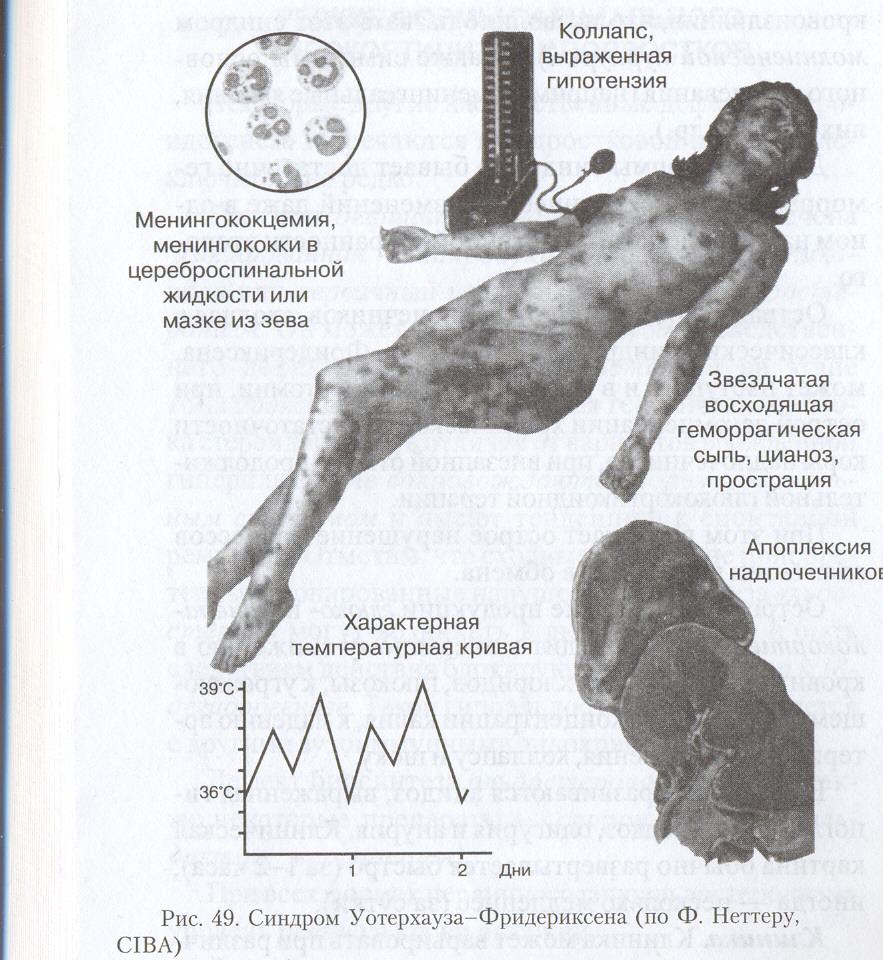
► Хроническая недостаточность коры надпочечников – заболевание, обусловленное сниженной продукцией и/или недостаточной эффективностью действия гормонов коры надпочечников. Синонимы: болезнь Аддисона, синдром Аддисона, бронзовая болезнь, аутоиммунная болезнь Аддисона, хронический гипокортицизм, хроническая меланодермическая недостаточность надпочечников, хроническая надпочечниковая недостаточность.
► Распространенность. Заболевание чаще возникает у молодых, без четких половых различий в пораженности, с частотой от 0,03 до 0,1 на 10 тыс. населения. Смертность достигает 4 на 100 тыс. населения. В явной форме болезнь наблюдается со среднепопуляционной частотой - приблизительно 50 случаев на 1 млн населения.
► Этиология болезни Аддисона до 80 % случаев является аутоаллергической. Деструкция коры надпочечников наступает в результате избыточно интенсивного аутоиммунного процесса, направленного против антигенов адренокортикоцитов или общих аутоантигенов коры надпочечников и гонад (антигены стероидопродуцирующих клеток).
► Наиболее часто мишенью аутоиммунитета при болезни Аддисона служат стероидогенные ферменты. В первую очередь характерны аутоантитела к 21β-стероидгидроксилазе (они присутствуют почти у 60 % больных). Нередко, особенно при раннем начале болезни, обнаруживаются аутоантитела к 17-a-гидроксилазе. Так как данный фермент присутствует в изобилии также в гонадах, у больных регистрируются взаимодействия иммуноглобулинов с цитоплазмой стероидпродуцирующих клеток гонад и надпочечников, почему, в дополнение к клинике болезни Аддисона, может возникать гипергонадотропный гипогонадизм
► Как причина болезни Аддисона описаны аутоантитела и к рецепторам АКТГ. В этих случаях иммуноглобулины взаимодействуют не столько с цитоплазмой, сколько с плазматическими мембранами клеток коры надпочечников. Отмечаются прекращение пролиферации и атрофия клеток коры надпочечников, но без признаков адреналита.
► Её проявления чаще всего входят в структуру комбинированных аутоиммунных синдромов, поражающих и другие эндокринные железы, а также неэндокринные клетки.
► Наиболее известен синдром Шмидта (сочетание аддисоновой болезни, аутоиммунного тироидита, инсулинозависимого сахарного диабета).
► Вторая по значению и первая, по описанию самим Томасом Аддисоном, причина болезни – инфекционные адреналиты, в первую очередь – в результате туберкулёза надпочечников. Эта причина ответственна примерно за 20 % случаев болезни.
Дата добавления: 2016-01-04; просмотров: 27; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
