Экспериментальные модели сахарного диабета
Панкреатэктомическая: фон Меринг и Минковский. Тотальное удаление панкреас у собак -> ИЗСД с истощением, кетоацидозом и гибелью. Минковский и Хидон: пересадка кусочка панкреас под кожу панкреатэктомированной собаки предохраняет от СД. Форшбах: СД после панкреатэктомии может быть купирован при парабиотической связи кровеносной системы подопытной и интактной собак. Диффузное распределение панкреатической ткани по брыжейке у крыс долго не позволяло удалить железу целиком, но Скау тотально удалил и получил у крысы типичный СД.
Соболев: модель СД на собаках, методика аутолиза экзокринной части панкреатической железы при сохранении островков Лангерганса путём перевязки выводного протока железы. Разрушение ацинозных элементов железы не приводило к СД.
Аллен на собаках с резекцией 90 % панкреас: поражение и гибель оставшихся В-клеток могут быть вызваны перекармливанием углеводами.
Усай: панкреатэктомия и СД у южноамериканских жаб и у млекопитающих; проявления СД значительно ослабевают, вплоть до полного исчезновения, при удалении аденогипофиза и надпочечников. Предварительная гипофизэктомия делает животных более резистентными к диабетогенному эффекту резекции панкреас -> факт продукции контринсулярных гормонов в аденогипофизе и надпочечниках.
Субтотальная резекция поджелудочной железы ведет к латентному СД, который переходит в явный при нагрузке контринсулярными гормонами (тироидные, соматотропин, глюкокортикоиды) или при перекармливании углеводами. Ивенс, Хэм и Хейст: стойкий СД у собак путём хронического введения экстрактов аденогипофиза.
|
|
|
Химические модели СД. Данн и Мак Летчи: аллоксан (уреид мезоксалевой кислоты) избирательно повреждает островковые В-клетки, вызывая их некроз -> СД у крыс, мышей, кроликов и собак. Так как аллоксан может возникать в организме из мочевой кислоты через диалуровую, а также в связи с частым клиническим сочетанием СД и гиперурикемии, Лазарис модифицировал аллоксановую модель, вызвав СД у крыс токсическими дозами мочевой кислоты (600-680 мг/кг массы тела), на фоне дефицита пищевых серосодержащих АК.
Маске: дитизон (дифенилтиокарбазон) и оксином (8-оксихинолин). Это «цинковые модели», действующие вещества образуют комплексы с Zn в секреторных гранулах В-клеток, нарушая накопление инсулина и его секрецию. СД по данной модели возникает лишь у кроликов, В-клетки которых богаты Zn.
Стрептозотоцин — антибиотик, избирательно повреждает В-клетки у крыс. У других животных диабетогенные и летальные дозы очень близки.
«Химические» модели на деле химико-иммунологические, так как аллоксан, мочевая кислота и стрептозотоцин запускают против В-клеток аутоиммунный процесс. Данные модели не воспроизводятся у тимэктомированных иммунодефицитных животных. Развитие химического экспериментального СД тормозится антилимфоцитарной сывороткой и иммунодепрессантами. СД подвергается адоптивному переносу. «Цинковые» модели иммунонезависимы.
|
|
|
Вирусная модель ИЗСД. Заражение мышей М-вариантом вируса мышиного энцефаломиокардита -> в 40% случаев аутоиммунный инсулит -> ИЗСД. Блокируется тимэктомией и иммунодепрессией.
Генетические модели: чистые линии китайских хомячков, мышей ККА, мышей ОВ/ОВ и DB/DB, мышей АВ/ АВ, колючих мышей, новозеландских мышей, песчаных крыс, крыс ВВ (BioBreeding), мышей NOD (Non Obese Diabetic), крыс WBH/Kobe.
У мышей NOD генетическая аномалия экспрессии АГ ГКГС класса -> облегчение провокации аутоаллергии против В-клеток, ИЗСД. Избыток Т-эффекторов, действующих против островковых АГ, дефицит супрессорных функций лимфоцитов.
Крысы ВВ: наследственная лимфопения и дефицит цитотоксических лимфоцитов. Спонтанный аутоиммунный инсулит; он, как в случае мышей NOD, приостанавливается неонатальной тимэктомией или применением иммунодепрессантов, а в естественных условиях ведет к неизбежному ИЗСД.
|
|
|
Крысы WBH/Кобе самопроизвольно вырабатывают в ↑титрах аутоАТ к инсулину->ИЗСД.
Мыши КО дефектны по гену адипонектина -> ИНСД с инсулинорезистентностью.
У мышей ОВ и DB развивается ожирение, инсулинорезистентность и ИНСД. Модели первичного ожирения, наследственный дефект гена лептина (ОВ) или лептинового рецептора (DB).
Стресс и общий адаптационный синдром. Гормональные изменения при стрессе. Экспериментальное моделирование. Стадии, эндокринно-метаболические изменения. Механизмы неспецифического повышения резистентности при стрессе. Дистресс. Патогенная роль хронического стресса. Болезни нарушений адаптации.
Стресс – экстренная адаптационная программа, включаемая как универсальный ответ, призванная уменьшить иск гибели при чрезвычайной ситуации. Как нейроэндокринный процесс описан Г. Селье в 1936. Стресс повышает резистентность к широкому кругу патогенных воздействий прежде всего за счет увеличения антигипоксической резистентности клеток.
Стадии: в начале стресса всегда наступает «стадия тревоги» - выработка гипоталамических сигналов, запускающих стресс (кортиколиберин, вазопрессин, симпатический нервный сигнал). Начинается продукция аденогипофизарных гормонов (ПОМК и его производные, включая АКТГ). В эту стадию адаптивная перестройка метаболизма не завершена и резистентность к острой гипоксии еще не повышена, т.к организм не насыщен гормонами надпочечников. Вторая стадия (стадия резистентности) – формирование общего адаптационного синдрома – организм насыщается ГКС и др. гормонами, катехоламинами. Обеспечивается ускорение транспортакислорода и энергосубстратов. В рез-те контринсулярного действия гормонов на метаболизм происходит перераспределение энергоресурсов в пользу органов и тканей с инсулин-незасисимыми транспортерами глюкозы (ЦНС, миокард, диафрагма, надпочечники, гонады и др.). мобилизируются эндогенные пути получения глюкозы – гликогенолиз и глюконеогенез. Все это продлевает обратимые стадии некробиоза клеток вышеназванных органов при острой гипоксии, отдаляет сроки гибели, оказывает противошоковое действие; бол-во мезенхимальных органов находятся при этом в состоянии энергетической депривации. Третья стадия – «стадия физиологического выхода из стресса», для ее осуществления нужны биорегуляторы, обеспечивающие энергетическую и анаболическую реабилитацию тех органов и тканей, за счет депривации которых достигался общий адаптационный синдром – эндогенные опиаты, андрогены, инсулин, противодистрессорные регуляторы (ГАМК, простагландины) – эустрес. Выход из стресса реализуется через индукторы положительных эмоций – опиатные пептиды, выделяемые при удачном разрешении острой стрессогенной ситуации для индивида.
|
|
|
Болезни адаптации. При сильных и длительных стрессирующих воздействиях и/или при наличии недостаточности функций гипоталамуса, гипофиза и надпочечников (синдром хр. усталости, гипокортицизм, астено-невротический синдром и др) функц. Ресурсы нейро-эндокринного аппарата м.б превышены => «стадия истощения» (в т.ч минуя стадию резистентности) – вместо физиологического выхода из стресса = > антигипоксическая резист-ть падает, в клетках наступают необратимые некробиотические и апоптотические изменения. Стресс, приведший к этой стадии, обозначают как дистресс. Дистресс – ф-р риска многих заб-ний, поражающих органы и ткани, оказывающиеся при стрессе в условиях энергодепривации («болезни нарушенной адаптации») – атеросклероз, гипертензия, втор. Иммунодефицит, ожирение, артриты и др.
Болезни адаптации делят на болезни первично ослабленной адаптации и болезни перенапряженной адаптации:
1) При гипокортицизме, аутоимм. И др поражениях гипоталамуса, выраженном гипотирозе, гипопитуитаризме – создается ситуация «нестартовавшего» стресса с исходом в дистресс по типу метаболико-поведенческих нарушений, примером которых служит ряд тормозно-депрессивных состояний (астено-невротический синдром, синдром хронической усталости, сезонная депрессия и т.д)
2) К синдромам перенапряженной адаптации с выходом в дистресс относят кушингоидные и псевдокушингоидные состояния, которым свойственны однотипные метаболические и поведенческие нарушения (инсулинорезистентность, тенденция к гипергликемии, гипертензии, висцеральному ожирению, тревожно-меланхолические расстройства, эгоцентричное поведение). При таких синдромах происходит субстратно-энергетическая депривация мезенхимальных проивзодных. Это ведет к иммунодефицитам, остеопорозу и кожным стриям – неспецифическое проявление дизрегуляции соед. ткани. Сюда относят: метаболический синдром, ювенильный диспитуитаризм, третий триместр беременности, обсессивно-компульсивные нарушения, панически-депрессивные расстройства, хронический активный алкоголизм, синдром отмены наркотика и т.д.
Модели острого стресса:
1) Модель Селье – на крысах, продленная иммобилизация на сроки 6-72 ч при комнатной и при пониженной температуре приводит к выраженному стрессу, доходящему до стадии истощения – явления дистресса.
2) Модель Мэйсона – на частично обездвиженных обезьянах, животные подвергаются действию слабого раздражающего электротока через нерегулярные промежутки времени. Более адекватна стрессу у человека, допускает выход из стресса в дистресс или эустресс.
3) Ротационная – вращение мышей на граммофонном диске.
4) Холодовая – кратковременное (5 мин) помещение грызунов в условия холода (-20)
5) Плавание грызунов в холодной воде в теч. 5 мин – происходит многократный значительный прирост КА и ГКС. При этом не наблюдаются явления дистресса.
Патология гипоталамо-гипофизарной системы. Виды нарушений и их проявления. Нарушения прямых и обратных гипоталамо-гипофизарных связей. Патология гипоталамуса. Основные синдромы при гипоталамопатиях и их механизмы. Несахарный диабет и другие нарушения вазопрессиновых механизмов.
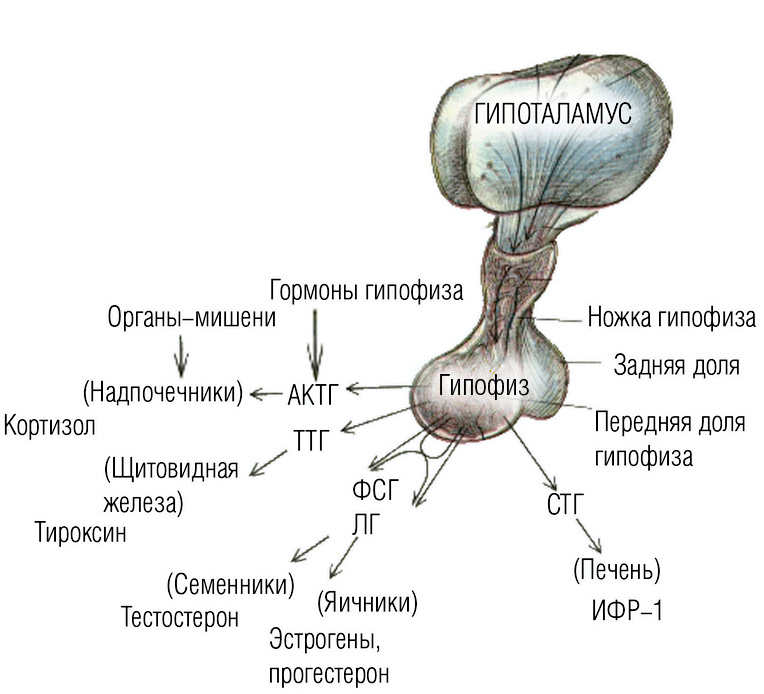 Гипоталамо-гипофизарная система:
Гипоталамо-гипофизарная система:
Гипоталамо- гипофизарный комплекс - высший нейроэндокринный трансмиттер организма, координирующий эндокринную регуляцию обмена веществ с работой вегетативной нервной и интегральной эмоционально – поведенческой реакциями лимбической системы.
Гипоталамус - место, куда стекается и где переключается сенсорная информация, касающаяся всех видов чувствительности. Книзу гипоталамус соединяется ножкой с гипофизом через нервные проводники и портальную систему сосудов. Гипофиз служит главным «интерфейсом» гипоталамуса во взаимодействии с периферическими железами.
Гипоталамус синтезирует:
1) Рилизинг-гормоны: либерины и статины,соответственно активаторы и ингибиторы секреторной деятельности аденогипофиза
2) Пептиды: пептид Y в аркуатном ядре стимулирует аппетит по средством взаимодействия с лептинам адипоцитов и гормонами ЖКТ.Ангиотензин II – пептид жажды. Холецистокин – стимулирует насыщение. Опиойдные – болевую чувствительность.
3) Биогенные амины: дофамин – подавляет продукцию гонадо – и тиролибирина,а также соматостатитна. Серотонин – увеличивает продукцию практически всех либиринов. Норадреналин – на кортиколибирины и тиролибирины. Гистамин – снижает продукцию пролактина.
Аденогипофиз образует следующие гормоны:
1) соматотропный - это гормон роста. Он стимулирует рост и физическое развитие детей. При недостаточном образовании гормона у детей происходит задержка роста и они становятся карликами. При избытке этого гормона в раннем возрасте возникает гигантизм,.Если количество гормона увеличивается во взрослом возрасте, возникает заболевание акромегалия. Ее признаками являются разрастание пальцев рук и ног, кистей и стоп, носа и нижней челюсти, языка, органов грудной и брюшной полости.
2) тиреотропный; стимулирует выделение щитовидной железой ее гормонов. Уровень образования тиреотропного гормона зависит от количества гормонов щитовидной железы в крови. При большом количестве в крови гормонов щитовидной железы образование тиреотропного гормона уменьшается, а при уменьшении – увеличивается. Если количество тиреотропина снижается до критических значений, то диагностируется тиреотоксикоз.
3) адренокортикотропный гормон оказывает влияние на выработку: глюкокортикоидов, к которым относятся кортикостерон, кортизон, кортизол. Половых гормонов: андрогенов, эстрогенов, прогестерона. И на выработку катехоламинов. Резкое понижение синтеза АКГТ может быть вызвано поражением легких и вызывать гипофункцию коры надпочечника. Болезнь Аддисона, Эктопический АКТГ-синдром (кортикотропин повышен в 1,5 раза). Причиной заболевания является злокачественная опухоль, Признаки и симптомы заболевания во всем схожи с болезнью Иценко—Кушинга. Врождённая надпочечниковая недостаточность (кортикотропин повышен до 2,5 раз). Заболевание может быть смертельно опасным, обусловлено нарушением или полным прекращением деятельности коры надпочечников.
4) пролактин;
5) фолликулостимулирующий;
6) лютеинизирующий.
Нейрогипофиз накапливает и секретирует гормоны( супраоптического и паравентрикулярного ядер гипоталамуса):
Супраоптическое ядро гипоталамуся выделяет вазопрессин. Главные функции которого — осморегуляция, стимуляция стресса и повышение кровяного давления. Параветрикулярное ядро гипаталамуса бырабатывает окситоцин. Главные функции − вызывает сокращение миоэпителиальных клеток, окружающих альвеолы и протоки молочной железы, что при лактации обеспечивает выделение молока и оказывает стимулирующее действие на гладкую мускулатуру матки. У свиньи вазопрессип, отличающийся от человеческого одной аминокислотой У человека понятия вазопрессин = АДГ, а у низших позвоночных — вазотоцин и он обладает смешанной вазопрессин-окситоциновой активностью.В гипоталамусе вазопрессин синтезируются в виде препрогормона,и содержат в своей структуре специальные пептид-переносчик нейрофизин, который образуюет комплекс – белок Х.Б.ван Дейка. Препрогормон гликозилируются в прогормон и пакуются в гранулы и они транспортируются в терминали аксонов, в заднюю долго гипофиза, а частично — в медиальное возвышение и в III мозговой желудочек. Поэтому, пересечение ножки гипофиза и его разрушение не лишают организм вазопрессина и окситоцина.В терминалях аксонов часть гранул запасается, а часть —секрецируются путём кальций-зависимого экзоцитоза. Специальные протеазы отщепляют от прогормонов неирофизины и вазопрессин попадает в кровь. Общим стимулятором секреции и вазопрессина и окситоцина является боль, а общим ингибитором — этиловый спирт. Гипволемия стимулирует выброс и синтез АДГ. Гиперволемия, невесомость, ныряние под воду понижают продукцию АДГ. При шоке возрастает концентрация в крови вазопрессина. При жажде – снижается уровень вазопрессина.
Патология гипоталамо-гипофизарной системы:
В норме не должны вырабатываться контрарегуляторные гипоталамические стимуляторы противоположных метаболических путей. При патологии(н-р: при охлаждении продуцируются и кортиколиберины и тиролиберины (Кортикотропин действует на переднюю долю гипофиза и вызывает там секрецию АКТГ,а усиление продукции тиреотропного гормона, увеличивает образование гормонов щитовидной железы), а конечные результаты усиленного действия АКТГ тиреотропного гормона на теплообмен не совпадают (это касается соотношения запасаемой и рассеиваемой энергии).
Гипоталомические гормоны попадают в аденогипофиз по портальной системе кровообращения.Из-за высокого уровня удельного кровотока – 10 мл/г ткани в мин, тромбоз хотя бы одной из гипофизарных артерий не вызывает его инфаркта, поэтому ранее описанная клиническая картина тромбоза гипофизарных артерий, на самом деле является (синдромом Шихена послеродовый аутоимунный гипопитуитапизм.). Массивные кровопотери и сепсис, ведут к спазму артерий гипофиза и множественным внутрисосудистым тромбозам, что ведет к некрозу тканей гипофиза. Вследствие поражения аденогипофиза нарушается продукция тропных гормонов с последующими повреждениями эндокринных желез и соответствующей симптоматикой. Группу высокого риска составляют женщины с кровотечениями в родах, у которых в прошлом уже были маточные кровотечения. Аутоимунный гипофизит (синдром Шихена) может привести к приобретенному центральному несахарному диабету.
Нарушения функций гипоталамуса порой трудно отделимы от гипофизарных нарушений. Например, первичное ожирение и ряд вторичных считаются патологией гипоталамического липостаза.
Первичная форма, развитие которой определяется пищевым эндокринная – проявляется при гипотериозе, болезни Иценко-Кушинга, гипогонадизме и некоторых других заболеваниях.
Дата добавления: 2016-01-04; просмотров: 48; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
