РАСЧЕТ ЭДС ДЛЯ ГАЛЬВАНИЧЕСКОЙ ЦЕПИ
Продолжительность занятия – 2 часа
В результате работы по данной теме студенты должны
получить представление:
- об электродном потенциале и его зависимости от различных факторов;
- о стандартных электродах и их обозначениях;
- о стандартном водородном потенциале;
знать:
- определение понятия «гальванический элемент», его обозначение и применение;
- формулу ЭДС;
- определение понятия «электрохимический ряд напряжения металлов»»
- уравнение Нернста;
- электроды потенциометрии;
уметь:
- составлять гальванические цепи;
- рассчитывать ЭДС гальванической цепи, определять анод, катод и процессы, протекающие на них.
Задание на дом:
1. Выучите теоретический материал по теме «Потенциометрический метод анализа».
2. Выполните в упражнении 19 (задания 15,16).
3. Подготовьтесь к лабораторной работе 13.
Контрольные вопросы для усвоения практических навыков
1. На чем основаны потенциометрические методы анализа?
2. Какая зависимость выражается уравнением Нернста?
3. Какой порядок соблюдают при записи гальванической цепи?
4. Какие требования предъявляются к электродам индикаторным и сравнения?
5. Для чего используют стеклянный электрод? Укажите его достоинства и недостатки.
6. В каких координатах строят кривые потенциометрического титрования? Как находят конечную точку титрования?
7. Для чего применяется потенциометрия в ТХК пищевой промышленности?
|
|
|
8. В каких целях при определении рН используют буферные растворы?
Задания для приобретения практических навыков
Выполните упражнение 19
Упражнение 19.
Составьте гальваническую цепь, образованную двумя окислительно-восстановительными парами, рассчитайте значение ее ЭДС. Укажите анод, катод и процессы, которые протекают между парами предложенными ниже:
1. Медь, ее соль и магний, его соль.
2. Алюминий, его соль и магний, его соль.
3. Цинк, его соль и серебро, его соль.
4. Марганец, его соль и медь, ее соль.
5. Золото, его соль и литий, его соль.
6. Калий, его соль и ртуть, ее соль.
7. Барий, его соль и серебро, его соль.
8. Стронций, его соль и медь, ее соль.
9. Кальций, его соль и свинец, его соль.
10. Натрий, его соль и олово, его соль.
11. Магний, его соль и никель, его соль.
12. Бериллий, его соль и кобальт, его соль
13. Алюминий, его соль и кадмий, его соль.
14. Марганец, его соль и железо, его соль.
15. Хром, его соль и цинк, его соль.
16. Марганец, его соль и золото, его соль.
17. Хром, его соль и ртуть, его соль.
18. Серебро, его соль и цинк, его соль.
19. Железо, его соль и медь, ее соль.
20. Кадмий, его соль и свинец, его соль.
21. Кобальт, его соль и олово, его соль.
|
|
|
22. Никель, его соль и марганец, его соль.
23. Олово, его соль и хром, его соль.
24. Свинец его соль и цинк, его соль.
25. Медь, ее соль и железо его соль.
26. Серебро, его соль и кадмий, его соль.
27. Ртуть, ее соль и кобальт, его соль.
28. Золото, его соль и никель, его соль.
29. Свинец, его соль и марганец, его соль.
30. Хром, его соль и олово его соль.
Внимание!
Используйте таблицу «Стандартные электродные потенциалы окислительно-восстановительных систем».
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ
ПОТЕНЦИОМЕТРИЧЕСКОГО МЕТОДА АНАЛИЗА.
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ. СТАНДАРТНЫЙ ВОДОРОДНЫЙ ЭЛЕКТРОД.
ГАЛЬВАНИЧЕСКИЕ ЦЕПИ. УРАВНЕНИЕ НЕРНСТА
Электродный потенциал возникает на границе соприкосновения металла с жидкостью, например с водой или водным раствором соли этого металла. Условное обозначение такой системы 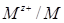 , где
, где 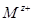 - потенциалопределяющие катионы металла (окисленная форма), черта отмечает наличие границы раздела раствор - твердая фаза, М – металл (восстановленная форма).
- потенциалопределяющие катионы металла (окисленная форма), черта отмечает наличие границы раздела раствор - твердая фаза, М – металл (восстановленная форма).
Рис. 24 Возникновение электродных потенциалов:
а – при погружении металла в чистую воду; б – при погружении металла в раствор его соли
В результате перехода катионов металла через поверхность раздела металл–раствор всегда образуется ДЭС и возникает электродный потенциал. Величина электродного потенциала φ ( 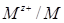 ), возникающего на границе металл-раствор, зависит от следующих факторов:
), возникающего на границе металл-раствор, зависит от следующих факторов:
|
|
|
- природы металла (энергии его кристаллической решетки, энергии ионизации атомов метали и энергии гидратации его катионов);
- активности (эффективной концентрации) потенциалопределяющих ионов в растворе;
- температуры раствора.
Потенциал, возникающий в системе при стандартных условиях, называется стандартным и обозначается φ° ( 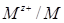 ).
).
 Стандартным электродным потенциалом называется потенциал, возникающий на границе металл-раствор при активности потенциалопределяющих ионов в растворе 1 моль/л и температуре 293 К.
Стандартным электродным потенциалом называется потенциал, возникающий на границе металл-раствор при активности потенциалопределяющих ионов в растворе 1 моль/л и температуре 293 К.
Абсолютное значение стандартного электродного потенциала отдельно взятого электрода измерить или рассчитать невозможно, но можно определить его значение относительно какого-либо электрода, выбранного в качестве эталона. Согласно Международному соглашению таким эталоном служит стандартный водородный электрод.
В электрохимии используется шкала стандартных потенциалов, определенных относительно потенциала стандартного водородного электрода.
|
|
|
Рис. 25 Стандартный водородный электрод
Стандартный водородный электрод представляет собой платиновую пластинку, покрытую платиновой чернью (рыхлой платиной) и опущенную в раствор кислоты, в котором активность ионов водорода равна 1 моль/л и через который все время пропускается очень чистый газообразный водород под давлением 1 атм (101 325 Па).
Условное обозначение стандартного водородного электрода:
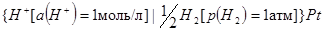
На водородном электроде протекают обратимые процессы:
Pt




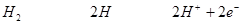
Потенциал стандартного водородного электрода условно принят за нуль при любой температуре:
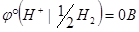
Следует отметить, что водородный электрод не очень удобен в работе, но важен в термодинамическом отношении, поскольку он служит первичным стандартом, относительно которого определяются потенциалы других электродов. На практике вместо водородного электрода в качестве электрода сравнения широко используют хлорсеребряный электрод.
Для определения электродного потенциала какого-либо электрода относительно стандартного водородного составляют гальваническую цепь (элемент) из двух полуэлементов: исследуемого электрода и стандартного водородного электрода.
Гальваническая цепь
Гальваническая цепь представляет собой замкнутую систему, состоящую из двух электродов, соединенных между собой внешней цепью – электронный проводник (металл) и внутренней цепью – ионный проводник (растворы электролита, соединенные солевым мостиком). В гальванической цепи происходит превращение химической энергии процессов окисления и восстановления в электрическую энергию. В гальванической цепи различают электроды: анод и катод.
 Анодом в электрохимии называется электрод, на котором протекает реакция окисления, т.е. отдача электронов.
Анодом в электрохимии называется электрод, на котором протекает реакция окисления, т.е. отдача электронов.
В гальванической цепи анод заряжен отрицательно, и он посылает электроны во внешнюю цепь. Анодом всегда является электрод, материал которого легче окисляется, например, более активный металл. В отличие от анода, анодный раствор из-за накопления в нем избытка катионов заряжается положительно.
 Катодом в электрохимии называется электрод, на котором протекает реакция восстановления, т.е. присоединение электронов.
Катодом в электрохимии называется электрод, на котором протекает реакция восстановления, т.е. присоединение электронов.
В гальванической цепи катод заряжен положительно, и он получает электроны из внешней цепи. Катодом является электрод из менее активного металла, катионы которого легче восстанавливаются. В отличие от катода, катодный раствор в гальванической цепи заряжается отрицательно из-за накопления в нем анионов.
Необходимо всегда помнить, что при рассмотрении электролиза (когда электрическая энергия превращается в химическую) характер процессов, протекающих на электродах, сохраняется, а знаки анода и катода изменяются на противоположные.
При условном обозначении гальванической цепи анод записывается слева, катод справа. Граница раздела между электродом и раствором, в который он опущен, обозначается одной чертой, а электролитический мостик, соединяющий анодный и катодный растворы, обозначается двумя чертами:

 | |||||
 |  | ||||



 – Анод Анодный Катодный Катод +
– Анод Анодный Катодный Катод +
раствор раствор
 |  | ||||||
 | |||||||
 | |||||||
анионы
 катионы
катионы

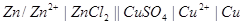
При замыкании гальванической цепи в ней из-за пространственного разделения реакций окисления (анод) и восстановления (катод) происходит направленное движение электронов от анода к катоду по внешней цепи, а ионов – по внутренней цепи (электролитическому мостику). Вследствие возникновения направленного движения заряженных частиц в гальванической цепи имеет место превращение химической энергии окислительно-восстановительных реакций в электрическую. Таким образом, гальванические цепи могут быть химическими источниками тока.
Способность гальванической цепи к переносу электрических зарядов характеризуется электродвижущей силой (ЭДС).
 ЭДС гальванической цепи определяется как разность потенциалов катода и анода:
ЭДС гальванической цепи определяется как разность потенциалов катода и анода: 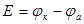 .
.
В гальванической цепи, работающей самопроизвольно, потенциал анода всегда меньше потенциала катода, и ее ЭДС – величина положительная (Е > 0).
Величина стандартного электродного потенциала металла характеризует его способность отдавать электроны и имеет постоянное для каждого металла значение. Стандартные электродные потенциалы металлов приведены в таблице 25.
Таблица 25
Дата добавления: 2018-09-22; просмотров: 476; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
