Хлорсеребряный электрод сравнения
Хлорсеребряный электрод (рис. 27) состоит из серебряной проволоки, покрытой слоем малорастворимой соли AgCl, опущенной в раствора KCl определенной концентрации (обычно насыщенный раствор KCl ) и солевого мостика, соединяющего этот раствор с исследуемым раствором. Электрохимическая цепь хлорсеребряного электрода записывается так: Ag | AgCl , KCl (нас).
В хлорсеребряном электроде на межфазной границе протекает следующая реакция:



Так как активность твердых веществ AgCl и Ag постоянна, то потенциал хлорсеребряного электрода зависит только от активности ионов 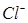 в растворе. Если активность ионов
в растворе. Если активность ионов 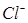 поддерживать постоянной, то потенциал хлорсеребряного электрода будет постоянной величиной. Проще всего поддерживать постоянной активность ионов хлора в растворе, используя насыщенный раствор KCl, в котором а (
поддерживать постоянной, то потенциал хлорсеребряного электрода будет постоянной величиной. Проще всего поддерживать постоянной активность ионов хлора в растворе, используя насыщенный раствор KCl, в котором а (  ) = const. В этом случае потенциал хлорсеребряного электрода по отношению к стандартному водородному электроду при 25°С
) = const. В этом случае потенциал хлорсеребряного электрода по отношению к стандартному водородному электроду при 25°С 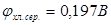 .
.
Рис. 27 Хлорсеребряный электрод сравнения
В гальваническом элементе хлорсеребряный электрод в зависимости от потенциала второго электрода может быть как анодом, так и катодом. В случае анода протекают реакции окисления серебра и взаимодействия его катиона с анионом хлора с образованием осадка AgCl:



Анод 
(окисление) 
В случае катода в системе происходит растворение осадка AgCl и восстановление катионов  :
:
|
|
|



Анод 
(восстановление) 
Потенциал хлорсеребряного электрода постоянен, легко воспроизводим и практически не зависит от протекания побочных реакций.
ИОНО- И МОЛЕКУЛЯРНОСЕЛЕКТИВНЫЕ ЭЛЕКТРОДЫ ОПРЕДЕЛЕНИЯ
Для измерения концентрации активных ионов: 
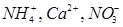 и других, а также различных веществ используют электроды определения, которые называют также индикаторными электродами. Потенциалы этих электродов зависят в основном от концентрации определяемого иона или вещества. Электродами определения прежде всего являются ионоселективные электроды, действие которых основано на возникновении мембранного потенциала на мембране с селективной чувствительностью к данному иону. Подобная мембрана способна адсорбировать или пропускать только определенный ион.
и других, а также различных веществ используют электроды определения, которые называют также индикаторными электродами. Потенциалы этих электродов зависят в основном от концентрации определяемого иона или вещества. Электродами определения прежде всего являются ионоселективные электроды, действие которых основано на возникновении мембранного потенциала на мембране с селективной чувствительностью к данному иону. Подобная мембрана способна адсорбировать или пропускать только определенный ион.
Все ионоселективные электроды в зависимости от агрегатного состояния мембран подразделяются на электроды с твердыми и жидкими мембранами. Наиболее широко используемым ионоселективным электродом определения с твердой мембраной является стеклянный электрод. Стеклянный электрод представляет собой трубку, заканчивающуюся тонкостенной стеклянной мембраной в виде шарика, чувствительной к определенному виду ионов. Внутри находится раствор, содержащий данный вид ионов, в который опущен внутренний электрод сравнения, соединяемый с внешней цепью. Чаще всего используется стеклянный электрод, чувствительный к ионам  и поэтому позволяющий определить рН раствора. В этом случае внутренним раствором является 0,1 М раствор HCl, а стеклянную мембрану (шарик) изготавливают из специального литийбарийсиликатного стекла (Рис. 28). Обозначают: Ag | AgCl | HCl.
и поэтому позволяющий определить рН раствора. В этом случае внутренним раствором является 0,1 М раствор HCl, а стеклянную мембрану (шарик) изготавливают из специального литийбарийсиликатного стекла (Рис. 28). Обозначают: Ag | AgCl | HCl.
|
|
|
Рис. 28 Стеклянный электрод для измерения рН
Чтобы повысить чувствительность стеклянной мембраны к ионам  , стеклянный электрод после хранения необходимо вымочить в разбавленном растворе HCl и далее сохранять в дистиллированной воде. При вымачивании стеклянной мембраны в кислоте поверхность стекла гидратируется, ионы щелочного металла в стекле обмениваются на ионы водорода
, стеклянный электрод после хранения необходимо вымочить в разбавленном растворе HCl и далее сохранять в дистиллированной воде. При вымачивании стеклянной мембраны в кислоте поверхность стекла гидратируется, ионы щелочного металла в стекле обмениваются на ионы водорода  , находящиеся в растворе:
, находящиеся в растворе:



В результате на каждой границе стекло-раствор возникает свой двойной электрический слой, характеризующийся потенциалом, зависящим от активности ионов  . Между внутренней и наружной поверхностями мембраны появляется разность потенциалов, которая зависит в основном от активности ионов
. Между внутренней и наружной поверхностями мембраны появляется разность потенциалов, которая зависит в основном от активности ионов 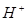 в исследуемом растворе, так как внутренний раствор имеет постоянную активность ионов
в исследуемом растворе, так как внутренний раствор имеет постоянную активность ионов 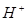 . Для измерения этой разности потенциалов необходимо составить гальваническую систему из стеклянного электрода, содержащего обычно внутренний хлорсеребряный электрод, и внешнего электрода сравнения (см. рис. 29):
. Для измерения этой разности потенциалов необходимо составить гальваническую систему из стеклянного электрода, содержащего обычно внутренний хлорсеребряный электрод, и внешнего электрода сравнения (см. рис. 29):
|
|
|



 ЭДС =
ЭДС = 
 |  |
Стеклянный электрод Внешний электрод
определения сравнения
 |  |  |  |  |  |
Внутренний Внутренний Стеклянная Исследуемый KCl ( p ) AgCl , Ag
электрод раствор мембрана раствор насыщ.
сравнения 0,1 М HCl рН = ?
Ag, AgCl a(H+) = const
|
|
|
j 1 = const j вн = const j нар = f(pH) j хл . сер = const
Рис. 29 Установка для потенциометрического титрования
1 – стакан для титрования; 2 – индикаторный электрод; 3 – электрод сравнения;
4 – бюретка; 5 – мешатель; 6 – исследуемый раствор; 7 – магнитная мешалка;
8 – рН-метр-милливольтметр
Потенциал стеклянного электрода является функцией рН исследуемого раствора, и ЭДС гальванической цепи из стеклянного электрода и электрода сравнения тоже будет функцией рН исследуемого раствора.
Лекция 6
Дата добавления: 2018-09-22; просмотров: 2913; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
