ОТВЕТЬТЕ НА ВОПРОСЫ И РЕШИТЕ ЗАДАЧИ
1. Как анализируют восстановители и окислители методом перманганатометрии?
2. Как вычислить молярную массу эквивалента окислителя и восстановителя?
3. Чему равна  каждого из следующих окислителей и восстановителей:
каждого из следующих окислителей и восстановителей:  в кислой и щелочной средах?
в кислой и щелочной средах?
4. По какому х.ч. веществу определяют нормальность раствора  ?
?
5. Составьте уравнение реакции взаимодействия  с
с  в кислой среде?
в кислой среде?
6. В 1 л раствора содержится 0,3161 г  . Определите нормальность этого раствора и титр его по железу.
. Определите нормальность этого раствора и титр его по железу.
Ответ: 0,010 н.; 0,00055585 г/мл.
7. На титрование 20,0 мл раствора 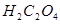 , содержащегося в 400 мл раствора 5,04 г
, содержащегося в 400 мл раствора 5,04 г  , израсходовано 22,5 мл раствора
, израсходовано 22,5 мл раствора  . Определить нормальность и титр раствора
. Определить нормальность и титр раствора  по железу. Как разбавить 1 л этого раствора, чтобы получить 0,1 н. раствор?
по железу. Как разбавить 1 л этого раствора, чтобы получить 0,1 н. раствор?
Ответ: 0,178 н.; 0,00994 г/мл; прибавить 780 мл воды.
8. Из 1,70000 г технической щавелевой кислоты (кристаллической) приготовлено 200 мл раствора; на титрование 20,0 мл полученного раствора израсходовано 16,20 мл 0,1 н. раствора  . Определить процентное содержание
. Определить процентное содержание  в анализируемом образце.
в анализируемом образце.
Ответ: 60,04%.
9. Навеску  в 0,9375 г растворили и довели объем раствора водой до 500 мл. Вычислить нормальность раствора для реакции: а) в кислой среде; б) в нейтральной среде.
в 0,9375 г растворили и довели объем раствора водой до 500 мл. Вычислить нормальность раствора для реакции: а) в кислой среде; б) в нейтральной среде.
Ответ: а) 0,0594 н.; б) 0,0356 г.
10. Раствор перманганата калия в кислой среде 0,1 н. Какой нормальности будет этот раствор в щелочной среде?
11. К 20,00 мл раствора хлорида кальция прилили избыток раствора оксалата аммония  ; отфильтровали полученный осадок; промыли его и обработали разбавленной серной кислотой
; отфильтровали полученный осадок; промыли его и обработали разбавленной серной кислотой
 .
.
Выделившуюся при этом щавелевую кислоту оттитровали 0,1 н раствором перманганата калия, которого израсходовали 24,5 мл. Вычислить титр и нормальность раствора  .
.
Ответ: 0,01350 г/мл и 0,1225 н.
12. Почему при иодометрическом определении окислителей KI добавляют в избытке?
13. Почему перед титрованием кислых растворов тиосульфатом необходимо разбавлять их большим количеством воды?
14. К 30,00 мл 0,107 н. раствора  добавлены
добавлены  и избыток KI; на титрование выделившегося при этом иода израсходовано 33,27 мл раствора
и избыток KI; на титрование выделившегося при этом иода израсходовано 33,27 мл раствора  . Определить нормальность раствора
. Определить нормальность раствора  и титр его по иоду.
и титр его по иоду.
Ответ: 0,0965 г., 0,0122 г/мл.
15. Сколько граммов  содержится в растворе, если после добавления к нему избытка KI и
содержится в растворе, если после добавления к нему избытка KI и  на титрование выделившегося иода израсходовано 30,00 мл 0,1 н. раствора
на титрование выделившегося иода израсходовано 30,00 мл 0,1 н. раствора  ?
?
Ответ: 0,147 г.
Лекция 5
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА.
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ
Изучив темы, студенты должны
иметь представление:
- о классификации физико-химических методов анализа;
- о достоинствах и недостатках физико-химических методов анализа;
знать:
- классификацию электрохимических методов анализа;
- сущность кондуктометрического метода анализа;
- сущность полярографического метода анализа;
- сущность потенциометрического метода анализа;
уметь:
- определять содержание вещества в растворе с помощью градуировочного графика.
Задание на дом:
Выучите теоретический материал по теме «Физико-химические методы анализа. Электрохимические методы анализа»
Дата добавления: 2018-09-22; просмотров: 536; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
