ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
В основе определения направления самопроизвольного протекания ОВР лежит следующее правило:
 Окислительно-восстановительные реакции самопроизвольно протекают всегда в сторону превращения сильного окислителя в слабый сопряженный восстановитель или сильного восстановителя в слабый сопряженный окислитель.
Окислительно-восстановительные реакции самопроизвольно протекают всегда в сторону превращения сильного окислителя в слабый сопряженный восстановитель или сильного восстановителя в слабый сопряженный окислитель.
Количественной мерой окислительно-восстановительной способности данной сопряженной окислительно-восстановительной пары является величина ее восстановительного потенциала φ, которая зависит от:
- природы окисленной и восстановленной формы данной сопряженной пары;
- соотношения концентраций окисленной и восстановленной формы данной сопряженной пары;
- температуры.
В тех случаях, когда в процессе превращения окислителя или восстановителя участвуют ионы Н+ или ОН - , φ зависит также и от рН раствора. Значение, которое принимает φ при стандартных условиях – концентрация всех компонентов, участвующих в реакции, включая ионы воды Н+ (в кислой среде) и ОН - (в щелочной среде), равная 1 моль/л, температура 298 К, - называется стандартным восстановительным потенциалом и обозначается φ°. Величина φ° является количественной характеристикой окислительно-восстановительных свойств данной сопряженной окислительно-восстановительной пары при стандартных условиях.

 Способа определения абсолютного значения потенциалов для сопряженных окислительно-восстановительных пар не существует. Поэтому пользуются относительными величинами, характеризующими потенциалы сопряженных пар относительно эталонной пары
Способа определения абсолютного значения потенциалов для сопряженных окислительно-восстановительных пар не существует. Поэтому пользуются относительными величинами, характеризующими потенциалы сопряженных пар относительно эталонной пары 
 потенциал которой при стандартных условиях условно принят равным нулю
потенциал которой при стандартных условиях условно принят равным нулю 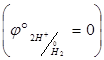 .
.
|
|
|
Положительное значение φ° имеют окислительно-восстановительные пары, в которых окисленная форма присоединяет электроны легче, чем катион водорода в эталонной паре. Отрицательное значение φ° имеют окислительно-восстановительные пары, в которых окисленная форма присоединяет электроны труднее, чем Н+ в эталонной паре. Следовательно, чем больше (т.е. положительнее) значение φ° данной сопряженной окислительно-восстановительной пары, тем сильнее выражены ее окислительные свойства, а восстановительные свойства - соответственно слабее.
В таблице 24 приведены стандартные значения потенциалов некоторых сопряженных окислительно-восстановительных пар.
В условиях, отличных от стандартных, величина φ рассчитывается по уравнению Нернста:

Суть окислительно-восстановительных реакций заключается в конкуренции за присоединение электрона участвующих окислителей. При этом электрон присоединяет та сопряженная пара, окисленная форма которой сильнее его удерживает. Это отражает следующая схема:
|
|
|
 φI φII
φI φII



 восстановитель I окислитель I + + окислитель II восстановитель II
восстановитель I окислитель I + + окислитель II восстановитель II

Смещение окислительно-восстановительного равновесия

 φI > φII
φI > φII
φI < φII
Сопоставляя потенциалы сопряженных пар, участвующих в окислительно-восстановительной реакции, можно заранее определить направление, в котором будет самопроизвольно протекать та или иная реакция.
 При взаимодействии двух сопряженных окислительно-восстановительных пар окислителем всегда будет окисленная форма той пары, потенциал которой имеет более положительное значение.
При взаимодействии двух сопряженных окислительно-восстановительных пар окислителем всегда будет окисленная форма той пары, потенциал которой имеет более положительное значение.
Пример. В реакционной смеси содержатся две сопряженные окислительно-восстановительные пары:  Так как первая пара содержит более сильный окислитель (I 2), чем вторая пара (S), то в стандартных условиях самопроизвольно пойдет реакция, в которой окислителем будет I 2, а восстановителем –
Так как первая пара содержит более сильный окислитель (I 2), чем вторая пара (S), то в стандартных условиях самопроизвольно пойдет реакция, в которой окислителем будет I 2, а восстановителем – 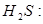

Для определения направления окислительно-восстановительной реакции можно также пользоваться величиной ее ЭДС.
|
|
|
 ЭДС окислительно-восстановительной реакции в стандартных условиях (Е°) численно равна разности стандартных потенциалов сопряженных окислительно-восстановительных пар, участвующих в реакции:
ЭДС окислительно-восстановительной реакции в стандартных условиях (Е°) численно равна разности стандартных потенциалов сопряженных окислительно-восстановительных пар, участвующих в реакции:  ,
, 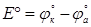 .
.
 Условием самопроизвольного протекания окислительно-восстановительной реакции является положительное значение ее ЭДС, т.е.
Условием самопроизвольного протекания окислительно-восстановительной реакции является положительное значение ее ЭДС, т.е.  > 0.
> 0.
С учетом этого условия для самопроизвольно протекающей ОВР значение ц окислительно-восстановительной пары, выступающей окислителем, должно быть больше ц второй окислительно-восстановительной пары, играющей роль восстановителя в данной реакции. Так, в рассмотренном выше примере:
 = 0,54 – 0,17 = 0,37 В.
= 0,54 – 0,17 = 0,37 В.
Если Е°= 0, то равновероятно протекание ОВР как в прямом, так и в обратном направлении, и это является условием возникновения химического равновесия для окислительно-восстановительного процесса.
Принято считать, что те реакции, ЭДС которых менее 0,35 В, – обратимы, при больших ЭДС – практически необратимые.
 Пример 1. Приведена схема ОВР
Пример 1. Приведена схема ОВР  Осуществима ли эта реакция и в каком направлении она происходит?
Осуществима ли эта реакция и в каком направлении она происходит?
| Найти: осуществима ли реакция? | Решение: 1. Записываем полуреакцию для процесса восстановления
Окисленная форма - Восстановленная форма - Электродный потенциал окислителя - 2. Записываем полуреакцию для процесса окисления
Окисленная форма - Восстановленная форма - Электродный потенциал окислителя - 3. Сопоставим электродные потенциалы окисленных форм
Делаем вывод: окисленная форма первой пары для этой системы является окислителем, а восстановленная форма второй пары
Ответ: реакция осуществима и проходит по прямому направлению.
| ||
Дано:


|
Пример 2. Можно ли ионы 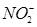 восстановить ионами
восстановить ионами  ?
?
| Найти: осуществима ли реакция? | Решение: 1. Записываем полуреакцию для процесса восстановления
Окисленная форма - Восстановленная форма - Электродный потенциал окислителя - 2. Записываем полуреакцию для процесса окисления
Окисленная форма - Восстановленная форма - Электродный потенциал окислителя - 3. Сопоставим электродные потенциалы окисленных форм
Делаем вывод: окисленная форма первой пары для этой системы не может быть окислителем ∆φ° = φ° ох - φ° Red = 0,99 – 1,09 < 0.
Ответ: Ионы |
Дано:


|
Упражнение 18.
Решить задачи:
1. Можно ли с помощью  окислить HCl до
окислить HCl до  ?
?
2. Можно ли с помощью  окислить
окислить  до элементарной серы?
до элементарной серы?
3. а) Можно ли хлоридом олова (II) восстановить хлорид железа (III)?
б) Можно ли перманганатом калия окислить нитрит кобальта (II) в кислой среде?
в) В какой среде соединения железа (II) можно окислить иодом?
4. Можно ли приготовить раствор, содержащий одновременно кислоты  и HI ?
и HI ?
Таблица 24
Дата добавления: 2018-09-22; просмотров: 1525; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!



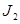

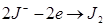

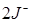

 = + 1,19 B >
= + 1,19 B >  = + 0,54 B.
= + 0,54 B. - восстановителем ∆φ° = φ° ох - φ° Red = + 1,19 – 0,54 > 0.
- восстановителем ∆φ° = φ° ох - φ° Red = + 1,19 – 0,54 > 0.







 = 1,09 B >
= 1,09 B >