Стандартные электродные потенциалы металлов в водных растворах
При 298 К (ряд напряжений металлов)
 Ряд напряжений – это расположение металлов в порядке возрастания их стандартных электродных потенциалов.
Ряд напряжений – это расположение металлов в порядке возрастания их стандартных электродных потенциалов.
В ряду напряжений те металлы, которые отдают электроны легче, чем водород, стоят слева от водорода и имеют отрицательные значения стандартных электродных потенциалов. Те металлы, которые отдают электроны труднее, чем водород, стоят справа от водорода и имеют положительные значения стандартных электродных потенциалов. Чем меньше значение φ° ( 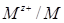 ), тем активнее металл.
), тем активнее металл.
Измерение электродных потенциалов.
Если измерить ЭДС гальванической цепи, составленной из исследуемого электрода и стандартного водородного, то можно определить значение электродного потенциала исследуемого электрода.
 Значение электродного потенциала численно равно ЭДС гальванической цепи, составленной из стандартного водородного электрода и электрода, потенциал которого подлежит определению и имеет знак «+», если на нем протекает процесс восстановления, и знак « – », если процесс окисления.
Значение электродного потенциала численно равно ЭДС гальванической цепи, составленной из стандартного водородного электрода и электрода, потенциал которого подлежит определению и имеет знак «+», если на нем протекает процесс восстановления, и знак « – », если процесс окисления.
Рассмотрим конкретные примеры. Определим значение стандартного потенциала цинкового электрода, опущенного в раствор соли цинка, в котором активность катионов 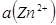 = 1 моль/л. Поскольку цинк окисляется легче, чем водород, то в гальванической цепи цинковый электрод будет анодом, а стандартный водородный электрод – катодом (рис. 26).
= 1 моль/л. Поскольку цинк окисляется легче, чем водород, то в гальванической цепи цинковый электрод будет анодом, а стандартный водородный электрод – катодом (рис. 26).
|
|
|
Запишем схему составленной гальванической цепи:
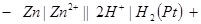
Рис. 26. Гальваническая цепь для измерения стандартного электродного
Потенциала цинкового электрода
ЭДС этой гальванической цепи равна разности потенциалов катода и анода:
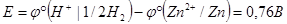
Так как 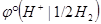 условно принят за ноль, то
условно принят за ноль, то 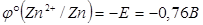 .
.
Определим стандартный потенциал медного электрода, если ЭДС гальванической цепи, составленной из определяемого электрода и стандартного водородного, равна 0,34 В.
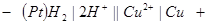
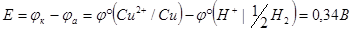
Так как 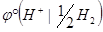 = 0 В, то
= 0 В, то 
Уравнение Нернста. Значение электродного потенциала, возникающего на границе металл-раствор, зависит от природы металла, активности его ионов в растворе и от температуры. Влияние всех перечисленных факторов на величину электродного потенциала металла выражается уравнением Нернста:
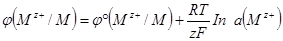
где ц° - стандартный электродный потенциал;
R – универсальная газовая постоянная, 8,31 Дж/(моль · К);
Т – температура, К;
z – заряд потенциалопределяющих ионов металла;
F – число Фарадея, 96 500 Кл/моль;
 - активность потенциалопределяющих ионов металла в растворе,
- активность потенциалопределяющих ионов металла в растворе,
моль/л.
Если ввести численные значения постоянных R и F и перейти от натурального логарифма к десятичному, уравнение Нернста примет вид:
|
|
|
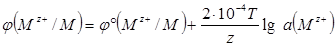
При стандартной температуре 298 К уравнение Нернста имеет вид:
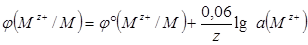
Дата добавления: 2018-09-22; просмотров: 358; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
