Стандартные электродные потенциалы
Окислительно-восстановительных систем
| Элемент | Уравнение реакции | φ°, В |
| Азот | 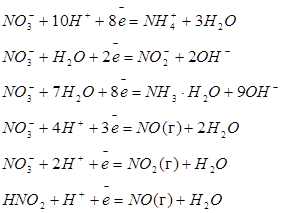
| +0,87 +0,10 -0,12 +0,96 +0,80 +0,99 |
| Алюминий | 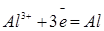
| -1,66 |
| Бром | 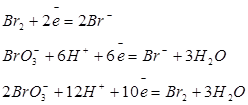
| +1,09 +1,45 +1,52 |
| Висмут | 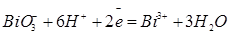
| +1,80 |
| Железо | 
| +0,77 |
| Золото | 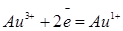
| +1,41 |
| Иод | 
| +0,54 +1,09 +1,19 |
| Кислород | 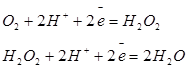
| +0,68 +1,78 |
| Марганец | 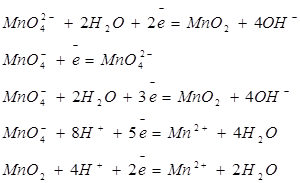
| +0,51 +0,56 +0,60 +1,52 +1,23 |
Продолжение табл. 24
| Элемент | Уравнение реакции | φ°, В |
| Мышьяк | 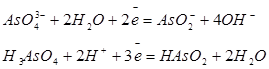
| -0,71 +0,56 |
| Олово | 
| +0,15 |
| Селен | 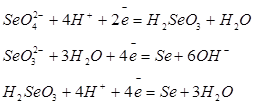
| +1,15 -0,366 +0,74 |
| Сера | 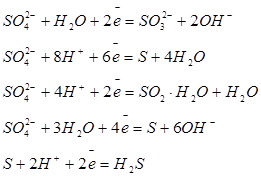
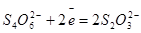
| -0,93 +0,36 +0,17 -0,90 +0,17 + 0,09 |
| Таллий | 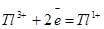
| +1,25 |
| Фосфор | 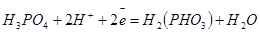
| -0,28 |
| Хлор | 
| +1,36 +1,45 +1,47 +1,50 +0,88 |
| Хром | 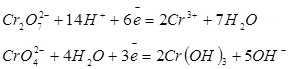
| +1,33 -0,13 |
Продолжение табл. 24
| Элемент | Уравнение реакции | φ°, В |
| Углерод | 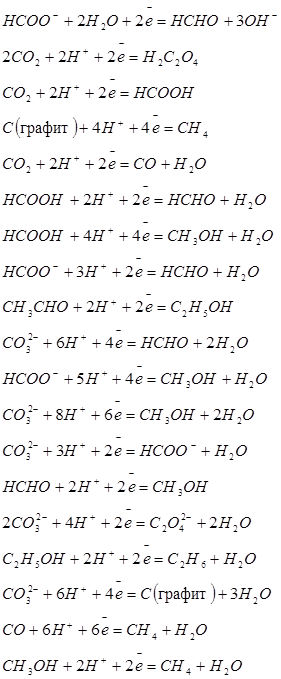
| -1,07 -0,49 -0,20 -0,132 -0,12 -0,01 +0,145 +0,167 +0,19 +0,197 +0,199 +0,209 +0,227 +0,232 +0,441 +0,46 +0,475 +0,497 +0,59 |
Подтема 2. ПЕРМАНГАНАТОМЕТРИЯ
Перманганатометрический метод анализа основан на реакции перманганата калия с восстановителями преимущественно в кислой среде.
В анализе некоторых органических соединений используется восстановление в сильнощелочной среде по уравнению (см. лаб. работы 1, 11 и опорный конспект 2 (с. 178)).
Рабочие растворы
Титрованный раствор перманганата калия по точной навеске кристаллического препарата приготовить невозможно, так как в нем всегда содержится некоторое количество  и другие продукты разложения. Перед установлением точной концентрации раствор
и другие продукты разложения. Перед установлением точной концентрации раствор  выдерживают в темной склянке в течение 7-10 дней. За это время происходит окисление восстановителей, присутствие которых в дистиллированной воде полностью исключить не удается (пыль, следы органических соединений и т.д.). Для ускорения этих процессов раствор перманганата калия иногда кипятят. Необходимо учитывать, что вода обладает окислительно-восстановительными свойствами и может восстанавливать перманганат. Эта реакция идет медленно, но
выдерживают в темной склянке в течение 7-10 дней. За это время происходит окисление восстановителей, присутствие которых в дистиллированной воде полностью исключить не удается (пыль, следы органических соединений и т.д.). Для ускорения этих процессов раствор перманганата калия иногда кипятят. Необходимо учитывать, что вода обладает окислительно-восстановительными свойствами и может восстанавливать перманганат. Эта реакция идет медленно, но  и прямой солнечный свет катализируют процесс разложения
и прямой солнечный свет катализируют процесс разложения 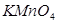 , поэтому раствор хранят в темном месте, а через 7-10 дней осадок
, поэтому раствор хранят в темном месте, а через 7-10 дней осадок  необходимо удалить. Раствор
необходимо удалить. Раствор 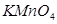 обычно осторожно сливают с осадка или фильтруют через стеклянный фильтр. Приготовленный таким образом раствор
обычно осторожно сливают с осадка или фильтруют через стеклянный фильтр. Приготовленный таким образом раствор 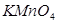 , не слишком низкой концентрации (0,05 н.) и выше, не изменяет титр продолжительное время. Титр раствора перманганата калия устанавливают по безводному оксалату натрия
, не слишком низкой концентрации (0,05 н.) и выше, не изменяет титр продолжительное время. Титр раствора перманганата калия устанавливают по безводному оксалату натрия 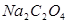 или дигидрату щавелевой кислоты
или дигидрату щавелевой кислоты  . Реакция взаимодействия перманганата калия со щавелевой кислотой относится к типу автокаталитических:
. Реакция взаимодействия перманганата калия со щавелевой кислотой относится к типу автокаталитических:
|
|
|
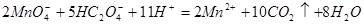 .
.
Она катализируется ионами 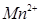 . Первые капли перманганата даже в горячем растворе обесцвечиваются очень медленно. В ходе титрования концентрация ионов
. Первые капли перманганата даже в горячем растворе обесцвечиваются очень медленно. В ходе титрования концентрация ионов  возрастает и скорость реакции увеличивается: реакция сама по себе поставляет катализатор.
возрастает и скорость реакции увеличивается: реакция сама по себе поставляет катализатор.
|
|
|
Растворы оксалатов рекомендуется хранить в темных склянках. Подкисленные растворы оксалатов более устойчивы, чем нейтральные или щелочные.
ИНДИКАТОРЫ
В титриметрических окислительно-восстановительных методах используют индикаторы двух типов. Индикаторы первого типа образуют окрашенные соединения с определяемым веществом или титрантом.
Индикаторами второго типа являются так называемые окислительно-восстановительные или редокс-индикаторы. Эти вещества изменяют свою окраску при изменении потенциала системы.
Правило выбора индикатора
В редоксиметрии индикатор выбирают таким образом, чтобы Ox - Red потенциал, при котором индикатор наиболее резко меняет свою окраску, должен быть как можно ближе к Ox - Red потенциалу в точке эквивалентности данного процесса.
В перманганатометрии часто обходятся без применения специального индикатора, так как сам перманганат имеет интенсивную окраску, которая меняется в результате ОВР и среды реакции, а поэтому избыточная капля реагента легко обнаруживается по собственной окраске. Титрование раствора до бледно-розового окрашивания, не исчезающего в течение 30 с, - обычный способ фиксирования точки эквивалентности в перманганатометрии. При титровании разбавленными растворами применяют редокс-индикаторы, такие, как дифениламинсульфокислота или ферроин (координационное соединение Fe (II) с 1,10 – фенантролином).
|
|
|
Практическое применение
Практическое применение весьма многообразно. Перманганатометрически определяют восстановители – методом прямого титрования, окислители – методом обратного титрования и некоторые вещества, не обладающие окислительно-восстановительными свойствами, - титрованием по замещению.
Подтема 3. ИОДОМЕТРИЯ
Основу иодометрических методов составляет полуреакция:
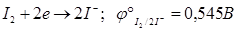 .
.
В титриметрических методах используют и окислительные свойства иода и восстановительные свойства иодида. Методы основанные на прямом окислении веществ, иногда называют иодиметрическими, а методы, в которых окисляется иодид с последующим титрованием выделившегося иода, - иодометрическими. Однако эта терминология соблюдается не строго.
Иод, выделившийся в результате окисления иодид-иона титруют обычно раствором тиосульфата натрия:
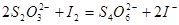
Эта реакция является наиболее важной в иодометрии (см.опорный конспект 2 с. 178 ).
|
|
|
Рабочие растворы
Растворимость иода в воде невелика (около 0,2 г/л или примерно 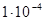 моль/л), поэтому его титрованные растворы готовят растворением точной навески свободного иода в концентрированном раствора KI. В растворе при этом образуется комплексный ион
моль/л), поэтому его титрованные растворы готовят растворением точной навески свободного иода в концентрированном раствора KI. В растворе при этом образуется комплексный ион  , что существенно увеличивает растворимость иода, не сказываясь практически на величине стандартного потенциала этой редокс-системы. Иногда титр раствора иода устанавливают по
, что существенно увеличивает растворимость иода, не сказываясь практически на величине стандартного потенциала этой редокс-системы. Иногда титр раствора иода устанавливают по 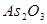 , хотя иод даже в растворе KI обладает заметной летучестью, при правильном хранении в склянках с притертой пробкой убыли концентрации иода практически не происходит.
, хотя иод даже в растворе KI обладает заметной летучестью, при правильном хранении в склянках с притертой пробкой убыли концентрации иода практически не происходит.
Титр раствора иода при хранении может даже возрастать за счет окисления иодида растворенным в воде кислородом.
В нейтральном растворе окисление происходит очень медленно. В кислом растворе, на свету и при нагревании, а также в присутствии тяжелых металлов процесс ускоряется, поэтому необходимо соблюдать соответствующие меры предосторожности при хранении (раствор необходимо хранить в темной склянке в прохладном месте). Титр раствора иода рекомендуется контролировать по реакции с тиосульфатом или арсенитом каждые несколько дней.
Рабочие растворы тиосульфата натрия готовят из перекристаллизованного препарата 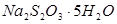 с последующим установлением точной концентрации по иоду, дихромату, металлической меди или другому веществу.
с последующим установлением точной концентрации по иоду, дихромату, металлической меди или другому веществу.
Титр разбавленных растворов тиосульфата рекомендуется проверять еженедельно. Если раствор помутнел, его выливают, так как выпадение серы свидетельствует о существенном и прогрессирующем разложении тиосульфата.
Индикаторы
Собственная желтая (до янтарно-коричневой) окраска иода в растворе достаточно интенсивная и при титровании бесцветных растворов позволяет обходиться без индикатора. В 100,0 мл раствора одна капля 0,1 М иода вызывает уже достаточно заметную на глаз желтую окраску. При титровании разбавленных или окрашенных растворов в качестве индикатора используют соединение иода с крахмалом, окрашивающее растворы в интенсивно синий цвет. Чувствительность реакции очень высока и позволяет фиксировать концентрации иода на порядок меньше, чем по собственной окраске иода. С повышением температуры чувствительность реакции уменьшается.
Растворы крахмала разрушаются при хранении в течение нескольких дней под действием бактерий. К анализируемому раствору, содержащему иод, крахмал добавляют в конце титрования, когда раствор приобретает слабую соломенно-желтую окраску, так как большие концентрации иода разрушают крахмал.
Интенсивную синюю окраску с иодом наряду с крахмалом дают многие соединения в состоянии коллоидного раствора: ацетаты некоторых редкоземельных элементов, кумарин, флавон, а-нафтафлавон, вариамин синий, иодид трифенилметиларсония и другие вещества. Иногда эти индикаторы более резко показывают конечную точку титрования, однако высокая чувствительность и другие достоинства иодкрахмальной реакции делают ее наиболее применяемой.
Дата добавления: 2018-09-22; просмотров: 321; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
