Урок 46. Типы химических реакций.
№ 45.
| На 3. Ураваняйте химическое уравнение, укажите тип реакции, напишите названия веществ. А)AlCl3+ NaOH→Al(OH)3+NaCl Б)KMnO4→K2MnO4 + MnO2 +O2 В)N2O5+H2O→HNO3 Г)НgCl2 + Fe→FeCl2+Hg |
| На 4. Закончите уравнения химической реакции, укажите тип реакции, напишите названия веществ. А) Cu(OH)2→ Б) Cl2+H2→ В)Fe2O3 +Mg→ Г) FeS+ HCl→ |
| На 5. |
| Закончите уравнения химической реакции, укажите тип реакции, напишите названия веществ. А) Карбонат кальция→ Б) оксид углерода (IV)+вода→ В)алюминий + оксид меди (II)→ Г)азотная кислота+ гидроксид алюминия→ |
Урок 47 -48 . Реакции ионного обмена.
№ 46.
На 3.
Уравняйте и запишите в ионном виде уравнение реакции
1.FeCl3+NaOH→Fe(OH)3+NaCl
2.K2SO4+BaCl2→KCl+BaSO4
На 4. Закончите и напишите уравнение реакции в ионном виде
1.Ba(NO3)2+Na2SO4→
2.FeCl2+NaOH→
На 5. Закончите уравнение реакции и запишите в ионном виде.
1. Хлорид бария+ серная кислота=
2. Сульфат железа ( III )+ гидроксид натрия
№ 47.
Подберите вещества, взаимодействие между которыми в водных растворах выражается следующими сокращенными ионными уравнениями:
а. SO32- + 2H+→H2O + SO2↑
б. Pb2++2OH-→Pb(OH)2↓
в. S2- +2H+→H2S↑
г. Ca 2+ +SO4 2-→CaSO4↓
Урок 49-50 . Реакции ионного обмена. Практическая работа.
№ 48. «Реакции ионного обмена».
Тема: Теория электролитической диссоциации (ТЭД).
Цель: Осуществить реакции ионного обмена
Оборудование и реактивы: запишите самостоятельно.
|
|
|
На 3. Описание опытов и наблюдений.
На 4. Записать уравнения химических реакций и наблюдения изменений. Написать название полученных веществ и указать тип реакции.
На 5. Записать уравнения химических реакций и наблюдения изменений. Написать название полученных веществ и указать тип реакции. 2 любых уравнения записать в ионном виде.
Ход работы.
| Что делаю? | Что наблюдаю? |
| Опыт 1. Проводим в капельнице. Хлорид бария (3к)+ соляная кислота (3к)→ Опыт № 2 . Проводим в капельнице. Гидроксид натрия (3к)+ сульфат меди (3к)→ Опыт № 3. Проводим в капельнице. Хлорид железа (III)(3к)+ Гидроксид натрия (3к)→ Опыт № 4. Проводим в капельнице. Карбонат натрия (3к) + соляная кислота (3к)→ Опыт № 5. Проводим в пробирке. Гидроксид меди + соляная кислота (0,5мл)→ |
Вывод: осуществили реакции ионного обмена:
в реакции (укажите номер реакции)…. выпал осадок
в реакции (укажите номер реакции)…. ……появился газ
в реакции (укажите номер реакции)…. ….растворился осадок
Урок 51 . Тепловой эффект реакции.
№ 49.
1. В результате реакции, термохимическое уравнение которой

выделилось 1479 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). Ответ округлите до целых.
|
|
|
2. В результате реакции, термохимическое уравнение которой
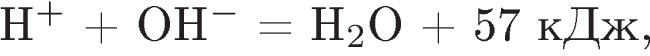
выделилось 171 кДж теплоты. Вычислите массу гидроксида натрия, который был нейтрализован соляной кислотой. Ответ укажите в граммах с точностью до целых.
3. Составьте, термохимическое уравнение гидратации окисда серы (VI), если при этом образовалось 294 г серной кислоты и выделилось 264 кДж теплоты.
4. Составьте, термохимическое уравнение сгорания водорода, если при этом затартилось 5,6 л кислорода и выделилось 121 кДж теплоты.
Урок 52-53 . Скорость химической реакции.
№ 50.
Дата добавления: 2018-09-20; просмотров: 373; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
