Скорость ферментативных реакций
Ферменты являются очень эффективными катализаторами, ускоряющими процессы в тысячи и миллионы раз лучше по сравнению с неорганическими катализаторами. И хотя существует огромное множество ферментативных процессов с различными механизмами, есть упрощённая схема, которая работает в большом количестве случаев:
E + S = ES = E + P, где
E – фермент, S – субстрат, ES– фермнент-субстратный комплекс и P–продукт. Первая стадия обратима, а вторая нет, и к тому же является лимитирующей. Данный подход разработан французским биохимиком Виктором Анри (Victor Henri).
Можно проследить зависимость ферментативной реакции от концентрации фермента. Зависимость будет прямой, т.к. обычно концентрация субстрата много больше концентрации фермента, а количество последнего весьма ограничено.

А вот зависимость скорости ферментативной реакции от концентрации субстрата сложнее за счёт того, что субстрата в какой-то момент времени становится слишком много, то есть он занимает все активные центры фермента. Этому положению соответствует горизонтальная прямая на графике.

Получим зависимость, используя формулы химической кинетики, где k1-константа скорости первой прямой реакции, k2-константа скорости второй прямой реакции и k3-константа скорости первой обратной реакции.
1. Vобразования SE = k1 *[S]*[E]
2. Vрасходования SE = k2*[ES] + k3*[ES], т.к он расходуется в «обе стороны»
3. Приравниваем эти скорости по определению стационарного состояния
|
|
|
K1*[S]*[E] = k2*[SE] + k3*[ES] = [ES]*(k2 + k3)
[S]*[E]*k2 + k3 = Km – константа Михаэлиса
[ES] k1
[S]*[E] = [ES]*Km (1)
Итого: Кm = (k2 + k3)/k1 (2)
1. Из материального баланса [E0] = [E] + [ES] находим концентрацию Е и подставляем в (1)
[E] = [E0] – [ES]
[S] *([E0] – [ES]) = [ES]*Km разделимна [S] и [ES]
[E0]/[ES] = ([S] +Km)/[S] (3)
2. Скорость процесса определяется скоростью лимитирующей стадии
V = k3*[ES]. Учитывая, что при насыщающих концентрациях S, весь Е0 перейдет в ES, и скорость примет максимальное значение (стационарная фаза):
Vmax = k2*[E0]. Найдем отношение Е0/Es = Vmax/V. Подставим это выражение в (3):
Vmax/V = ([S] + Km)/[S]
3. Получаем зависимость скорости ферментативной реакции от концентрации субстрата:
V = Vmax*[S]/([S] + Km) = Vmax/ 1 + Km/[S]
Это уравнение называется уравнением Михаэлиса-Ментен в честь немецкого биохимика Михаэлиса и канадского биохимика Ментен. Присутствующая в нём константа Михаэлиса численно равна такой концентрации субстрата, при которой скорость реакции в два раза меньше максимальной. При этом значение константы Михаэлиса зависит от разнообразных условий.
Подобные уравнения можно вывести для нескольких субстратов, но они будут намного сложнее.
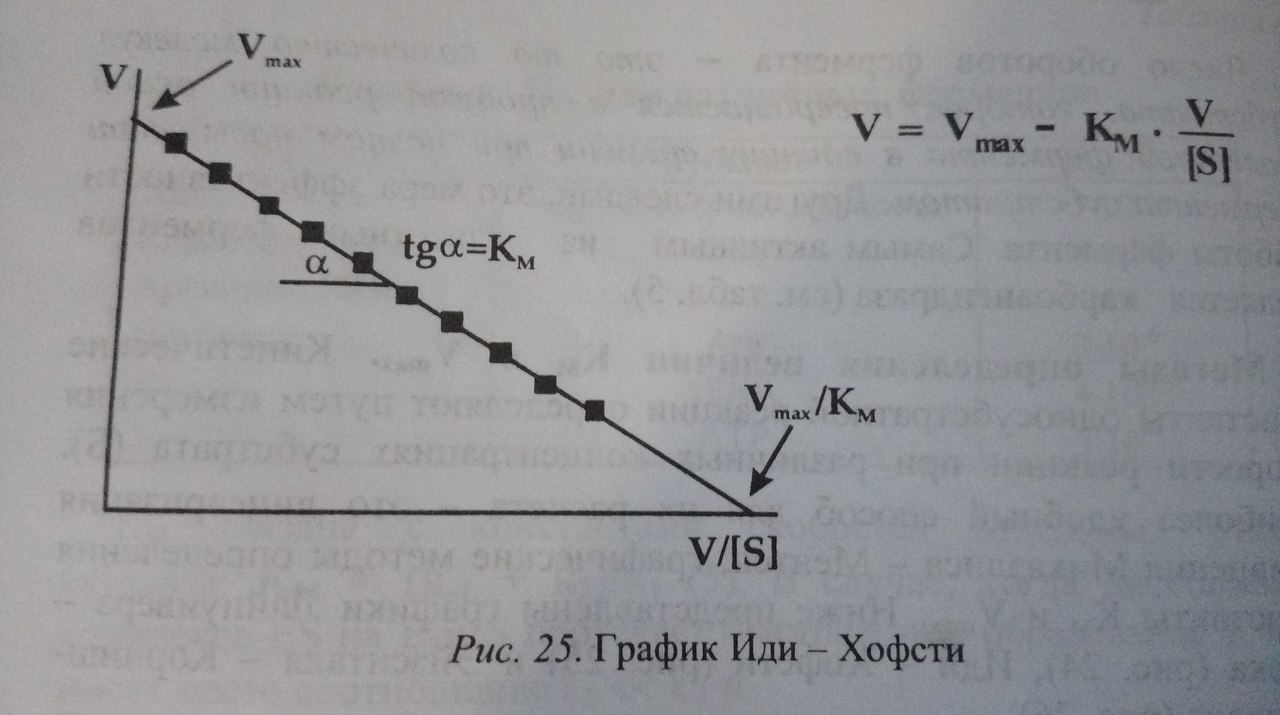
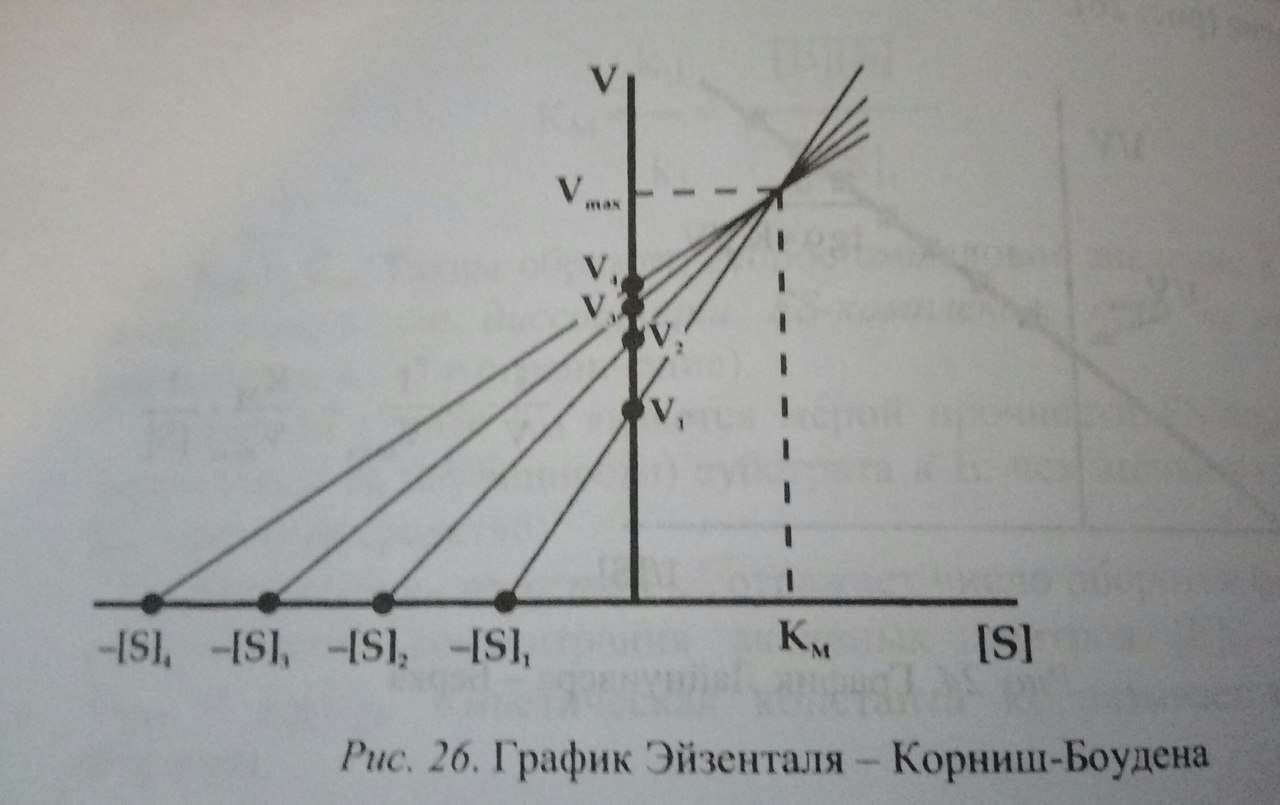
Существует три альтернативных способа графического представления зависимости скорости ферментативной реакции от концентрации субстрата. Например, на графике Иди-Хофсти константа Михаэлиса равна тангенсу угла наклона прямой.
|
|
|

Дата добавления: 2018-08-06; просмотров: 616; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
