Кинетика ферментативных реакций
Строение ферментов
Специфика реакций, протекающих в живых организмах, состоит в том, что их ускоряют и направляют в нужное русло очень эффективные и специфичные катализаторы - ферменты. Ферменты обеспечивают очень быстрое и эффективное протекание биохимических процессов.
В простейшем случае ферменты представляют собой молекулы РНК. Такие ферменты называются рибозимами. Также РНК может выполнять функцию хранения генетического материала, что делает эти молекулы вообще очень функциональными. Но эволюция шла, и молекулы РНК почти полностью передали функцию катализа белковым ферментам - энзимам. Белковые молекулы имеют более сложную структуру, что делает их намного более эффективными, чем РНКовые молекулы. Далее все процессы мы будем рассматривать на примере действия энзимов.
Любой энзим состоит из множества остатков аминокислот (как правило, нескольких сотен), но непосредственно с субстратом (реагентами) взаимодействует только несколько. В связи с этим выделяют адсорбционный центр – участок фермента, связывающий субстрат и каталитический центр – участок фермента, непосредственно участвующий в катализе. Совокупность всех таких центров называется активным центром фермента. Остальная часть молекулы придаёт активному центру нужную форму. При этом молекула фермента окончательно приобретает некую конформацию только во время взаимодействия с субстратом, что называют индуцированным взаимодействием. Данный вопрос был изучен американским биохимиком ДэниэломКошландом (DanielKoshland).
Кофакторы - небелковые части энзимов, помогающие последним осуществлять свои функции. Кофакторы могут быть различными неорганическими ионами, или органическими «простетическими группами». Остальная – белковая – часть фермента называется апоферментом. Кофактор + апофермент также называются холоферментом. Коферменты – очень распространённые субстраты, участвующие во множестве различных превращений.

На рисунке представлена молекула лизоцима, расщепляющая молекулу углевода клеточной стенки бактерий в ротовой полости.
Как и все катализаторы, ферменты не смещают равновесие реакции, а ускоряют и прямую, и обратную.
Механизм действия ферментов
Ферментативный катализ начинается с индуцированного взаимодействия фермента с субстратом, при котором субстрат встраивается в активный центр фермента. При этом остатки аминокислот активного центра так электростатически взаимодействуют с субстратом, что ослабляют в нём связь, по которой идёт разрыв.

На рисунке представлен механизм гидролиза ацетилхолина до холина и уксусной кислоты. Данный процесс активно протекает в мышечной ткани при расслаблении.
Многие ферменты в качестве кофакторов содержат атомы металлов, которые несут некоторый положительный заряд. Таким образом, эти частицы взаимодействуют с электроотрицательными атомами в составе субстрата. Кроме того многие ферменты вступают в дополнительное взаимодействие с АТФ (аденозинтрифосфорной кислотой), гидролиз которой на специальном участке фермента делает возможным протекание той или иной реакции за счёт выхода энергии. Это соединение относится к коферментам. Также коферментами являются, например, переносчики атомов водорода в реакциях гидрирования/дегидрирования.
На рисунке представлен механизм действия карбоксипептидазы А, катализирующей гидролиз пептидной связи. При этом атом цинка, несущий положительный заряд, взаимодействует с отрицательнозаряженным атомом кислорода карбонильной группы, что в конечном счёте приводит к поляризации связи –С—N-, по которой и происходит разрыв.

Одним из распространённых кофакторов в живых организмах является гем В – простетическая группа, с коорденированным атомом железа в центре. Его особенностью является многофункциональность. В составе молекул гемоглобина и миоглобина он не проявляет каталитическую активность, являясь переносчиком кислорода в крови или мышцах. В составе молекулы пероксидазы он катализирует окислительно-восстановительные реакции с перекисью водорода. Таким образом апофермент способствует выполнению кофактором какой-то одной из его многочисленных функций. Это и есть ещё один фундаментальный вывод о природе жизни, который мы обещали сделать в предыдущей главе: биологические молекулы специализируют небиологические под свои «прихоти».
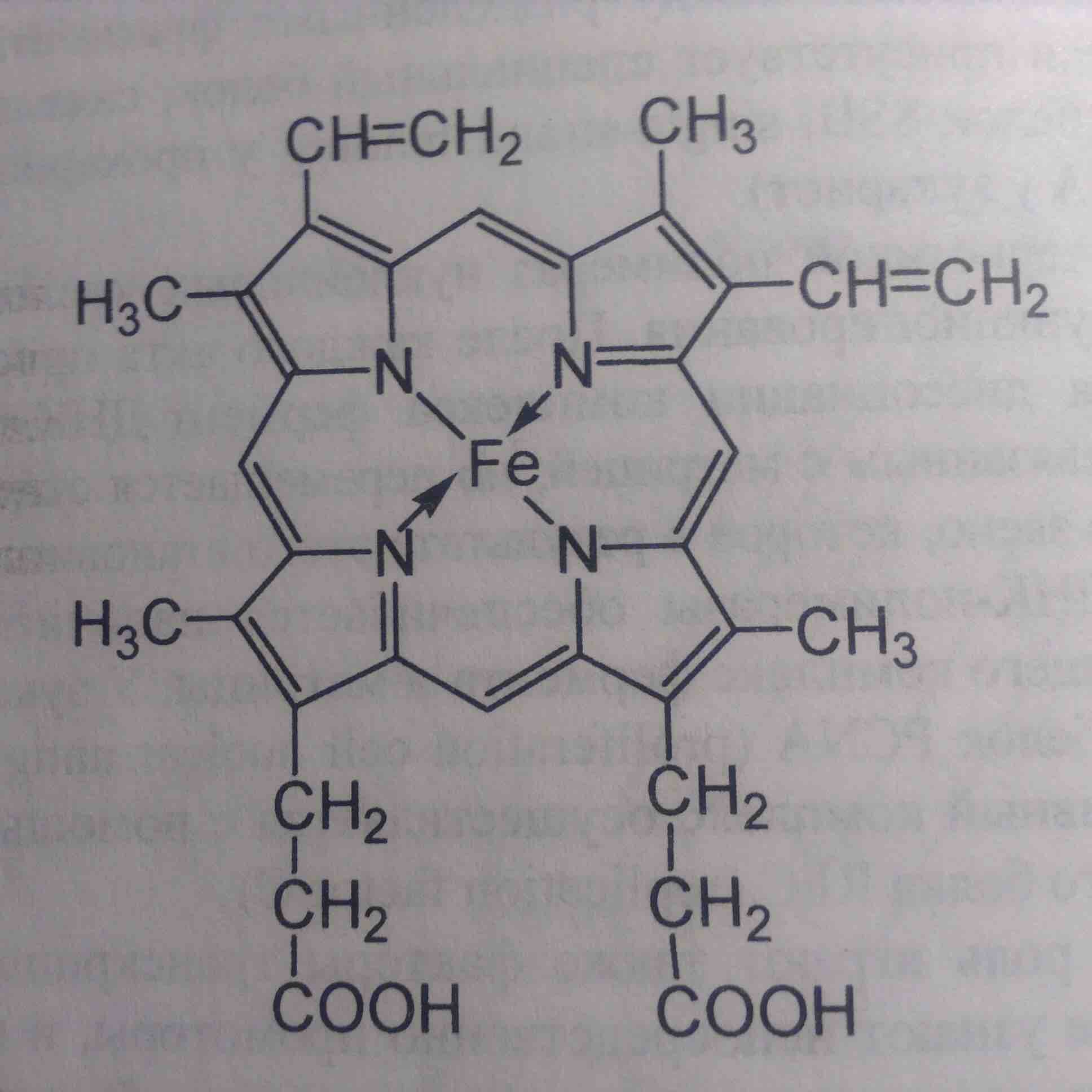
Гем В
Дата добавления: 2018-08-06; просмотров: 531; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
