Свободная энергия и равновесие
Мы имеем представление о тепловом эффекте реакций. Также по второму закону термодинамики мы знаем, что вещества будут претерпевать такие превращения, которые приведут их в состояние с наибольшей энтропией. Для химических превращений оказалось целесообразно ввести физическую величину - свободную энергию. Для изобарного (постоянное давление) процесса вводят свободную энергию Гиббса (dG0), а для изохорного (постоянный объём) свободную энергию Гельмгольца (dA0), причём
dG0 = dH - T*dS
dG0 = dU - T*dS,
где dU - изменению внутренней энергии.
Нам далее будет удобно пользоваться свободной энергией Гиббса. Разберёмся с ней подробнее. Мы знаем, что идти будет такая химическая реакция, которая приведёт к общему увеличению энтропии. Поскольку считать общее изменение энтропии напрямую очень сложно, химики пользуются формулой Клаузиуса (dS=Q/T) для изотермического процесса. Химические же реакции почти всегда идут с выделением или поглощением тепла, что также изменяет энтропию. Чтобы разрешить эту трудность и существует понятие свободной энергии. Свободная энергия Гиббса включает в себя как чисто энтропийный фактор (T*dS), так и изменение энтропии за счёт изменения температуры (dH). Не верите, что так вообще можно? Попробуем применить формулу для реакции водорода с кислородом.Знак изменения энтропии (dS) определяется состояниями веществ без учёта теплового эффекта. Например, dS для реакции 2H2 + O2 = 2H2O будет отрицательным, т.к. объём, занимаемый веществами, уменьшается. А вот выделяющаяся энергия (отрицательное изменение энтальпии) увеличивает энтропию системы. Тут также подходит аналогия с мячом, который падает на землю и выделяет энергию, которая уже вряд ли снова соберётся и "случайно" вытолкнет его с земли назад. Получается, что в данном случае, пойдёт ли реакция, определяется температурой, при которой идёт процесс. А точнее реакция будет идти при любой температуре до тех пор, пока она не станет слишком большой. Подставим в наше уравнение конкретные табличные значения (для получения газообразной воды):
dG0 = -286000Дж/моль - (-188Дж/(моль*К)*T
Теперь всё видно.
Также понимать это можно так: свободная энергия – это вся энергия, доступная для совершения работы. В ней теплота и упорядоченность уже учтены.
Но что именно мы получили? Абсолютное условие протекания химической реакции? Нет, нельзя забывать о равновесии. По факту у нас идут различные химические превращения, как в одну сторону, так и в другую. И если реакция горения водорода почти необратима при стандартных условиях, многие реакции явно обратимы. Например, разложение N2O4. В реакционной смеси явно присутствуют как продукты, так и реагенты.
N2O4=2NO2
Допустим, при какой-то температуре у нас отрицательное значение свободной энергии будет соответствовать прямой реакции. Тогда идти должна она, а не обратная. В то же время в сосуде, где первоначально были только молекулы NO2, появятся и молекулы N2O4, причём ровно в равновесных соотношениях. То есть обратная реакция тоже идёт, несмотря на положительное значение свободной энергии. Чтобы понять истинную суть свободной энергии, нам следует количественно охарактеризовать равновесие. Для этой цели существует специальная физическая величина – константа равновесия (К), численно равная отношению произведений концентраций продуктов в степенях их коэффициентов, делить на отношение концентраций реагентов в степенях их коэффициентов. Например, для реакции А + В = 2С,
К = [C]2/[A][B], где в квадратных скобочках указаны молярные концентрации соответствующих веществ [моль/л].В дальнейшем отношение концентраций в правой части в общем случае будем записывать, как p/q.
Константа равновесия зависит от температуры (как и свободная энергия), а также немного от давления, чем мы обычно пренебрегаем.
Мы научимся пользоваться константой в полной мере позже, а пока что укажем зависимость свободной энергии от положения реакции относительно равновесия. Свободная энергия Гиббса, которую мы обсуждали до этого, является стандартной табличной величиной и по сути своей означает, сколько энергии свободной выделится, если реакция пройдёт до конца. На практике мы такого не наблюдаем, реакция идёт не до конца, а до равновесия. Введём вторую свободную энергию Гиббса – не стандартную (dG). Она будет показывать положение равновесия относительно тех концентраций, которые мы по факту имеем.
На рисунке видна зависимость между стандартной свободной энергией и свободной энергией в данный момент времени. ln(p/q) будет равен 0, если все концентрации равны 1 (логарифм равен 0, если подлогарифмическое выражение равно 1). В этот момент времени свободная энергия равна стандартной свободной энергии. То есть стандартную свободную энергию можно также определить, как свободную энергию в момент времени, когда концентрации всех продуктов и реагентов равны 1. Отношение p/qравно константе равновесия в момент равновесия. В этот момент свободная энергия Гиббса равно 0 и реакция останавливается. На самом деле реакция продолжает течь в обе стороны, но с одинаковыми скоростями – наступает динамическое равновесие.
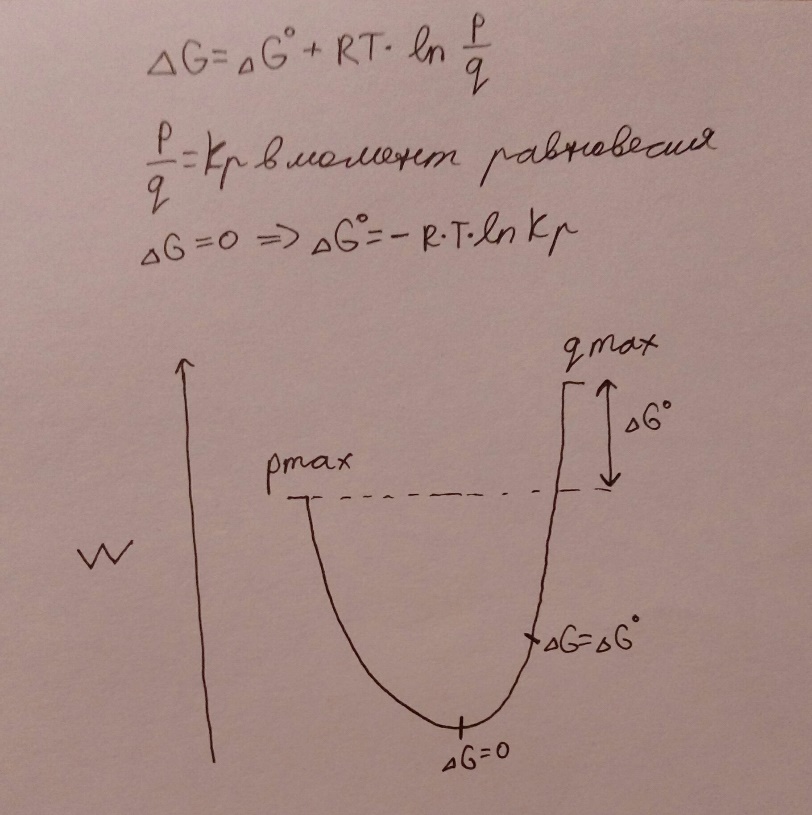
Таким образом, истинное направление протекания химической реакции указывает свободная энергия (dG). Если она отрицательна, идёт прямая реакция. Если положительна, то обратная. Куда бы реакция ни шла, свободная энергия по модулю будет уменьшаться, в положении равновесия достигая 0. Из формулы также видно, что при бесконечной концентрации реагентов (q), второе слагаемое стремится к минус бесконечности, то есть свободная энергия также стремится к минус бесконечности. Это значит, что пойдёт прямая реакция, т.к. при отрицательной свободной энергии идёт прямая реакция. Это вполне логично: если у нас в смеси только реагенты, то образовываться будут продукты. Если есть только q, образовываться будет p. В противоположном случае свободная энергия максимальна, и реакция идёт обратная. В дальнейшем для сравнения энергетических эффектов реакций мы будем иметь дело только со стандартным значением свободной энергии, т.к. оно точно даёт ответ на вопрос: сколько энергии выделится, если прореагирует сколько-томоль вещества. Нестандартное же значение показывает, сколько энергии выделится, если реакция дойдёт до состояния равновесия.
Интересной операцией над химическим равновесием является его смещение. Подобное действие можно производить согласно принципу Ле-Шателье-Брауна. Суть его в следующем: если прямая реакция протекает с увеличением давления, то, чтобы её "усилить", давление надо уменьшить. И наоборот. То бишь система стремится скомпенсировать наше влияние. Как бы ни менялись условия, она всё равно возвращается на путь наибольшей энтропии. Допустим, в какой-то реакции образуется больше газов по объёму, чем было изначально. Чтобы уменьшить их количество мы уменьшим объём, что повысит их концентрацию и облегчит им взаимодействие с образованием менее объёмного продукта (из которого они получились). Также можно, например, уменьшать концентрацию продуктов, что будет "стимулировать" их образование. Так же и с температурой. Если реакция экзотермическая, чтобы стимулировать её, надо уменьшить температуру. Если температуру увеличить, скорее пойдёт обратная ей эндотермическая реакция. Это следствие того, что эндотермические продукты требуют для своего образования больше тепла (подумайте самостоятельно).
Глава 5
Тепло порождает жизнь
Диссипативные структуры
Здесь хочется окинуть взглядом пройденный нами путь. Начали мы с простого, казалось бы, вопроса: как вода поднимается вверх по растению против силы тяжести? Вопрос может казаться биологическим, но, чтобы на него ответить, пришлось вникать в движение отдельных частиц. Описывая их движение, мы знакомились с физическими законами и логически выводили какие-то следствия. Мы научились описывать поведение огромного числа частиц с помощью статистических соображений. Мы обсудили физику и химию в контексте термодинамики… или термодинамику в контексте физики и химии.Теперь мы вернёмся к биологическим объектам.
Живые организмы – самые сложные объекты во вселенной. Они намного сложнее самых больших и величественных космических тел. Эта невероятная сложность долгое время казалась людям непреодолимым препятствием для сил природы. До сих пор (2018 год) нет убедительной всеобъемлющей теории происхождения жизни. Но это вовсе не значит, что это невозможно. Развитие классической термодинамики в двадцатом веке вышло на такой уровень, что теперь мы можем указать принципы, по которым жизнь не просто функционирует сейчас, но и появилась 4 миллиарда лет назад. Дальнейшие поиски в любом случае должны вестись в области, отграниченной нашими началами (которых у нас пять). Нобелевский лауреат 1977 года - Илья Пригожин - описывал в своей нобелевской лекции такой пример создания сложной структуры из простой. Если мы возьмём сосуд с водой и будем нагревать его снизу, в воде возникнут конвекционные ячейки (Рэлея-Бенара). Вода, нагреваясь, будет подниматься наверх, охлаждаться и опускаться вниз, постоянно таким образом перемешиваясь.
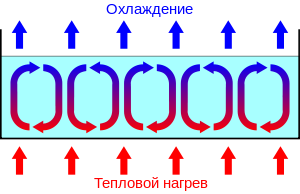
Если бы вода была полностью однородной, никакой структуры в виде конвекционных ячеек там бы образоваться не могло. Но вода – это совокупность хаотически движущихся частиц, то есть на маленьком масштабе она не однородна. В ней существуют так называемые микроскопические флуктуации. Опыт с созданием конвекционных ячеек показывает, что при подводе энергии извне, микроскопические молекулярные флуктуации могут вырастать до больших размеров, образуя макроскопическую структуру (в данном случае, конвекционных ячеек). Такие структуры, существующие при подводе энергии извне, называются диссипативными.
Жизнь – это макроскопическая структура. Экстраполируя рассуждения Пригожина, мы получаем интересный вывод: жизнь возникла из микроскопических флуктуаций при подводе энергии извне. Представим себе Землю 4 миллиарда лет назад. В вулканических лужах плавают различные органические вещества. Подводя к ним энергию (энергию земных недр через вулканическую активность или энергию ультрафиолетового излучения, которого тогда было на Земле намного больше), мы из микроскопических молекулярных флуктуаций получаем всё большие по масштабам и всё более упорядоченные структуры, и в конечном счёте живые организмы. Сейчас усилия учёных направлены на выяснение подробностей этого процесса: где, когда и как произошло появление жизни на данный момент известно очень смутно. Но одно предельно ясно – жизнь образовалась аналогично конвекционной ячейке.
Нам кажется целесообразным остановиться на этом моменте подробнее в связи с актуальностью его для современной науки. Как только учёные приняли возможность зарождения живой материи из неживой, они столкнулись со следующими вопросами, без ответов на которые нельзя было продвигаться дальше. Во-первых, что является основным компонентом живой материи, что делает неживое живым. Во-вторых, где именно произошло зарождение жизни. В-третьих, когда оно произошло, и какие условия существовали тогда на Земле: температура, вулканическая активность, состав атмосферы, состав литосферы, состав воды, интенсивность солнечного излучения и т.д. С первых попыток воссоздать в лаборатории условия древней земли и синтезировать из неорганических веществ сложные органические прошло много времени. Благодаря успехам в биологии, химии и геологии на настоящий момент мы знаем о многих достаточно достоверных этапах создания жизни. Произошло это около 4 миллиардов лет назад, когда на землю попадало интенсивное солнечное излучение, а в воде было растворено много органических соединений. Но это было ясно с самого начала. Предполагалось, что произошло это в океане, но откуда взять столько органики, чтобы наполнить весь океан? Арену боевых действий переместили в небольшую лужу. Многие бактерии сейчас получают энергию за счёт неорганических реакций, которые они проводят в сильно загрязнённых различными солями мелких водоёмах. Отлично. Чтобы получить больше энергии (система у нас диссипативная), а заодно обеспечить постоянный приток веществ, к этому можно добавить вулканическую активность. Интересным выводом термодинамической кинетики (с которой мы познакомимся позже) является возможность автокаталитических систем эволюционировать. Эта химическая эволюция при должных условиях может перерасти в биологическую. Мы знаем много, но насколько много? Человечеству до сих пор не удалось создать живое из неживого при всём развитии техники, так что какой-то ингредиент постоянно упускается. Сейчас мы можем только говорить, что термодинамически появление жизни разрешено. Как это случилось? Мы знаем об этом пока что очень мало.
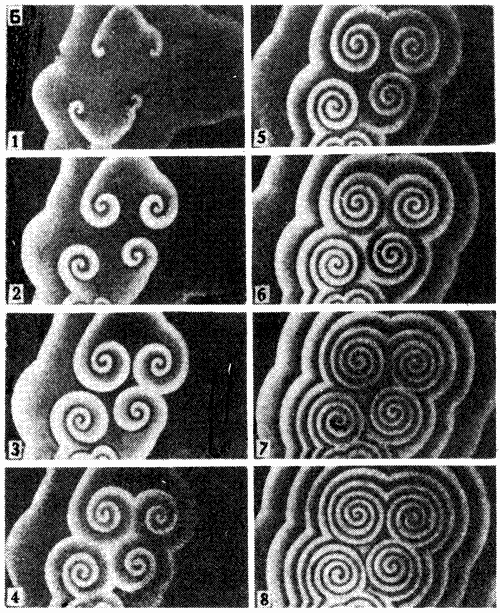
Существует особый тип химических реакций: например, реакция Белоусова-Жаботинского, в которых концентрации некоторых реагентов и продуктов колеблются с определённой частотой. Сначала в сосуде много одного вещества, потом другого, потом снова первого и т.д. Возрастание концентрации одного вещества с запозданием вызывает увеличение концентрации другого, в то время как концентрация первого падает. Это можно сравнить с работой обыкновенного маятника: постепенно колебания будут затухать, если мы не будем подводить энергию. Пример пространственных изменений в одной из таких реакций изображён на рисунке.
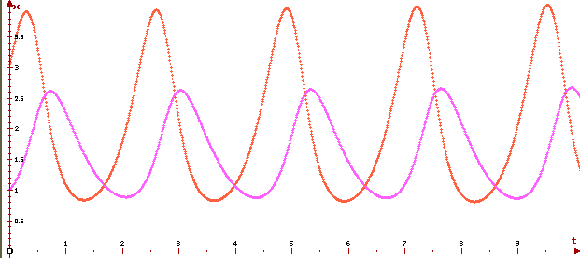
Изучая данный вопрос, Пригожин нарисовал следующий график

Который удивительным образом похож на график «хищник-жертва» в популяционной экологии. Допустим, у нас произошло увеличение числа хищников. Тогда жертв стали есть больше, и их численность упала, но с некоторым запозданием. Хищники стали голодать и их численность также упала, но это позволило увеличиться числу жертв. Это, в свою очередь, с некоторой задержкой вызовет увеличение численности хищников, и всё начнётся сначала. Такие колебания происходят в природе постоянно. Задержки возникают, потому что в случае химической реакции любая реакция имеет определённую скорость протекания, а в случае хищников и жертв те имеют определённые скорости размножения. Механизм колебаний численности организмов действительно очень похож на механизм реакции Белоусова-Жаботинского, вот и описываются они сходным образом.
И пусть вас не удивляет, что конвекционные ячейки и зарождение жизни, химические реакции и колебания численности особей в популяции описываются одинаковым образом. Мы уже убедились, что термодинамические законы работают на совершенно различных уровнях организации материи. Ведь, как мы обсуждали ранее, главным условием применимости термодинамики как науки об описании хаотического поведения многих частиц является наличие этого самого большого количества хаотически движущихся частиц. В контексте химической реакции частицами являются молекулы и ионы, а в контексте экологии животные-хищники и животные-жертвы. Но разве термодинамика не должна описывать превращения энергии? Должна, и она это делает. Хищник в контексте термодинамики выполняет роль того, кто забирает энергию у жертвы, чтобы поддерживать свою жизнедеятельность. Чтобы доказать, что указанная система является диссипативной, нужно лишь заметить, что хищники и жертвы получают всю свою энергию от других животных или растений, которые в конечном счёте берут её от Солнца. Уберите подвод энергии – лишите животных питания – и они вымрут. Макроскопическая структура исчезнет, заменяясь безжизненным хаосом с микроскопическими флуктуациями.
Величайшая тепловая машина
Предыдущий раздел мы закончили рассуждениями на тему того, как в живых системах ведёт себя энергия. Но чтобы понять фундаментальную природу жизни, нам следует отвлечься от примера с хищниками и жертвами, и перейти к рассмотрению всей биосферы в общем.
Биосфера – оболочка Земли, состоящая из живых организмов и среды, с которой они взаимодействуют. В качестве компонентов включает в себя литосферу, гидросферу и атмосферу. Учение о биосфере разработал советский учёный – Вернадский. Именно она станет сейчас объектом нашего внимания. Итак, у нас есть звезда Солнце и планета Земля. Без Солнца поверхность Земли давно бы уже остыла, и ни о какой жизни речи бы не шло. Вспомним, что жизнь – диссипативная структура, для её поддержания нужна энергия. Энергия поступает от Солнца в виде фотонов. Фотоны – новый для наших рассуждений тип частиц, но жизненно для нас необходимый. И дело не только в зрении. Для начала коротко рассмотрим физику явления. Если описывать фотон как волну, у нас получится следующая картина, представленная на рисунке. Слева на право увеличивается длина волны и падает её энергия. Самыми энергетическими и маленькими являются гамма-фотоны, а самыми большими и низкоэнергетическими радиоволны. Классификация проводится по тому, с помощью какого прибора можно зарегистрировать данную часть спектра. Например, человеческий глаз регистрирует небольшую область, названную видимым излучением. Если переходить к привычным нам частицам, то понимать это можно так: высокоэнергетические фотоны – это маленькие частицы, а низкоэнергетические - большие.
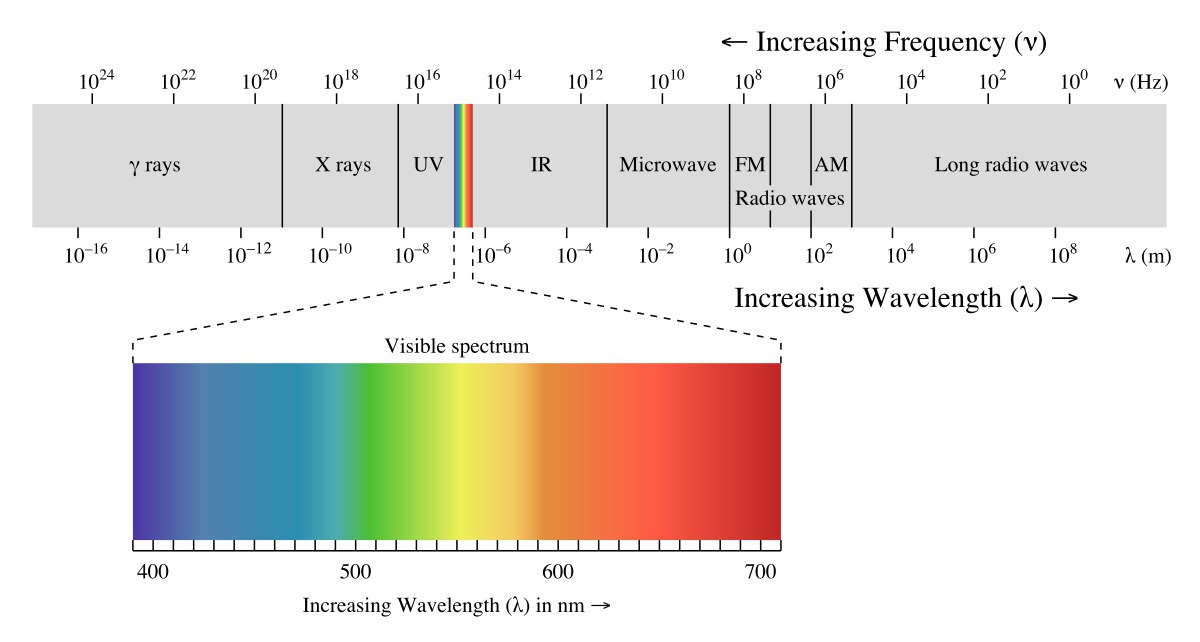
В контексте биосферы нам нужно знать о фотонах ещё две вещи. Во-первых, фотоны способны взаимодействовать с веществом, «ударяясь» об атомы, выбивая электроны и разрушая химические связи. Это лучше получается у маленьких фотонов, которые способны точно поражать цель. Во-вторых, можно заметить, что по энергии один маленький фотон соответствует нескольким большим. Причём небольшой фотон способен совершать работу (по разрушению химических связей), а несколько больших нет. Это связано как минимум с тем, что большие фотоны разлетаются в разные стороны и маловероятно их соединение для совершения работы… Да, рассуждения здесь аналогичны рассуждениям для частиц вещества: маленькие фотоны обладают маленькой энтропией, а большие большой. Так что на шкале сверху можно поставить стрелочку вправо и написать: увеличение энтропии.
Итак, от Солнца у нас вылетают фотоны, которые через 8 минут достигают поверхности Земли. Но прежде чем добраться до живых организмов, им нужно пройти сквозь толщу атмосферы, а это получается не у всех. На рисунке показано, фотоны какой длины поглощаются атмосферой, а какой длины пропускаются.
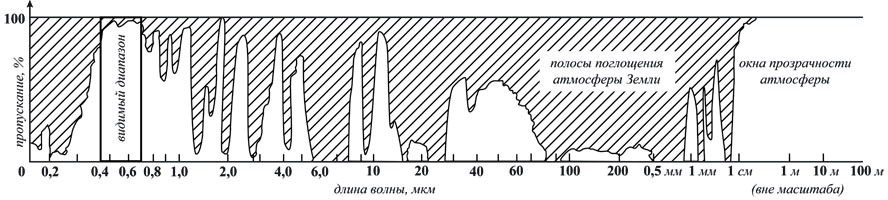
Можно заметить, что атмосфера плохопроницаема для ультрафиолетового излучения (слева от видимого диапазона), что было не так в эпоху зарождения жизни. Когда живые организмы наполнили атмосферу кислородом, кислород образовал озоновый слой, который прекратил поступление ультрафиолета в больших количествах. Это позволило живым организмам выйти на сушу. То есть сначала жизнь появилась благодаря ультрафиолету, а потом избавилась от него, что помогло её дальнейшему развитию. Это удивительный пример взаимного влияния живых и неживых компонентов планеты, общего их развития. Подобные примеры позволили создать две противостоящие гипотезы. Джеймс Лавлок выдвинул гипотезу Геи, согласно которой Земля представляет собой суперорганизм, где живые и неживые компоненты вместе поддерживают своё существование, поддерживая постоянство условий. В противовес этой гипотезе существует гипотеза Медеи Питера Уорда, согласно которой микроорганизмы постоянно пытаются уничтожить жизнь: метановое отравление 3,7 миллиардов лет назад, кислородная катастрофа 2,7 миллиарда лет назад. Видимо, эти два противостоящих процесса и обеспечивают не просто сохранение жизни, но и ещё развитие. Однозначно, этот вопрос заслуживает самого пристального внимания для понимания сущности жизни.
Вред ультрафиолета для жизни заключается в том, что он очень легко реагирует с веществом, разрушая крупные молекулы, из которых построена жизнь. Менее опасно видимое излучение, которое не способно вызывать такой разрушительный эффект, и к тому же проходит через атмосферу в огромных количествах. Именно его организмы и используют для получения энергии. И это не совпадение: наши глаза реагируют на фотоны этого диапазона как раз по той причине, что их много, и их легко уловить (как уже говорилось, они обладают достаточной энергией). Итак, фотон видимого излучения проходит сквозь атмосферу. Достаточно известным является факт, что растения синтезируют органические вещества из углекислого газа и воды – процесс фотосинтеза. Но эта реакции идёт с резким понижением энтропии. Чтобы она прошла в достаточных количествах, нужен свет, который особым образом улавливается растением и используется для компенсации энтропии. Растение называется продуцентом органических веществ. Далее растение поедается травоядными организмами (консументамиI порядка), те поедаются хищниками (консументамиII порядка). Все вместе они образуют пищевые цепи и сети, в которых на каждом этапе происходит рассеивание части энергии в виде тепла, то есть её становится всё меньше. На рисунке показано уменьшение количества энергии, переходящей по пищевой цепи. Это постепенное рассеивание энергии ограничивает длину пищевых цепочек – на каком-то этапе энергию становится слишком сложно получить. Хищников всегда меньше, чем их жертв, что в принципе весьма логично.
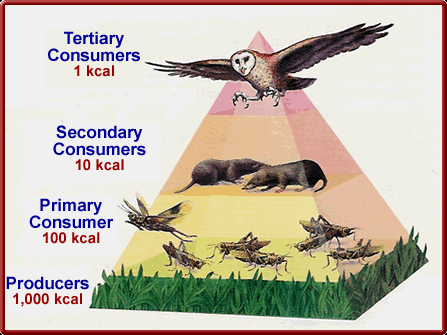
Рассеянная в виде тепла энергия может снова уходить в космос в виде инфракрасного – высокоэнтропийного, непригодного для совершения работы, излучения. Видно, что принцип устройства биосферы – это тепловая машина Карно. Солнце – нагреватель, космос – холодильник, а Земля – баллон с газом, который толкает поршень – совершает работу по созданию жизни. Вряд ли Сади Карно предполагал, что описал не просто тепловую машину, а всю биосферу.

Глава 6
Химическая кинетика
Мы научились предугадывать прохождение химической реакции, используя свободную энергию - величину, непосредственно связанную с энтропией. Увеличение энтропии будет происходить за счёт рассеивания энергии в пространстве в виде тепла. Маловероятен процесс обратной её концентрации в одном месте, т.к. частицы движутся хаотически и разносят энергию во все стороны. При всём этом, например, смесь кислорода и водорода не подаёт признаков реакции при нормальной температуре, хотя термодинамически реакция разрешена. Если же мы эту смесь нагреем, то реакция пойдёт. Не противоречит ли это нашему уравнению? Нет, так как при стандартной температуре водород тоже реагирует с кислородом, но слишком медленно, чтобы мы это заметили. Целесообразно ввести новую физическую величину - скорость реакции. А вместе с ней и новую науку - химическую кинетику - следствие химической термодинамики.
Итак, мы выяснили, что при нагревании скорость химической реакции увеличивается. Это вполне понятно, так как увеличение температуры - это увеличение скорости движения частиц. Чем быстрее частицы движутся, тем чаще сталкиваются. Очень не хочется пугать читателей, но даже здесь нужно сделать некие ограничения. Например, в реакции водорода с кислородом при увеличении температуры наступит такой момент, когда реакция вообще идти не будет. Это видно из уравнения свободной энергии. Не говоря уже о том, что само понятие химической реакции применимо только в определённом интервале температур. На самом деле температура увеличивает скорость реакции ещё и по той причине (и это как правило самое важное) что для взаимодействия частицам нужно обладать определённой кинетической энергией. Максвелл в своё время описал распеределение энергий среди частиц при определённой температуре. Понятно, что при увеличении температуры всё большее число частиц обладает большей энергией, а значит и энергией, нужной для прохождения реакции. Количественно это описывается величиной, называемой энергией активации, численно равной разности между энергией, которая нужна частицам для прохождения реакции и средней кинетической энергией частиц при данной температуре.

Скорость химической реакции (v) зависит от температуры, концентрации жидких и газообразных веществ, а также от площади поверхности твёрдых тел. При увеличении всех этих факторов, скорость реакции увеличивается, т.к. увеличивается частота столкновений частиц и в случае температуры понижается энергия активации. Зависимость скорости реакции от концентрации газообразных и жидких веществ:
v = k*CA^a*CB^b, где k, a и b - коэффициенты, а CA и CB - молярные концентрации реагентов.
Уравнение Вант-Гоффа гласит, что:
v2/v1=j^((T2-T1)/10), где v1 и v2 - скорости реакций, T1 и T2 - различные температуры, при которых реакции проходят, а j - коэффициент Вант-Гоффа, равный примерно 2-4.Присмотревшись к формуле видно, что сама по себе она означает только то, что при увеличении температуры на 10К скорость реакции увеличивается во сколько-то раз. Это количество раз и есть коэффициент Вант-Гоффа. То есть в данном случае мы допускаем, что при увеличении температуры на какое-то значение кельвинов, скорость реакции возрастает всегда в определённое количество раз (2-4),что действительно выполняется для многих реакций в определённых интервалах температур. При больших перепадах температур зависимость теряет линейный характер, коэффициент Вант-Гоффа перестаёт быть константой.
Вы можете вспомнить, как в самом начале разговоров про энтропию мы привели в пример химическое равновесие, а именно равновесие диссоциации NaCl. В тот момент, когда энергетически выгодным оказывается равно как прямой процесс, так и обратный, наступает это самое равновесие. Для его описания существует величина, названная константой равновесия, причём она численно равна произведению молярных концентраций продуктов в степенях, равным коэффициентам, делить на произведение молярных концентраций реагентов в степенях, равных их коэффициентам. В случае диссоциации NaCl это выглядит так:
K = [Na+]*[Cl-]/[NaCl]
Если посчитать изменение молярных концентраций веществ в данном равновесии и вспомнить формулу степени диссоциации, то можно получить уравнение, согласно которому
K = L^2*C/(1-L), где C - исходная молярная концентрация электролита, а L - его степень диссоциации.
Для чего мы всё это делали? В одной из первых статей на эту темы мы сказали, что степень диссоциации - ипостась энтропии. Пришло время это подтвердить, то есть используя известные нам формулы, вывести степень диссоциации через энтропию. Мы можем сделать это, используя зависимость степени диссоциации от константы равновесия, зависимость константы равновесия от изменения свободной энергии и зависимость свободной энергии от энтропии. Правда, данное уравнение будет слишком громоздким, чтобы его здесь записать.
Понятие механизма реакции
Когда мы обсуждали закон Гесса, мы уже говорили о том, что все химические реакции обладают каким-то механизмом. Частицы беспорядочно сталкиваются, связи между ними рвутся, возникают новые, образуются всевозможные соединения разной степени устойчивости. Самые устойчивые при данных условия соединения мы можем обнаружить в продуктах реакции, а доля каждого из них называется выходом реакции. Даже самые простые процессы состоят из десятков стадий, небольших процессов. Горение водорода, к примеру, включает в себя процессы с образованием таких соединений, как H2, O2, H, O, OH, HO2, H2O, H2O2.Понятно, что в более сложных реакциях количество промежуточных соединений, продуктов и реагентов, а значит и количество стадий, резко возрастает. В живых организмах реакции крайне сложные, поэтому образуется там всё, что угодно. Только тонкая ферментативная регуляция способна приводить этот хаос к порядку.
В рамках химической кинетики выделяется лимитирующая стадия процесса – стадия, протекающая с наименьшей скоростью. Количество участвующих в ней реагентов называется молекулярностью данной реакции. Как правило, реакции моно- и бимолекулярные, т.к. встреча сразу трёх частиц очень маловероятна, но и такое в принципе может произойти.
Теория катализа
При небольших температурах скорость химической реакции относительно низкая. И дело тут не только в том, как часто частицы сталкиваются, но и в том, какой кинетической энергией они при этом обладают. Нужная для взаимодействия энергия частиц называется энергетическим барьером. По распределению Максвелла какие-то частицы нужной энергией обладают и реагируют, но при нагревании доля их увеличивается. Можно добиться увеличения скорости реакции, добавляя в реакционную смесь некий катализатор – вещество, ускоряющее химическую реакцию, но в её результате не расходующееся. Происходит это за счёт того, что молекула катализатора реагирует с одним из реагентов, что требует небольшого количества энергии, а потом образовавшаяся частица реагирует с другим реагентом, для чего также нужна небольшая энергия. Молекула катализатора в итоге выходит из реакции в первозданном виде. То есть катализатор направляет реакцию по пути, где одна большая энергия активации как бы делится на несколько маленьких. Биологические катализаторы называются ферментами, их мы подробно рассмотрим в дальнейшем.
Глава 7
Необходимость эволюции
В одной из предшествующих глав мы говорили о том, что зарождение жизни при определённых условиях является закономерным процессом, а также о гипотезах, которые могут дать ключ к тому, как взаимодействие живых организмов и планеты обеспечивают их эволюцию. Подкрепим наши рассуждения ещё несколькими весомыми аргументами.
Как мы уже говорили ранее, существует явление автокатализа, при котором продукты реакции являются для неё катализаторами. В живых организмах таких реакций очень много. Например, чтобы синтезировать белок-катализатор для синтеза белков, нужен другой такой же белок-катализатор. Поскольку различных реакций и катализаторов в живых организмах невероятное множество, реакции образуют сеть взаимокаталитических процессов. Интересное наблюдение касается того, что при условиях ограниченного субстрата авто и взаимокаталитические циклы даже в неживой природе могут конкурировать, эволюционировать и подвергаться естественному отбору на самые быстрые и «живучие». Такие сложные системы циклов Эйген назвал гиперциклами. То есть те циклы, которые работают быстрее и эффективнее, поглотили больше субстрата, за счёт чего только стали работать быстрее (процесс же автокаталитический), а другие циклы исчезли из-за недостатка реагентов и катализаторов. Видно, что это по сути процесс естественного отбора, а ведь именно он согласно общей теории систем является в природе единственным способом создания новой информации. Такая эволюция, несомненно, играла одну из основных ролей в зарождении жизни.
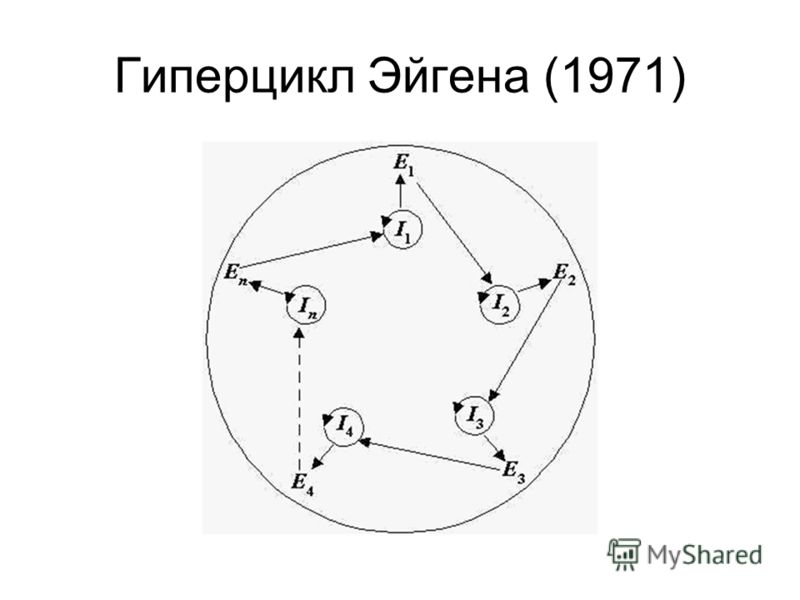
Конечно, вопрос происхождения жизни во многом не научный, т.к. мы никогда не узнаем, как жизнь зародилась. Но мы можем в будущем провести эксперимент, который покажет, как она может зародиться. А это будет уже не просто философская спекуляция.
Глава 8
Дата добавления: 2018-08-06; просмотров: 757; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
