Измерение энтропии. Тепловые машины
Итак, мы готовы вновь подниматься вверх к объяснению сложных биологических процессов. И первое, что мы обсудим - измерение энтропии.
Мы выяснили, что посчитать абсолютное значение энтропии невозможно. Но мы можем определять, в каком направлении пойдёт процесс, исходя из того, что энтропия должна возрастать. Соответственно, нам достаточно только знать изменение энтропии. Система пойдёт по пути положительного её изменения. Для измерения изменения энтропии существует формула:
dS=Q/T
,где Q - количество теплоты, а T - постоянная температура.
Эту формулу вывел Клаузиус (Rudolf Julius Emanuel Clausius, 1822-1888), немецкий физик, для изотермических (постоянная температура) условий. Понятно, что в природе сообщение системе энергии как правило вызывает в ней изменение температуры, но формула рассчитана из допущения, что она не меняется. В то же время в процессе перехода тела из одного агрегатного состояния в другое его температура не меняется, несмотря на поступление (или отвод) энергии. При этом значения энтропии для разных агрегатных состояний отличаются. Для твёрдого тела значение энтропии меньше, чем для жидкости, а для газа ещё больше, чем для жидкости.
Мы договорились рассчитывать изменение энтропии по формуле dS = Q/T [Дж/К]. При этом мы сказали, что для определения направления процесса нам этого будет достаточно. Применим это к идеальной тепловой машине.
Тепловая машина служит для перевода энергии теплоты в работу. То есть она превращает "бесполезное" неупорядоченное движение частиц в полезное "упорядоченное". Но такой процесс маловероятен, то есть сопровождается уменьшением энтропии. В таком случае, мы должны уменьшать энтропию в одном месте вселенной, при этом увеличивая её в другом, чтобы скомпенсировать это "нарушение" второго начала термодинамики. Посмотрим, как это работает на практике.
|
|
|
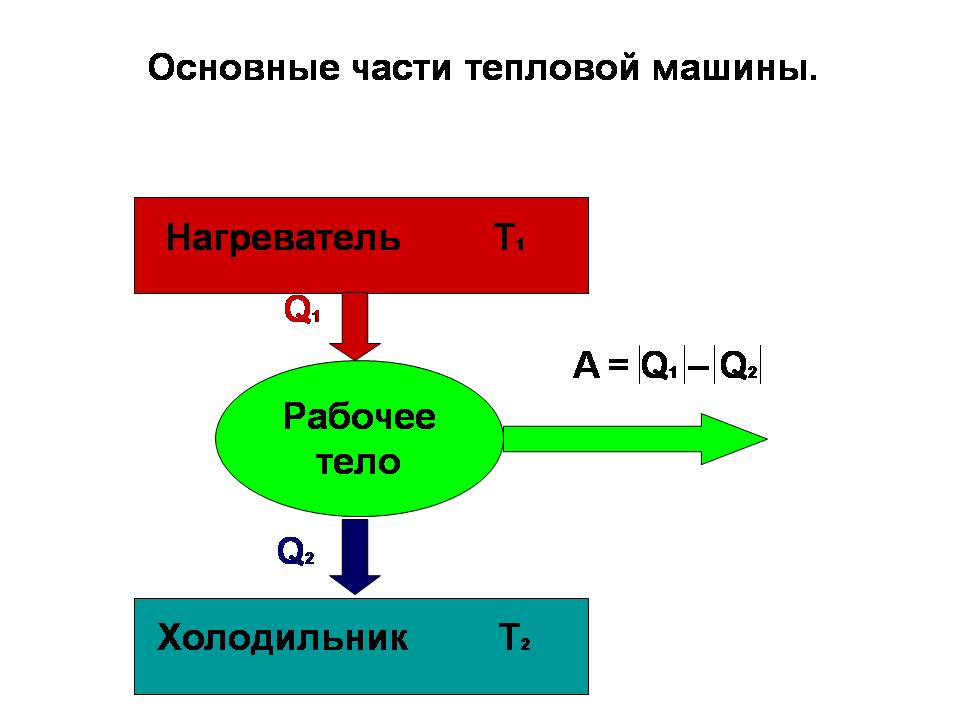
Схема работы тепловой машины.
Итак, в тепловой машине мы с помощью нагревателя, температура которого T1, отдаём энергию Q1 в виде тепла газу, который толкает поршень, то есть совершает работу. При этом газ увеличил свой объём - его энтропия возросла, а температура нагревателя уменьшилась. Далее мы отдаём энергию Q2 от газа холодильнику, температура которого T2. Газ с поршнем возвращаются в первоначальное состояние и готовы к следующему циклу. Таким образом газ уменьшил свою температуру и объём, то есть перешёл в состояние с более низкой энтропией, но параллельно возросла энтропия холодильника, которому передали энергию. Чтобы тепловая машина работала, нужно, чтобы уменьшение энтропии нагревателя (от которого забирают энергию) по модулю было меньше увеличения энтропии холодильника, то есть
|
|
|
|dS1|<=|dS2|или |Q1/T1|<=|Q2/T2|
при этом |Q1| всегда > |Q2,|, т.к. часть энергии идёт на работу (первое начало термодинамики), а T1 всегда > T2. Это и есть условие работы тепловой машины.
Тепловая машина будет работать тогда, когда суммарное изменение энтропии будет положительным. При этом, если температура холодильника будет равна абсолютному нулю, бесконечно малое количество переданной теплоты вызовет бесконечно большое увеличение энтропии, то есть коэффициент полезного действия (n) такой машины будет равен 1. Это также видно из формулы
n = (T1-T2)/T1или n = (Q1-Q2)/Q1(по определению к.п.д.)
К.п.д. реальных машин ещё ниже из-за различных теплопотерь.
Цикл работы идеальной тепловой машины называется циклом Карно. Он состоит из изотермического нагревания, адиабатного нагревания (отключённый нагреватель, газ изолирован), изотермического охлаждения и адиабатного охлаждения (отключённый холодильник, газ изолирован).
Также мы можем заставить тепловую машину переносить тепло к нагревателю от холодильника (охлаждая его), но при этом мы должны совершать работу. Такой механизм используется в бытовых холодильниках: воздух внутри охлаждается, а металлическая решётка сзади нагревается. Но чем дольше мы будем отбирать от холодильника порции тепла, тем меньше будут эти порции. Таким образом мы будем стремиться к абсолютному нулю, но никогда его не достигнем.
|
|
|
Присмотряс
Часть 4
Химическая термодинамика
Закон Гесса
Мы научились пользоваться энтропией (и вообще всеми началами термодинамики) на универсальном примере, названном тепловой машиной. При этом система претерпевала только простые превращения. Теперь посмотрим, как термодинамические уравнения позволяют нам описывать и предсказывать ход химических реакций.
Для начала следует запомнить простое правило: при образовании любой химической связи энергия выделяется, а при разрыве затрачивается. Это можно сравнить с камнем, который падает на землю, причём энергия рассеивается в виде тепла. Так же и частицы притягиваются друг к другу, выделяя энергию при столкновении. Далее есть ещё один принципиальный момент: все химические реакции имеют свои механизмы - последовательность простых превращений частиц, которые в совокупности дают сложное превращение - химическую реакцию. Рассмотрим всё вышесказанное на примере:
2H2 + O2 = 2H2O
|
|
|
Мы понимаем, что для совершения этой реакции нужно разорвать три связи (две в молекулах водорода и одну в молекуле кислорода), а затем образовать ещё четыре (в двух молекулах воды). То есть какое-то количество энергии мы затрачиваем на разрыв связей, но затем какое-то её количество возвращается нам при образовании новых. В данной реакции мы получим больше энергии, чем потратили - экзотермическая реакция (если будет наоборот, то реакцию назовут эндотермической).Горение водорода действительно идёт с выделением тепла, как и любое другое горение. То количество энергии, которое мы в сумме получаем (или тратим) при протекании реакции - есть количество теплоты (Q), а величина с противоположным знаком - изменение энтальпии (dH) системы. Горение водорода происходит с положительным количеством теплоты, но отрицательным изменением энтальпии.
Обсудим энтальпию. Эта физическая величина выводится для химических реакций, происходящих при постоянном объёме.По первому началу термодинамики:
Q= dU + p*dV,то есть переданная системе энергия идёт на изменение её внутренней энергии и совершение работы (p*dV – совершённая системой работа, например, по выталкиванию газом с давлением р поршня на объём V).Q= U2–U1 + p*V2 – p*V1 = U2+ p*V2 – (U1 + p*V1) = H2–H1 = dH. Вот мы и пришли к тому, что для изобарного процесса изменение энтальпии… равно количеству теплоты? Но как же смена знака? Всё зависит от того, какую теплоту мы берём. В данном случае мы рассматривали изменение теплоты системы, но в химической термодинамике принято рассматривать изменение энергии окружающей среды.
Кратко повторим вышесказанное. Суммарная энергия разрыва и образования химических связей определяет суммарную энергию химической реакции. Если в результате реакции тепло поглощается, такой процесс называется эндотермическим и протекает с положительным изменением энтальпии. Экзотермический процесс, напротив, протекает с выделением тепла и отрицательным изменением энтальпии. Знак количества теплоты (Q) зависит от того, с какой стороны: «изнутри» или «снаружи» мы смотрим. По этой причине в химической термодинамике предпочитают пользоваться изменением энтальпии, т.к. её знак определяется однозначно. Нужно помнить, что энтальпия определяется для изохорных процессов, что очень удобно в том числе и для описания живых систем.
Теперь представим, что мы проводим несколько реакций последовательно. Имеем ли мы право складывать участников реакций вместе с тепловыми эффектами (количество теплоты или энтальпия)? Имеем. Это видно из закона Гесса: тепловой эффект реакции (или нескольких последовательных реакций) не зависит от механизма этих реакций, а зависит только от начального и конечного состояний системы. То сеть, рассчитывая энергию связей реагентов и продуктов, мы можем предсказывать тепловой эффект реакции, не рассматривая её механизм. Это также следствие закона сохранения энергии: энергия продуктов равна энергии реагентов, если вычесть из последней ушедшую энергию или добавить пришедшую.
Дата добавления: 2018-08-06; просмотров: 572; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
