Взаимодействие биологических молекул
В этой главе мы коротко рассмотрим главные принципы функционирования именно биологических молекул. Любые взаимодействия между атомами сводятся в химических реакциях к электростатическим, описываемым приближением Борна-Оппенгеймера. «Проблема» заключается в том, что только для атома водорода получается провести все необходимые расчёты (т.к. это просто протон и электрон). Система с большим числом элементов сводится к нерешаемой в общем виде задаче о движении трёх тел. Благодаря таким учёным, как Гиллеспи, Полинг и другим химикам, мы имеем в своём распоряжении множество теорий, приближённо описывающих движение систем сложнее атома водорода. В их числе теории валентных схем, молекулярных орбиталей, отталкивания электронных облаков, гибридизации, поля лигандов и прочие. Чтобы понять все недостатки этих моделей достаточно только знать, что даже самые точные вычисления на 2018 год дают результаты точнее, чем экспериментальные установки, только для молекулы водорода. Во всех остальных случаях мы в основном полагаемся именно на опыты и измерения. Что уж говорить о невероятно сложных биологических молекулах. Ясно, что все наши попытки что-то для них посчитать могут выглядеть только детской игрой. Но это значит в первую очередь то, что в эту область и нужно направлять наши усилия.
Что же мы смогли прощупать в ещё только зарождающейся области квантовой биологии? Ещё Шрёдингер писал о том, что основным отличием биологических «кристаллов» является их непереодичность, то есть и в молекулах белков, и в молекулах нуклеиновых кислот положение каждого отдельного мономера играет существенную роль, а в большинстве важнейших случаев отсутствует дальний порядок. Изменение одного аминокислотного остатка влияет на работу белка, а одного нуклеотида в ДНК на кодируемую им информацию. Что это такое с точки зрения термодинамики? Это всё колоссальные по важности флуктуации! Вот такой вот синтез кантовой механики с термодинамикой Пригожина мы провели. Важнейшее понятие биологической квантовой механики – комплементарность, то есть более-менее однозначное соответствие молекул друг другу по форме и свойствам групп (плюс к минусу, неполярное к неполярному). Самый известный пример – взаимодействие нуклеотидов в нуклеиновых кислотах: Уотсон-Криковские пары. Но те же самые принципы работают и в любых ферментативных реакциях. Об этом подробнее мы расскажем в следующей главе. Сейчас только расскажем идею, которая ещё не нашла строгого подтверждения. Заключается она в том, что взаимодействие субстрата и фермента начинается в любой точке последнего, после чего субстрат как бы переползает по поверхности фермента к субстрат-специфичному центру. Сейчас показано только, что полимеразы нуклеиновых кислот присоединяются к последним в любой точке и движутся вдоль них, пока не достигнут участка, с которым специфично свяжутся. Это позволяет резко увеличить вероятность правильного взаимодействия молекул.
|
|
|
|
|
|
Очень показательным примером того, что наши старания не напрасны, является процесс связывания кислорода гемоглобином – самым изученным из всех белков. Начав с подробного рассмотрения этого вопроса, мы, как всегда, выведем ещё один универсальный принцип жизни.
Функция гемоглобина заключается в связывании кислорода в лёгких и диссоциации его в тканях. Как это происходит? Первым нашим предположением может являться то, что там, где кислорода много (лёгкие) он с большей вероятностью будет связываться, а там, где его мало (ткани), с большей вероятностью отдаваться. Такая картина в точности наблюдается у белка миоглобина, запасающего кислорода в мышцах. Миоглобин состоит из одной субъединицы, содержащей один гем – органическая группа с атомом железа в центре. Построим график связывания миоглобином кислорода в зависимости от концентрации последнего и сравним с тем же графиком для гемоглобина.
|
|
|
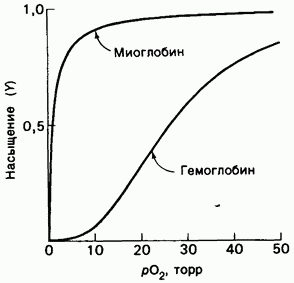
Видно, что гемоглобин демонстрирует зависимость, отличную от той, которую мы ожидали увидеть. В бедной кислородом среде он удивительно слабо связывает его, а затем начинает резко это делать в среде, богатой О2. Жизнь опять придумала механизм более хитрый, чем мы сначала себе представляли. В чём же отличие гемоглобина от гемоглобина? Гемоглобин состоит из четырёх субъединиц, каждая из которых содержит по гему. Чтобы лучше выполнять свою функцию субъединицы гемоглобина действуют сообща. Присоединение к одной из них молекулы кислорода резко повышает присоединение последующих к остальным. Именно это и обеспечивает такой скачок на графике. И есть ещё одна особенность: сродство гемоглобина к кислороду понижается при понижении pH, что в крови связано с увеличением концентрации CO2. А концентрация углекислого газа больше в тканях, где кислород и должен освобождаться от гемоглобина.
Глава 9
Дата добавления: 2018-08-06; просмотров: 483; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
