Металлы подгрупп меди и цинка
Цель работы: изучить химические свойства соединений металлов подгрупп меди и цинка.
Задание: получить гидроксид меди (II), исследовать его свойства; провести рекции взаимодействия солей цинка, кадмия и ртути со щелочью; получить комплексные соединения цинка и кадмия; убедиться на опыте, что соединения ртути (II) являются окислителями. Выполнить требования к результатам опытов, оформить отчет, решить задачу.
Теоретическое введение
Медь, серебро, золото расположены в побочной подгруппе I группы, относятся к d-металлам. Электронная структура атомов этих элементов выражается формулой (n-1)d10ns1. Наиболее характерные степени окисления: для меди +2, для серебра +1, для золота +3.
Медь, а особенно, серебро и золото – малоактивные металлы. В ряду напряжений эти металлы стоят после водорода, поэтому не вытесняют его из разбавленных кислот. Медь и серебро растворимы в концентрированной H2SO4 при нагревании, а также в азотной кислоте любой концентрации. Золото достаточно легко растворяется в смеси кислот.
Медь образует нерастворимые в воде оксиды: Cu2O – красного цвета и CuO – чёрного цвета. Гидроксиды меди CuOH и Cu(ОН)2 – нерастворимые в воде вещества соответственно жёлтого и голубого цвета, легко разлагаются при нагревании на оксид и воду. Cu(ОН)2 наряду с основными свойствами в слабой степени проявляет кислотные свойства; он растворяется в концентрированных растворах щелочей с образованием мало прочных купритов Na2[Cu(OH)4], K2[Cu(OH)4].
|
|
|
Оксид серебра получается только косвенным путём, при взаимодействии соли серебра со щёлочью:
2AgNO3 + 2NaOH = Ag2O↓ + 2NaNO3 + H2O
Большинство соединений меди, серебра и золота являются окислителями.
Цинк, кадмий и ртуть образуют побочную подгруппу II группы. Это d- металлы. Электронная структура атомов этих элементов может быть выражена формулой (n-1)d10ns2. Цинк и кадмий проявляют степень окисления +2, ртуть +1 и +2.
В подгруппе цинка наблюдается резкое падение химической активности металлов при переходе сверху вниз. В ряду напряжений цинк и кадмий стоят до водорода, а ртуть – после. Цинк – химически активный металл, легко растворяется в HCl и разбавленной H2SO4 с выделением водорода. Вследствие амфотерности его оксида он растворяется также в концентрированных растворах щелочей. Кадмий в щелочах практически не растворяется, а в кислотах – менее энергично, чем цинк. Ртуть растворима только в кислотах-окислителях: HNO3 и концентрированной H2SO4:
Hg + 2H2SO4 (конц.) = HgSO4 + SO2 + 2H2O
Hg + 4HNO3 (конц.) = Hg(NO3)2 + 2NO2 + 2H2O
При действии разбавленной азотной кислоты на избыток ртути образуется Hg2(NO3)2, где каждый атом ртути имеет степень окисления +1:
6Hg + 8HNO3 (разб.) = 3Hg2(NO3)2 + 2NO + 4H2O
|
|
|
Во всех соединениях ртути (I) атомы ртути связаны между собой попарно, образуя двухвалентные группы –Hg–Hg−. Поэтому формулу нитрата ртути (I) следует писать Hg2(NO3)2, а не HgNO3, также Hg2Cl2, а не HgCl. Диссоциация солей ртути (I) идёт с образованием ионов Hg22+. Соединения Hg22+ в зависимости от условий могут быть окислителями и восстановителями. Например, в реакции Hg2Cl2 + Cl2 = 2HgCl2 Hg2Cl2 – восстановитель, а в реакции Hg2Cl2 + SnCl2 = 2Hg + SnCl4 Hg2Cl2 − окислитель.
Все металлы подгруппы цинка устойчивы на воздухе, так как на поверхности цинка и кадмия при обычной температуре образуется тончайшая оксидная плёнка, защищающая эти металлы от дальнейшего окисления, а ртуть на воздухе при комнатной температуре не окисляется. При нагревании все металлы образуют с кислородом нерастворимые оксиды: ZnO – белого, CdO – коричневого, HgO – жёлтого или красного, Hg2O – чёрного цвета.
Гидроксиды цинка и кадмия нерастворимы в воде и получаются при взаимодействии их солей с растворами щелочей. Zn(OH)2 обладает амфотерными свойствами, а Cd(OH)2, главным образом, − основными. Оба эти гидроксида легко растворяются в избытке NH4ОН с образованием комплексных аммиакатов. При взаимодействии растворов солей ртути со щелочами образуются оксиды, так как гидроксиды неустойчивы и разлагаются в момент образования.
|
|
|
Элементы подгрупп меди и цинка проявляют склонность к комплексообразованию, координационное число их ионов равно 4.
Выполнение работы
Опыт 1. Получение и свойства гидроксида меди (II)
В четыре пробирки налить по 1-2 мл раствора соли меди (II) и во все добавить раствор щёлочи до выпадения осадка. Затем прилить до растворения осадков в первую – раствор HCl, во вторую – раствор аммиака, в третью – концентрированной щёлочи. Содержимое четвёртой пробирки нагреть до кипения и отметить изменение окраски.
Требования к результатам опыта:
1. Написать уравнение реакции получения гидроксида меди (II).
2. Составить уравнения реакций растворения гидроксида меди (II) в:
а) HCl; б) NH4OH; в) концентрированной щелочи.
3. Составить уравнение реакции, происходящей при нагревании Cu(ОН)2.
4. Сделать выводы о кислотно-основных свойствах и термической устойчивости гидроксида меди (II).
Опыт 2. Окислительные свойства соли меди (II)
Налить в пробирку 3-4 мл раствора CuSO4 и прибавить такой же объём раствора KI. Наблюдать образование белого осадка CuI. Дать осадку отстояться и испытать раствор иодкрахмальной бумажкой.
|
|
|
Требования к результатам опыта:
1. Закончить уравнение реакции CuSO4 + KI = и объяснить изменение окраски иодкрахмальной бумажки.
2. Сделать вывод об окислительно-восстановительных свойствах соединений меди (II).
Опыт 3. Получение оксида серебра
В пробирку налить 3-4 капли раствора AgNO3 и добавить 1-2 капли раствора щёлочи. Отметить цвет образующегося осадка.
Требование к результату опыта:
Составить уравнение реакции образования оксида серебра.
Опыт 4. Действие щёлочи на растворы солей металлов подгруппы цинка
Налить в четыре пробирки по 1-2 мл растворов солей цинка, кадмия, ртути (I) и ртути (II). В каждую пробирку по каплям прибавить раствор щёлочи до выпадения осадков. Отметить их цвет. Прилить во все пробирки избыток раствора щёлочи. Какой из осадков растворяется?
Требования к результатам опыта:
1. Составить уравнения реакций взаимодействия вышеперечисленных солей с раствором щелочи.
2. Написать молекулярное и ионные уравнения реакции растворения осадка в избытке щелочи.
Опыт 5. Окислительные свойства солей ртути
В пробирку налить 1-2 мл раствора нитрата ртути (II) и прибавить по каплям раствор SnCl2 до образования белого осадка хлорида ртути (I) Hg2Cl2. К осадку добавить избыток раствора SnCl2. Наблюдать постепенное образование серого осадка металлической ртути.
Требования к результатам опыта:
1. Написать уравнения реакций образования Hg2Cl2 и металлической ртути.
2. Сделать вывод об окислительно-восстановительных свойствах солей ртути (II) и (I).
Опыт 6. Комплексные соединения цинка и кадмия
Налить в одну пробирку 1-2 мл раствора соли цинка, в другую 1-2 мл раствора соли кадмия. В обе пробирки добавить по каплям раствор NH4ОН до образования осадков, а затем до полного их растворения.
Требование к результатам опыта:
Составить молекулярные и ионные уравнения реакций образования гидроксидов и аммиакатов цинка и кадмия.
Задачи
№ 19.1. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Ag → AgNO3 → AgCl → [Ag(NH3)2]Cl → Ag2S
№ 19.2. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
ZnS → ZnO → Zn → ZnSO4 → Zn(OH)2 → Na2ZnO2
№ 19.3. Составить в молекулярном и ионном виде уравнения реакций гидролиза:
а) CuSO4 + H2O ↔; б) CuSO4 + Na2CO3 + H2O =; в) CuCl2 + H2O ↔
№ 19.4. Вычислить ΔН0 реакции восстановления оксида цинка углем с образованием СО. (  -350,6 кДж/моль;
-350,6 кДж/моль; 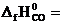 -110,5 кДж/моль).
-110,5 кДж/моль).
(Ответ: 240,1 кДж).
№ 19.5. Написать уравнения реакций, сопровождающихся образованием свободного металла:
а) AgNO3 + H2O2 + NaOH =; б) H[AuCl4] + H2O2 + NaOH =
№ 19.6. Что происходит при действии на гидроксиды цинка и кадмия растворов: а) щелочи; б) аммиака? Написать уравнения соответствующих реакций в молекулярном и ионном виде.
№ 19.7. Вычислить молярную концентрацию водного раствора сульфата меди (  = 1,107 г/мл), полученного при растворении 5 г соли в 45 г воды.
= 1,107 г/мл), полученного при растворении 5 г соли в 45 г воды.
(Ответ: 0,57 моль/л).
№ 19.8. Закончить уравнения реакций: а) CuCl2 + NaOH =;
б) CuO + HNO3 =; в) Cu(СN)2 + КСN =; г) CuSO4 + H2O ↔
№ 19.9. Закончить уравнения реакций: а) Zn + NaNO3 + NaOH =;
б) Zn + K2Cr2O7 + H2SO4 =; в) Hg + HNO3 (разб.) =; г) Zn + H2SO4 (разб.) =
№ 19.10. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
СuS → CuO → Cu → CuSO4 → Cu(OH)2 → CuO
№ 19.11. Можно ли восстановить медь из ее оксида водородом? Ответ мотивировать, вычислив ΔG0 реакции: CuO (к) + H2 (г) = Cu (к) + H2O (г)
(  -129,9 кДж/моль;
-129,9 кДж/моль;  = -228,6 кДж/моль).
= -228,6 кДж/моль).
№ 19.12. Написать уравнения реакций взаимодействия металлов с кислотами: а) Сu + H2SO4 (конц.) =; б) Au + H2SеO4 (конц.) =;
в) Ag + HNO3 (разб.) =; г) Cu + HNO3 (разб.) =
№ 19.13. Кусочек латуни (сплав цинка и меди) растворили в азотной кислоте. Раствор разделили на две части: к одной части прибавили избыток аммиака, а к другой − избыток щелочи. В растворе или в осадке и в виде каких соединений находятся цинк и медь в обоих случаях? Написать уравнения соответствующих реакций.
№ 19.14. С помощью каких химических реакций можно осуществить следующие превращения: HgSO4 → HgO → HgCl2 → HgS → HgO →Hg
№ 19.15. Чему равна молярная масса эквивалентов кадмия, если для выделения 1 г кадмия из раствора его соли надо пропустить через раствор 1717 Кл электричества? (Ответ: 56,2 г/моль).
№ 19.16. Закончить уравнения реакций: а) Hg2Cl2 + SnCl2 =;
б) Cd + HNO3 (разб.) =; в) Cd + H2SO4 (конц.) =; г) Hg + HNO3 (разб.) =
№ 19.17. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Cd → Cd(NO3)2 → Cd(OH)2 → [Cd(NH3)4](OH)2 → CdSO4
№ 19.18. Учитывая, что координационное число серебра равно двум, написать уравнения реакций образования комплексных соединений серебра и назвать их:
а) AgNO3 + KCN (избыток) =; б) AgBr + Nа2S2O3 =; в) AgCl + NH4OH =
№ 19.19. Какие вещества образуются при добавлении щелочи к растворам одно- и двухвалентной азотнокислой ртути? Составить молекулярные и ионные уравнения реакций.
№ 19.20. Составить схемы двух гальванических элементов, в одном из которых медь служила бы катодом, а в другом – анодом. Написать уравнения реакций, происходящих при работе этих элементов. Вычислить значения стандартных ЭДС.
Лабораторная работа 20
Хром
Цель работы: изучить химические свойства соединений хрома.
Задание: убедиться на опытах, что кислотно-основные и окислительно-восстановительные свойства соединений хрома зависят от степени его окисления. Выполнить требования к результатам опытов, оформить отчет, решить задачу.
Теоретическое введение
Хром является элементом побочной подгруппы VI группы. Это d-металл. На внешнем энергетическом уровне атома хрома содержится один электрон (3d54s1), однако соединения, в которых хром был бы одновалентен, неизвестны. Типичные степени окисления хрома +3, +6.
Хром – металл, исключительно химически устойчивый, так как покрыт защитной оксидной плёнкой. Концентрированные H2SO4, HNO3 и царская водка на холоду не действуют на хром и лишь при нагревании медленно его растворяют. Однако хром реагирует с HCl и разбавленной H2SO4, вытесняя из них водород.
При прокаливании на воздухе образуется оксид хрома (III) Cr2O3 – тугоплавкое вещество зелёного цвета, не растворимое в воде. Cr2O3 – амфотерен, но малоактивен и реагирует только при сплавлении:
Cr2O3 + 2NaOH = 2NaCrO2 + H2O
Cr2O3 + 3Na2S2O7 = Cr2(SO4)3 + 3Na2SO4
Гидроксид хрома (III) получают реакцией обмена:
Cr2(SO4)3 + 6КОН = 2Cr(OH)3↓ + 3К2SO4
Cr(OH)3 не растворим в воде, имеет амфотерный характер. Он растворяется в кислотах с образованием солей, в которых хром (III) выполняет функцию катиона:
Cr(OH)3 + 3HCl = CrCl3 + 3H2O
и в щелочах с образованием солей, называемых хромитами, в которых хром (III) входит в состав аниона:
Cr(OH)3 + 3КОН = К3[Cr(OH)6]
Соединения хрома (III) являются восстановителями и под действием окислителей переходят в соединения хрома (VI). Оксид хрома (VI) CrO3 – вещество тёмно-красного цвета, сильный окислитель. При растворении его в воде образуется две кислоты хромовая и дихромовая, известные только в растворах. Соли хромовой кислоты (хроматы) окрашены в жёлтый цвет, присущий иону CrO42−; соли дихромовой кислоты (дихроматы) имеют оранжевую окраску, характерную для ионов Cr2O72−.
Хроматы устойчивы в нейтральной и щелочной среде, дихроматы – в кислой. При изменении реакции среды возможен переход хроматов в дихроматы и наоборот:
2CrO42− + 2H+ ↔ Н2O + Cr2O72− (оранжевая окраска)
Cr2O72− + 2OH‾ ↔ H2O + 2CrO42− (жёлтая окраска)
Хроматы и дихроматы – сильные окислители. Наиболее сильно окислительные свойства проявляются в кислой среде, при этом соединения хрома (VI) восстанавливаются до соединений хрома (III).
Выполнение работы
Опыт 1. Получение оксида хрома (III) (групповой)
В фарфоровую чашку насыпать горкой небольшое количество дихромата аммония(NH4)2Cr2O7 и горящей спичкой нагреть его сверху. Наблюдать бурное разложение соли. Отметить цвет исходного вещества и продукта реакции. Проверить растворимость последнего в воде.
Требования к результатам опыта:
1. Написать уравнение реакции разложения дихромата аммония и сделать вывод, к какому типу ОВР относится данная реакция.
2. Сделать вывод о растворимости в воде оксида хрома (III)
Опыт 2. Получение и свойства гидроксида хрома (III)
В две пробирки налить по 1-2 мл раствора соли хрома (III) и добавить в каждую по каплям раствор щёлочи до появления серо-зелёного осадка. Для определения свойств Cr(OH)3 добавить в первую пробирку раствор HCl, а во вторую концентрированный раствор щёлочи до полного растворения осадков. (Пробирку с образовавшимся хромитом сохранить для опыта 3).
Требования к результатам опыта:
1. Написать уравнение реакции получения гидроксида хрома (III).
2. Составить уравнения реакций взаимодействия Cr(OH)3 с кислотой и щелочью.
3. Сделать вывод о кислотно-основных свойствах гидроксида хрома (III).
Опыт 3. Восстановительные свойства соединений хрома (III)
В пробирку с хромитом натрия или калия, полученным в опыте 2, добавить пероксид водорода H2O2 до изменения окраски.
Требования к результатам опыта:
1. Закончить уравнение реакции: KCrO2 + H2O2 + KOH =
2. Сделать вывод, какими свойствами – окислительными или восстановительными – обладают соединения хрома (III).
Опыт 4. Взаимные переходы хромата и дихромата
Налить в одну пробирку 2-3 мл раствора хромата калия K2CrO4, а в другую – столько же дихромата калия K2Cr2O7. Заметить окраску в обеих пробирках. В первую пробирку добавить 1-2 мл раствора H2SO4 , во вторую 1-2 мл раствора щёлочи. Наблюдать изменения окраски.
Требования к результатам опыта:
1. Написать уравнения реакций перехода хромата в дихромат в кислой среде и дихромата в хромат в щелочной среде.
2. Сделать вывод о влиянии реакции среды на устойчивость хроматов и дихроматов.
Опыт 5. Окислительные свойства соединений хрома (VI)
В две пробирки налить по 1-2 мл раствора K2Cr2O7 и подкислить растворы 1 мл разбавленной H2SO4. Затем в одну пробирку прилить немного свежеприготовленного раствора сульфита натрия, во вторую – раствора нитрита калия. Как изменится окраска растворов?
Требования к результатам опыта:
1. Закончить уравнения реакций: K2Cr2O7 + Na2SO3 + H2SO4 =
K2Cr2O7 + KNO2 + H2SO4 =
2. Сделать вывод, какими свойствами – окислительными или восстановительными – обладают соединения хрома (VI).
Задачи
№ 20.1. Закончить уравнения реакций: а) K2Cr2O7 + KI + H2SO4 =;
б) CrO3 + NaOH =; в) CrCl3 + H2O ↔; г) Cr2O3 + H2SO4 =
№ 20.2. Вычислить тепловой эффект реакции получения хрома по стандартным энтальпиям образования: Cr2O3 + 2Al = Al2O3 + 2Cr
(  -1440,6 кДж/моль;
-1440,6 кДж/моль; 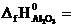 -1676 кДж/моль). (Ответ: -235,4 кДж).
-1676 кДж/моль). (Ответ: -235,4 кДж).
№ 20.3. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Na2Cr2O7 → Na2CrO4 → Na2Cr2O7 → CrCl3
№ 20.4. Закончить уравнения реакций: а) NaCrO2 + PbO2 + NaOH =;
б) K2Cr2O7 + FeSO4 + H2SO4 =; в) Cr2(SO4)3 + H2O ↔
№ 20.5. Какой объем хлора при нормальных условиях выделится при взаимодействии одного моля дихромата натрия с избытком соляной кислоты? (Ответ: 67,2 л).
№ 20.6. Составить уравнения реакций взаимодействия в щелочной среде хлорида хрома (III): а) с бромом (Br2); б) с пероксидом водорода (H2O2).
№ 20.7. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Cr2O3 → Cr2(SO4)3 → Cr(OH)3 → K3[Cr(OH)6]
№ 20.8. Можно ли восстановить хром из его оксида алюминием? Ответ мотивировать, вычислив ΔG0 реакции: Cr2O3 + 2Al = Al2O3 + 2Cr
(  -1050 кДж/моль;
-1050 кДж/моль;  -1582 кДж/моль).
-1582 кДж/моль).
№ 20.9. Составить уравнения реакций взаимодействия в щелочной среде сульфата хрома (III): а) с бромом (Br2); б) с диоксидом свинца (PbO2).
№ 20.10. Учитывая, что координационное число хрома (III) равно 6, написать уравнения реакций образования комплексных соединений хрома и назвать их: а) CrCl3 + KCN (избыток) =;
б) Cr(OH)3 + NaOH (избыток) =; в) CrCl3 + NH4OH (избыток) =
№ 20.11. Написать в молекулярном и ионном виде уравнения реакций гидролиза солей хрома: а) CrCl3 + Na2S + H2O =;
б) Cr2(SO4)3 + K2CO3 + H2O =; в) Cr(NO3)3 + H2O ↔
№ 20.12. Вычислить молярную массу эквивалентов и эквивалент восстановителя в реакции: 2СrCl3 + 3Br2 + 16KOH = 2K2CrO4 + 6KBr + 6KCl + 8H2O
№ 20.13. При сплавлении хромита железа Fe(CrO2)2 с карбонатом натрия в присутствии кислорода хром (III) и железо (II) окисляются и приобретают степени окисления +6 и +3. Составить уравнение реакции.
№ 20.14. Можно ли получить хром восстановлением Cr2O3 водородом с образованием водяного пара при стандартном состоянии всех веществ? Ответ обосновать, рассчитав ΔG0 реакции: Cr2O3 + 3Н2 = 3Н2O (г) + 2Cr.
(  -1050 кДж/моль;
-1050 кДж/моль; 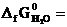 -228,6 кДж/моль).
-228,6 кДж/моль).
№ 20.15. Закончить уравнения реакций: а) Na2CrO4 + H2SO4 =;
б) Na2Cr2O7 + NaOH =; в) Na2Cr2O7 + HCl =; г) Cr + HCl =
№ 20.16. Закончить уравнения реакций окисления соединений хрома (III):
а) Cr2O3 + NaNO3 + Na2CO3  ; б) Cr(NO3)3 + NaBiO3+ HNO3 =;
; б) Cr(NO3)3 + NaBiO3+ HNO3 =;
№ 20.17. Вычислить молярную массу эквивалентов и эквивалент окислителя в реакции: Al + K2Cr2O7 + H2SO4 =
№ 20.18. Закончить уравнения реакций:
а) Cr2O3 + H2SO4 =; б) Cr2O3 + КОН  ; в) Cr2O3 + КОН + KMnO4 =
; в) Cr2O3 + КОН + KMnO4 =
№ 20.19. Предложить 4 способа получения Cr2O3. Составить соответствующие уравнения реакций.
№ 20.20. Сколько требуется дихромата калия для приготовления 2 л 0,1 н (по отношению к реакциям окисления в кислой среде) раствора K2Cr2O7?
(Ответ: 9,8 г).
Лабораторная работа 21
Марганец
Цель работы: изучить химические свойства соединений марганца.
Задание: получить и исследовать кислотно-основные и окислительно-восстановительные свойства гидроксида марганца (II); провести реакцию разложения перманганата калия; выяснить, как влияет среда на характер протекания реакций с участием перманганата калия в качестве окислителя. Выполнить требования к результатам опытов, оформить отчет, решить задачу.
Теоретическое введение
Марганец является элементом побочной подгруппы VII группы. Это d-металл. Электронная структура его атома выражается формулой 3d54s2. Типичные степени окисления марганца +2, +4, +7, менее свойственные +3, +6. Для химии марганца очень характерны окислительно-восстановительные реакции. При этом в кислой среде для марганца устойчива степень окисления +2, в сильнощелочной +6, в нейтральной +4.
В соответствии с возможными степенями окисления марганец образует оксиды: Mn+2O, Mn2+3O3, Mn+4O2, Mn+6O3, Mn2+7O7
С повышением степени окисления марганца ослабевают основные и усиливаются кислотные свойства оксидов и гидроксидов. MnO и Mn2O3 и соответствующие им гидроксиды Mn(OH)2 и Mn(OH)3 имеют основной характер. Нерастворимый в водеMn(OH)2 на воздухе вследствие окисления кислородом постепенно переходит в бурыйMn(OH)3:
4Mn(OH)2 + O2 + 2H2O = 4Mn(OH)3
Окончательным продуктом окисления является коричневый оксид-гидроксид марганца:
4Mn(OH)3 + O2 + 2H2O = 4Mn(OH)4 = 4MnO(OH)2 + 4H2O
Соли марганца (II) и их концентрированные растворы обычно окрашены в светло-розовый цвет. Соединения марганца (II) – восстановители.
Оксид марганца (IV)MnO2 – тёмно-бурое нерастворимое в воде вещество, наиболее устойчивое кислородное соединение марганца при обычных условиях. Обладает слабо выраженными амфотерными свойствами. С концентрированной H2SO4 он даёт крайне неустойчивую соль Mn(SO4)2, а при сплавлении со щелочами образует манганиты:
MnO2 + 2KOH = K2MnO3 + H2O
MnO2 − сильный окислитель, при этом он восстанавливается до солей марганца (II):
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
Действием более сильных окислителей может быть окислен до соединений Mn (VI), Mn (VII):
2MnO2 + 4KOH + O2 = 2K2MnO4 + 2H2O
K2MnO4 − манганат калия, соль не выделенной в свободном состоянии марганцовистой кислоты H2MnO4. Не получен и оксид Mn (VI) – MnO3. Растворы манганатов окрашены в тёмно-зелёный цвет, присущий ионам MnO42−. Они устойчивы только в сильнощелочной среде, при разбавлении раствора водой манганаты диспропорционируют:
3K2MnO4 + 2H2O = 2КMnO4 + MnO2 + 4KOH
Все производные Mn (VI)являются окислителями, особенно в кислой среде. Однако при действии более сильных окислителей они превращаются в соединения марганца (VII):
K2MnO4 + Сl2 = 2КMnO4 + 2KCl
Оксид марганца (VII) Mn2O7 – зеленовато-чёрная жидкость, сильный окислитель. Растворим в воде. Отвечающая ему марганцовая кислота HMnO4 известна только в растворах. Эти растворы, а также растворы её солей (перманганаты), окрашены в фиолетово-малиновый цвет, характерный для иона (MnO4)−. При нагревании перманганаты разлагаются с выделением кислорода:
2КMnO4 = K2MnO4 + MnO2 + O2
Производные Mn (VII) – сильные окислители. В кислой среде они восстанавливаются до солей марганца (II), в нейтральной, а также в слабокислой и слабощелочной – до MnO2, в сильнощелочной до манганатов, которые затем постепенно переходят в соединения Mn (IV).
Выполнение работы
Опыт 1. Получение и свойства гидроксида марганца (II)
В две пробирки налить по 1-2 мл раствора соли марганца (II) и в каждую добавить по каплям раствор щёлочи до образования осадка. Отметить его цвет. В одну из пробирок прилить раствор кислоты, другую оставить на воздухе и наблюдать изменение цвета осадка. Осадок сохранить для опыта 3.
Требования к результатам опыта:
1. Составить уравнение реакции образования Mn(ОН)2.
2. Написать уравнение реакции растворения гидроксида марганца (II) в кислоте.
3. Написать уравнение реакции окисления гидроксида марганца (II) на воздухе до MnО(ОН)2
4. Сделать вывод о кислотно-основных свойствах Mn(ОН)2.
Опыт 2. Восстановительные свойства соединений марганца (II)
В пробирку налить 2-3 мл раствора азотной кислоты (1:1) и 2-3 капли раствора MnSO4, перемешать и на кончике шпателя добавить висмутата натрия NaBiO3. По изменению окраски раствора определить образовавшееся соединение.
Требования к результатам опыта:
1. Закончить уравнение реакции: MnSO4 + NaBiO3 + HNO3 =
2. Сделать вывод, какие свойства, окислительные или восстановительные, проявляют соединения марганца (II).
Опыт 3. Окислительные свойства соединений марганца (IV)
Приготовить 2-3 мл раствора сульфата железа (II), подкислить его 1-2 мл разбавленной H2SO4 и добавить к осадку, полученному в опыте 1. Что наблюдается?
Требования к результатам опыта:
1. Составить уравнение реакции взаимодействия MnО(ОН)2 с FeSO4 в кислой среде.
2. Сделать вывод, какие свойства, окислительные или восстановительные, проявляют соединения марганца (IV) в данной реакции.
Опыт 4. Разложение перманганата калия
В сухую пробирку поместить шпатель перманганата калия и нагреть на пламени спиртовки. К отверстию пробирки поднести тлеющую лучинку. Что наблюдается? Какой газ выделяется при разложении KМnO4? Нагревание продолжить до прекращения выделения газа. Пробирку охладить и влить в неё 2-3 мл воды. По окраске образовавшегося раствора и осадка определить соединения.
Требования к результатам опыта:
1. Составить уравнение реакции разложения KМnO4 при нагревании и сделать вывод, к какому типу ОВР относится данная реакция.
2. Закончить уравнение реакции K2МnO4 + Н2О = и сделать вывод, к какому типу ОВР относится данная реакция.
Опыт 5. Окислительные свойства соединений марганца (VII)
Окисление пероксида водорода
Налить в пробирку 1-2 мл раствора KМnO4, 0,5-1 мл раствора H2SO4 и 2-3 мл раствора пероксида водорода Н2O2. Отметить обесцвечивание раствора и выделение газа.
Окисление сульфата марганца (II)
К 1-2 мл раствора сульфата марганца MnSO4 по каплям прилить раствор перманганата калия до выделения бурого осадка MnO2. При помощи универсальной индикаторной бумаги убедиться, что реакция раствора стала кислой.
Требования к результатам опыта:
1. Закончить уравнения реакций: KМnO4 +Н2O2 + H2SO4 =;
MnSO4 + KМnO4 + Н2О=
2. Сделать вывод, какие свойства, окислительные или восстановительные, проявляют соединения марганца (VII).
Опыт 6. Влияние среды на характер восстановления перманганата калия
В три пробирки налить по 2-3 мл раствора перманганата калия и добавить: в первую – 1-2 мл раствора H2SO4, во вторую – столько же воды, а в третью 1-2 мл концентрированной щёлочи. Во все три пробирки добавить по каплям раствор нитрита калия КNO2 до исчезновения фиолетового окрашивания. По окраскам полученных растворов и осадков определить соединения марганца.
Требования к результатам опыта:
1. Закончить уравнения реакций:
KМnO4 + КNO2 + H2SO4 =;
KМnO4 + КNO2 + Н2О =;
KМnO4 + КNO2 + КОН =
2. Сделать вывод о характерной степени окисления марганца в кислой, нейтральной и щелочной среде.
Задачи
№ 21.1. Как получить сульфат марганца (II) из: а) оксида марганца (II);
б) металлического марганца; в) KMnO4? Составить соответствующие уравнения реакций.
№ 21.2. Какая масса перманганата калия потребуется для окисления 7,6 г FeSO4 в кислой среде? (Ответ: 1,58 г).
№ 21.3. Рассчитать молярную массу эквивалентов перманганата калия в реакции: KMnO4 + PH3 + H2SO4 = H3PO4 + …..
Какая масса H3PO4 образуется, если в реакции участвовало 17 г PH3?
(Ответ: 31,6 г/моль; 49 г).
№ 21.4. Под действием HNO3 манганаты диспропорционируют следующим образом: K2MnO4 + HNO3 = KMnO4 + MnO2 + KNO3 + H2O
Какой объем раствора HNO3 (ρ = 1,185 г/мл) с массовой долей 30 % необходим для того, чтобы получить 9,48 г перманганата калия? (Ответ: 21,3 мл).
№ 21.5. Как получить соединения марганца (VI) из соединений с более высокой и с более низкой степенью окисления? Составить соответствующие уравнения реакций.
№ 21.6. Окисление сульфата железа (II) перманганатом калия в нейтральной среде протекает по уравнению KMnO4 + FeSO4 + Н2О = FeОНSO4 + ……
Какая масса перманганата калия потребуется для окисления 7,6 г FeSO4?
(Ответ: 2,63 г).
№ 21.7. Закончить уравнения реакций: а) MnO + H2SO4 =;
б) Mn2O7 + KOH =; в) MnSO4 + KClO3 + KOH  K2MnO4 + …
K2MnO4 + …
№ 21.8. Закончить уравнения реакций, в которых соединения марганца проявляют свойства: а) окислительные Fe(OH)2 + KMnO4 + H2O =;
б) восстановительные MnSO4 + PbO2 + HNO3 =;
в) окислительные и восстановительные одновременно K2MnO4 + H2O =
№ 21.9. Почему оксид марганца (IV) может проявлять и окислительные и восстановительные свойства? Закончить уравнения реакций:
а) MnO2 + KI + H2SO4 =; б) MnO2 + KNO3 + KOH =
№ 21.10. Как меняется степень окисления марганца при восстановлении KMnO4 в кислой, щелочной и нейтральной среде? Закончить уравнения реакций: а) KMnO4 + К2SO3 + H2SO4 =;
б) KMnO4 + К2SO3 + КОН =; в) KMnO4 + К2SO3 + H2O =
№ 21.11. Восстановление перманганата калия сульфатом железа (II) в кислой среде протекает по уравнению KMnO4 + FeSO4 + H2SO4 =…. На восстановление KMnO4 израсходовано 47 мл 0,208 н раствора FeSO4. Сколько граммов KMnO4 содержалось в исходном растворе? (Ответ: 0,154 г).
№ 21.12. Закончить уравнения реакций: а) Mn + H2SO4 (разб.) =;
б) MnCl2 + KOH =; в) MnCl2 + H2O ↔; г) Mn + HNO3 (разб.) =
№ 21.13. Окисление сульфата железа (II) перманганатом калия в щелочной среде протекает по уравнению KMnO4 + FeSO4 + КОН = FeОНSO4 + ……
Какая масса перманганата калия потребуется для окисления 7,6 г FeSO4?
(Ответ: 7,9 г).
№ 21.14. Можно ли восстановить марганец из его оксида алюминием? Ответ мотивировать, вычислив ΔG0 реакции: 3MnO2 + 4Al = 2Al2O3 + 3Mn
( 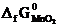 = -464,8 кДж/моль;
= -464,8 кДж/моль;  -1582 кДж/моль).
-1582 кДж/моль).
№ 21.15. Как можно перевести в растворимое состояние марганец? Составить соответствующие уравнения реакций.
№ 21.16. Вычислить молярную массу эквивалентов и эквивалент окислителя в реакции: NaNO2 + KMnO4 + H2SO4 =
№ 21.17. Вычислить тепловой эффект реакции получения марганца по стандартным энтальпиям образования: 3MnO2 + 4Al = 2Al2O3 + 3Mn
(  -519,4 кДж/моль;
-519,4 кДж/моль; 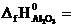 -1676 кДж/моль). (Ответ: -1793,8 кДж).
-1676 кДж/моль). (Ответ: -1793,8 кДж).
№ 21.18. Закончить уравнения реакций: а) KMnO4 + H2SO4 (конц.) =;
б) Mn2O7 + HCl =; в) Mn2O7 + NaOH =; г) MnO2 + KOH =
№ 21.19. За 10 мин из раствора MnSO4 ток силой 5 А выделил 0,85 г Mn. Определить молярную массу эквивалентов марганца. (Ответ: 27,3 г/моль).
№ 21.20. Закончить уравнения реакций: а) K2MnO4 + Cl2 =;
б) Mn(NO3)2 + H2O ↔; в) MnSO4 + H2O ↔; г) MnCl2 + NaOH =.
Реакции б), в), г) написать в молекулярном и ионном виде.
Лабораторная работа 22
Железо, кобальт, никель
Цель работы: изучить химические свойства соединений железа, кобальта, никеля.
Задание:получить гидроксиды железа (II), кобальта (II), никеля (II) и изучить их окислительно-восстановительные свойства; убедиться на опытах, что соединения железа (II) проявляют восстановительные, а железа (III) – окислительные свойства; получить комплексные соединения никеля и кобальта. Выполнить требования к результатам опытов, оформить отчет, решить задачу.
Теоретическое введение
Железо, кобальт, никель составляют первую триаду элементов VIII группы побочной подгруппы (семейство железа), расположены в 4 периоде, относятся к d-элементам. Электронное строение 3dn4s2 (n = 6, 7, 8). Степени окисления +2, +3 и +6 (для Fe).
В ряду напряжений Fe, Co, Ni располагаются перед водородом в той же последовательности, в какой они стоят в периодической системе элементов.
В соляной и разбавленной серной кислоте железо, кобальт, никель растворяются при комнатной температуре с выделением водорода и образованием солей М (II).
При действии концентрированной H2SO4 и дымящей HNO3 при обычной температуре эти металлы пассивируются. Разбавленная азотная кислота растворяет железо с образованием соли Fe (II); продуктами восстановления HNO3 могут быть (в зависимости от концентрации) NH4NO3, N2, N2O. Только концентрированная HNO3 при нагревании растворяет железо с образованием солей
Fe (III).
Кобальт и никель растворяются в HNO3 с образованием солей М (II) и выделением NO2 в случае концентрированной кислоты и NO в случае разбавленного раствора.
Fe, Co, Ni образуют оксиды MО, M2O3 и М3О4 (МО . М2О3).
Оксид железа Fe+6O3, в свободном состоянии не получен, известны соответствующие соли − ферраты Na2FeO4, K2FeO4.
Оксиды МО и соответствующие им гидроксиды М(ОН)2 обладают основными свойствами, практически не растворимы в воде. М(ОН)2 получаются при взаимодействии солей М (II) со щелочами. Гидроксид Fe(OH)2 легко окисляется и частично переходит в Fe(OH)3:
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
Гидроксид Со(ОН)2 существует в виде двух модификаций − синей и розовой, окисляется в Со(ОН)3 под воздействием кислорода воздуха, но медленнее, чем Fe(OH)2. Под действием окислителей Н2О2, Br2 окисление идет гораздо быстрее. В отличие от Fe(OH)2 и Со(ОН)2 гидроксид Ni(OH)2 устойчив на воздухе и устойчив к действию Н2О2. Окисляется только более энергичными окислителями (Cl2, Br2):
2Ni(OH)2 + Br2 + 2NaOH = 2Ni(OH)3 + 2NaBr
Оксид Fe2O3 и соответствующий гидроксид проявляют основные свойства, легко растворяются в кислотах, но могут проявлять и слабые амфотерные свойства. При сплавлении со щелочами или содой образуют ферриты:
Fe2O3 + Na2CО3 = 2NaFeO2 + CО2
Оксиды Co2O3 и Ni2O3 и соответствующие им гидроксиды Со(ОН)3 и Ni(OH)3 плохо растворимы в воде, являются сильными окислителями. При действии на них кислот образуют соли М (II):
Cо2O3 + 6HCl = 2CoCl2 + Cl2 + 3 H2O
Для железа более устойчивыми являются соединения со степенью окисления +3, для никеля и кобальта +2. Поэтому Fe2+ является довольно сильным восстановителем, тогда как Со2+ и Ni2+ этими свойствами в заметной степени не обладают. В степени окисления +3 железо, кобальт и никель проявляют окислительные свойства; окислительная способность увеличивается в ряду Fe −Co − Ni .
Соли сильных кислот, как правило, все хорошо растворимы, растворы их вследствие гидролиза имеют кислую среду.
Элементы триады железа легко образуют комплексные соединения, в которых железо может иметь степень окисления +2, +3, кобальт, главным образом, +3, а никель +2. Наиболее характерное координационное число 6, редко 4.
Выполнение работы
Опыт 1. Получение и свойства гидроксида железа (II)
Налить в пробирку 1-2 мл свежеприготовленного раствора FeSO4 и прилить такой же объем щелочи. Наблюдать выделение осадка. Через несколько минут наблюдается побурение осадка. Почему?
Требование к результатам опыта:
Написать уравнения реакций получения гидроксида железа (II) и окисление его на воздухе до Fe(ОН)3.
Опыт 2. Получение и свойства гидроксида кобальта (II)
Налить в две пробирки по 1-2 мл раствора СоСl2, добавить 1-2 мл раствора щелочи. Наблюдать осаждение синей формы Со(ОН)2. Нагреть содержимое одной пробирки. Образуется Со(ОН)2 розового цвета. При стоянии на воздухе Со(ОН)2 окисляется до Со(ОН)3. Быстро ли происходит эта реакция?
В другую пробирку с Со(ОН)2 прилить несколько капель раствора пероксида водорода Н2О2. Что наблюдается?
Требования к результатам опыта:
1. Составить уравнения реакций получения гидроксида кобальта (II) и окисление его на воздухе до Со(ОН)3.
2. Написать уравнение реакции окисления Со(ОН)2 пероксидом водорода.
3. Сделать вывод о скорости окисления Со(ОН)2 под действием кислорода воздуха и пероксида водорода.
Дата добавления: 2018-06-27; просмотров: 448; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
