Опыт 4. Действие щелочи на металлы
В две пробирки налить по 2-3 мл концентрированного раствора щелочи. В одну из них насыпать небольшое количество цинковых опилок, в другую – алюминиевого порошка. Если реакция не идет, слегка нагреть. Когда начнется интенсивное выделение газа, поднести к отверстиям пробирок зажженную лучинку. Что наблюдается?
Требования к результатам опыта:
1. Составить уравнения реакций взаимодействия цинка и алюминия с раство ром щелочи.
2. Сделать вывод, какие металлы реагируют со щелочами.
Задачи
№ 14.1. Закончить и уравнять реакции:
а) Ba + H2O =; б) Sn + NaOH + H2O =;
в) Sn + HNO3 (разб.) =; г) Hg + H2SO4 (конц.) =
№ 14.2. Закончить и уравнять реакции:
а) Cd + H2SO4 (разб.)=; б) Be + NaOH + H2O =;
в) Bi + HNO3 (конц.) г) Li + H2O =
№ 14.3. Какие из перечисленных металлов (Mg, Mn, Hg, Au, Al, Cd, Ag) растворяются в разбавленной H2SO4? Написать уравнения реакций.
№ 14.4. Закончить и уравнять реакции:
а) Mg + HNO3 (разб.) =; б) Sn + KOH + H2O =;
в) Ni + H2SO4 (конц.) =; г) W + HNO3 + HF = H2[WF8] + …
№ 14.5. Закончить и уравнять реакции:
а) Ga + NaOH + H2O =; б) Bi + HNO3 (разб.) =;
в) La + H2O =*; г) Co + H2SO4 (конц.) =
*Электродный потенциал лантана -2,55 В.
№ 14.6. Закончить и уравнять реакции:
а) Rb + H2O =; б) W + Na2CO3 + NaNO3  Na2WO4 + …;
Na2WO4 + …;
в) Be + KOH + H2O =; г) Sn + HCl =
№ 14.7. Закончить и уравнять реакции:
а) Pb + NaOH + H2O =; б) Fe + O2 =;
в) Ni + HNO3 (конц.) =; г) La + H2SO4 (разб.) =*
* Электродный потенциал лантана -2,55 В.
|
|
|
№ 14.8. Закончить и уравнять реакции:
а) Ga + H2SO4 (разб.) =*; б) Cd + HNO3 (конц.) =;
в) Sr + H2O =*; г) Al + C 
* Электродный потенциал стронция -2,88 В, галлия -0,53 В.
№ 14.9. Закончить и уравнять реакции:
а) Mn + HNO3 (разб.) =; б) Al + KOH + H2O =;
в) Ca + H2O =; г) Fe + H2SO4 (разб.) =
№ 14.10. Закончить и уравнять реакции:
а) Ta + HNO3 + HF = H2[TaF7] + …; б) Cs + H2O =;
в) Ag + HNO3 (разб.) =; г) Al + HCl =
№ 14.11. Закончить и уравнять реакции:
а) Zr + HNO3 + HCl = ZrCl4 + …; б) Rb + H2O =;
в) Mn + HNO3 (конц.) =; г) Sn + KOH + H2O =
№ 14.12. Закончить и уравнять реакции:
а) Mo + NaNO3 + NaOH  Na2MoO4 + …; б) Ni + H2SO4 (разб.) =;
Na2MoO4 + …; б) Ni + H2SO4 (разб.) =;
в) Ni + H2SO4 (конц.) =; г) Mg + H2O 
№ 14.13. Закончить и уравнять реакции:
а) Na + H2 =; б) Zn + CH3COOH =;
в) Sn + H2SO4 (конц.) =; г) Ca + HNO3 (оч. разб.) =
№ 14.14. Закончить и уравнять реакции:
а) Hg + HNO3 + HCl = HgCl2 + …; б) Co + HNO3 (конц.) =;
в) K + H2O =; г) Sc + H2SO4 (разб.) =*
* Электродный потенциал скандия -2,01 В.
№ 14.15. Какие из перечисленных металлов (Cu, Ca, Hg, Au, Fe, Cr, Ag, Al) растворяются в HCl? Написать уравнения реакций.
№ 14.16. Закончить и уравнять реакции:
а) Nb + HNO3 + HF = H2[NbF7] + …; б) Li + N2 =;
|
|
|
в) Pb + KOH + H2O =; г) Fe + HNO3 (разб.) =
№ 14.17. Закончить и уравнять реакции:
а) V + KOH + O2  КVО3 + …; б) Sn + HNO3 (конц.) = H2SnO3 + …;
КVО3 + …; б) Sn + HNO3 (конц.) = H2SnO3 + …;
в) Ag + H2SO4 (конц.)  ; г) Mn + H2SO4 (разб.) =
; г) Mn + H2SO4 (разб.) =
№ 14.18. Закончить и уравнять реакции:
а) Pt + HNO3 + HCl = H2[PtCl6] + …; б) Fe + H2SO4 (конц.)  ;
;
в) Al + S  ; г) Sn + KOH + H2O =
; г) Sn + KOH + H2O =
№ 14.19. Закончить и уравнять реакции:
а) Fe + Cl2 =; б) Be + KOH + H2O =;
в) Cd + HNO3 (разб.) =; г) Sn + H2SO4 (разб.) =
№ 14.20. Закончить и уравнять реакции:
а) Ca + H2 =; б) Mn + HCl =;
в) Mo + Na2CO3 + NaNO3  Na2MoO4 + …; г) Cd + HNO3 (разб.) =
Na2MoO4 + …; г) Cd + HNO3 (разб.) =
Лабораторная работа 15
Комплексные соединения
Цель работы: получить представление о комплексных соединениях, их строении, комплексообразователях, лигандах, координационном числе, научиться составлять уравнения реакций с участием комплексных соединений.
Задание:получить комплексные соединения меди, ртути, серебра; проделать окислительно-восстановительные реакции и реакции обмена с участием комплексных соединений. Выполнить требования к результатам опытов, оформить отчет, решить задачу.
Теоретическое введение
|
|
|
Соединения, в состав которых входят комплексные ионы, способные существовать как в кристаллах, так и в растворах, называются комплексными. Комплексные соединения могут быть получены при взаимодействии нейтральных молекул:
Fe(CN)3 + 3KCN = K3[Fe(CN)6]; BF3 + KF = K[BF4]
В молекуле комплексного соединения один атом или ион, обычно положительно заряженный, занимает центральное место и называется комплексообразователем. В непосредственной близости к нему расположены или координированы противоположно заряженные ионы или нейтральные молекулы, называемые лигандами. Комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения. Число лигандов, расположенных вокруг комплексообразователя, называется координационным числом.Чаще всего координационное число равно 6, 4 и 2. В формулах комплексных соединений внутреннюю сферу обозначают квадратными скобками. Все остальные ионы, не вошедшие во внутреннюю сферу, составляют внешнюю сферу.
При растворении в воде комплексные электролиты диссоциируют на внутреннюю и внешнюю сферу: [Ag(NH3)2]Cl ↔ [Ag(NH3)2]+ + Cl‾. Наряду с этим происходит и другой процесс, хотя в значительно меньшей степени:
[Ag(NH3)2]+ ↔ Ag+ + 2NH3. Здесь диссоциация протекает обратимо и равновесие резко сдвинуто влево. Константа диссоциации комплексного иона
|
|
|

называется константой нестойкости (Кн). Она характеризует устойчивость комплекса. Чем меньше константа нестойкости, тем прочнее комплексный ион в растворе.
Выполнение работы
Опыт 1. Получение комплексной соли меди
Налить в пробирку 1-2 мл раствора сульфата меди CuSO4 и по каплям прибавить раствор аммиака NH4OH. Наблюдать образование осадка основной соли меди (CuOH)2SO4. Отметить цвет осадка. Прилить избыток раствора аммиака. Получается раствор, содержащий комплексный ион [Cu(NH3)4]2+. Отметить цвет раствора.
Требования к результатам опыта:
1. Написать уравнение реакции образование основной соли (CuOH)2SO4.
2. Составить уравнение реакции получения комплексной соли меди.
Опыт 2. Получение комплексной соли ртути
Налить в пробирку 1-2 мл раствора нитрата ртути и добавить по каплям раствор иодида калия KI до появления ярко оранжевого осадка HgI2. Слить с осадка жидкость. К осадку добавить раствор KI. Осадок растворяется с образованием комплексного иона [HgI4]2−.
Требования к результатам опыта:
1. Написать уравнение реакции образования иодида ртути.
2. Составить уравнение реакции получения комплексного соединения ртути.
Опыт 3. Получение комплексной соли серебра
Налить в пробирку 1-2 мл раствора AgNO3 и добавить такой же объем раствора хлорида натрия NaCl. Отметить цвет осадка. Слить с образовавшегося осадка жидкость. К осадку добавить раствор аммиака NH4OH. Наблюдать растворение осадка хлорида серебра. Раствор сохранить для следующего опыта.
Требования к результатам опыта:
1. Написать уравнение реакции взаимодействия AgNO3 и NaCl.
2. Составить уравнение реакции образования [Ag(NH3)2]Cl.
Опыт 4. Разрушение комплексных соединений
К раствору комплексной соли серебра, полученной в предыдущем опыте, прибавить несколько капель концентрированной азотной кислоты до кислой реакции. Наблюдать выпадение белого осадка хлорида серебра
Требование к результату опыта:
Составить уравнение реакции и объяснить разрушение комплексного иона.
Опыт 5. Комплексные соединения в реакциях обмена
Налить в пробирку 1-2 мл раствора гексацианоферрата (III) калия K3[Fe(CN)6] и добавить несколько капель раствора сульфата железа (II) FeSO4. Наблюдать образование осадка гексацианоферрата (III) железа (II) калия KFe[Fe(CN)6] синего цвета, получившего название турнбулевой сини.
Налить в пробирку 1-2 мл раствора гексацианоферрата (II) калия K4[Fe(CN)6] и добавить несколько капель раствора хлорида железа (III) FeCl3. Наблюдать образование осадка гексацианоферрата (II) железа (III) калия KFe[Fe(CN)6] синего цвета, называемого берлинской лазурью
Требование к результатам опыта:
Написать молекулярные и ионные уравнения реакций образования осадков гексацианоферрата (III) железа (II) калия и гексацианоферрата(II) железа (III) калия.
Опыт 6. Комплексные соединения в реакциях окисления-восстановления
Смешать в пробирке по 1-2 мл растворов пероксида водорода H2O2 и разбавленного раствора щелочи, прилить несколько капель K3[Fe(CN)6]. Какой газ выделяется (испытать тлеющей лучинкой)?
К подкисленному раствору перманганата калия KMnO4 прибавить 1-2 мл раствора гексацианоферрата(II) калия K4[Fe(CN)6]. Наблюдать обесцвечивание раствора.
Требование к результатам опыта:
Закончить уравнения реакций:
K3[Fe(CN)6] + Н2О2 + КОН =
K4[Fe(CN)6] + KMnO4 + Н2SO4 =
В каждой реакции указать окислитель и восстановитель.
Примеры решения задач
Пример 15.1. Определить заряд комплексного иона, координационное число комплексообразователя (к.ч.) и степень окисления комплексообразователя в соединениях: а) [Cr(H2O)4Cl2]Cl, б) K3[Fe(CN)6], в) [Cu(NH3)4]SO4.
Решение. Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Координационное число комплексообразователя равно числу лигандов, координирующихся вокруг него. Степень окисления комплексообразователя определяется так же, как степень окисления атома в любом соединении, исходя из того, что сумма степеней окисления всех атомов в молекуле равна нулю. Заряды нейтральных молекул (Н2О, NH3) равны нулю. Заряды кислотных остатков определяют из формул соответствующих кислот. Отсюда: заряд иона а) +1, б) −3, в) +2; к.ч. а) 6, б) 6, в) 4; степень окисления
а) +3, б) +3, в) +2
Пример 15.2.Назвать комплексные соли: [Cu(NH3)4]SO4, [Co(Н2О)4(NO2)2]Cl, K4[Fe(CN)6], Na2[Pt(OH)5Cl], [Pt(NH3)2Cl2], [Cu(NH3)2(SCN)2].
Решение. При составлении названия комплексного соединения первым в именительном падеже называется анион, в потом в родительном – катион, независимо, который из них является комплексным.
1. Соль содержит комплексный катион. Название комплексного катиона составляют следующим образом: сначала указывают числа (ди, три, тетра, пента, гекса и т.д.) и названия отрицательно заряженных лигандов с окончанием «о» (Cl‾ - хлоро, SO42− - сульфато, ОН− - гидроксо, CN‾ - циано. SCN− – родано, NO2− - нитро и т.п.); затем указывают числа и названия нейтральных лигандов, причем вода называется аква, аммиак – аммин; последним называют комплексообразователь, указывая его степень окисления (в скобках римскими цифрами после названия комплексообразователя). Например, [Cu(NH3)4]SO4 – сульфат тетраамминмеди (II); [Co(Н2О)4(NO2)2]Cl – хлорид динитротетрааквакобальта (III).
2. Соль содержит комплексный анион. Название комплексного аниона составляют аналогично названию катиона и заканчивают суффиксом «ат». Например, K4[Fe(CN)6] − гексацианоферрат (II) калия; Na2[Pt(OH)5Cl] – хлоропентагидроксоплатинат (IV) натрия.
3. Наименование нейтральных комплексов образуют так же, как и катионов, но комплексообразователь называют в именительном падеже, а его степень окисления не указывают. Например, [Pt(NH3)2Cl2] – дихлородиамминплатина; [Cu(NH3)2(SCN)2] – дироданодиамминмеди.
Задачи
№ 15.1. Написать формулы следующих соединений: а) хлорид дибромотетраамминплатины (IV); б) тетрароданодиаквахромат (III) калия; в) сульфат пентаамминакваникеля (II); г) трихлоротриамминкобальт (III). К какому типу относится каждое из комплексных соединений по электрическому заряду комплексного иона?
№ 15.2. Составить координационные формулы следующих комплексных соединений платины: а) PtCl4 ∙ 6NH3; б) PtCl4 ∙ 4NH3; в) PtCl4 ∙ 2NH3. Координационное число платины (IV) равно 6. Написать уравнения диссоциации этих соединений в водных растворах. Какое соединение является комплексным неэлектролитом?
№ 15.3. Написать молекулярные и ионные уравнения реакций обмена с образованием нерастворимых комплексных соединений:
а) СuSO4 + K4[Fe(CN)6] =; б) KCl + Na2[PtCl6] =;
в) AgNO3 + K3[Fe(CN)6] =; г) FeSO4 + Na3[Co(CN)6] =.
Назвать образующиеся при реакциях комплексные соли.
№ 15.4. Определить степень окисления и координационное число комплексообразователя в следующих комплексных ионах: а) [Ni(NH3)5Cl]2+;
б) [Co(NH3)2(NO2)4]‾; в) [Cr(H2O)4Br2]+; г) [AuCl4]‾; д) [Cd(CN)4]2−.
№ 15.5. Составить координационные формулы следующих комплексных соединений кобальта: а) CoCl3 ∙ 6NH3; б) CoCl3 ∙ 5NH3; в) CoCl3 ∙ 4NH3. Координационное число кобальта (III) равно 6. Написать уравнения диссоциации этих соединений в водных растворах.
№ 15.6. Написать координационные формулы следующих комплексных соединений: а) гексанитрокобальтат (III) калия; б) хлорид гексаамминникеля (II); в) тетрахлородиамминплатина; г) трифторогидроксобериллат магния. К какому типу относится каждое из комплексных соединений по заряду комплексного иона?
№ 15.7. Из сочетания частиц Cr3+, H2O, Cl‾, K+ можно составить семь координационных формул комплексных соединений хрома, одно из которых [Cr(H2O)6]Cl3. Составить формулы других шести соединений и написать уравнения их диссоциации в водных растворах.
№ 15.8. Написать молекулярные и ионные уравнения реакций обмена, происходящих между: а) гексацианоферратом (II) калия и сульфатом меди;
б) гексацианокобальтатом (II) натрия и сульфатом железа; в) гексацианоферратом (III) калия и нитратом серебра; г) гексахлороплатинатом (II) натрия и хлоридом калия. Образующиеся в результате реакций комплексные соединения нерастворимы в воде.
№ 15.9. Константы нестойкости комплексных ионов [Co(CN)4]2−, [Hg(CN)4]2−, [Cd(CN)4]2− соответственно равны 8 ∙ 10−20, 4 ∙ 10−41, 1,4 ∙ 10−17. В каком растворе, содержание ионов CN‾ больше? Написать выражения для констант нестойкости указанных комплексных ионов.
№ 15.10. Определить, чему равен заряд комплексных ионов:
а) [Сr(NH3)5NO2], б) [Pd(NH3)Cl3], в) [Ni(CN)4], если комплексообразователями являются Cr3+, Pd2+, Ni2+. Написать формулы комплексных соединений, содержащих эти ионы.
№ 15.11. Из сочетания частиц Co3+, NH3, NO2‾, K+ можно составить семь координационных формул комплексных соединений кобальта, одно из которых [Co(NH3)6](NO2)3. Составить формулы других шести соединений и написать уравнения их диссоциации в водных растворах.
№ 15.12. Составить координационные формулы следующих комплексных соединений платины (II), координационное число которой равно 4:
а) PtCl2 ∙ 3NH3; б) PtCl2 ∙ NH3 ∙ KCl; в) PtCl2 ∙ 2NH3. Написать уравнения диссоциации этих соединений в водных растворах. Какое соединение является комплексным неэлектролитом?
№ 15.13. Константы нестойкости комплексных ионов [Co(NH3)6]3+, [Fe(CN)6]4−, [Fe(CN)6]3− соответственно равны 6,2 ∙ 10−36, 1,0 ∙ 10−37, 1,4 ∙ 10−44. Какой из этих ионов наиболее прочный? Написать выражения для констант нестойкости указанных комплексных ионов и молекулярные формулы соединений, содержащих эти ионы.
№ 15.14. Известны две комплексные соли кобальта, отвечающие одной и той же эмпирической формуле CoClSO4 ∙ 5NH3. Одна из них в растворе с BaCl2 дает осадок BaSO4, но не дает осадка с AgNO3, другая с AgNO3 дает осадок AgCl, а с BaCl2 осадка не дает: а) написать формулы обоих комплексных соединений;
б) назвать эти комплексные соединения и написать уравнения их диссоциации; в) написать молекулярные и ионные уравнения реакций взаимодействия комплексных соединений с образованием осадка – в одном случае AgCl, а в другом – BaSO4.
№ 15.15. Определить заряд комплексообразователя и назвать комплексные соединения:
а) Cu2[Fe(CN)6]; б) [Ag(NH3)2]Cl; в) [Co(NH3)3(NO2)3]; г) Na2[PtCl4].
№ 15.16. Назвать каждое из следующих соединений: а) K3[Ni(CN)6];
б) [Cr(NH3)4(SCN)Cl]NO3; в) [Pt(NH3)2(H2O)2Br2]Cl2; г) K4[CoF6].
№ 15.17. Из раствора комплексной соли PtCl4 ∙ 6NH3 нитрат серебра осаждает весь хлор в виде хлорида серебра, а из раствора соли PtCl4 ∙ 3NH3 – только ¼ часть входящего в его состав хлора. Написать координационные формулы этих солей, определить координационное число платины в каждой из них.
№ 15.18. Координационное число Os4+ и Ir4+ равно 6. Составить координационные формулы и написать уравнения диссоциации в растворе следующих комплексных соединений этих металлов:
а) 2NaNO2 ∙ OsCl4; б)Ir(SO4)2 ∙ 2KCl; в) OsBr4 ∙ Ca(NO3)2; г) 2RbCl ∙ IrCl4.
№ 15.19. Написать координационные формулы соединений
а) Co(NO2)3 ∙ 3KNO2; б) Co(NO2)3 ∙ KNO2 ∙ 2NH3; в) CoCl3 ∙ 3NH3, если координационное число кобальта 6. Составить уравнения диссоциации этих соединений.
№ 15.20. Нижеприведенные молекулярные соединения представить в виде комплексных солей: а) KCN ∙ AgCN; б) 2KCN ∙ Cu(CN)2; в) Co(NO3)3 ∙ 6NH3; г) CrCl3 ∙ 6H2O; д) 2KSCN ∙ Co(SCN)2; е) 2KI ∙ HgI2. Написать уравнения диссоциации этих солей в водных растворах.
Лабораторная работа 16
S-металлы
Цель работы: изучить химические свойств s-металлов.
Задание: провести реакции взаимодействия натрия, калия, магния, кальция с водой; убедиться на опыте, что пероксид натрия подвергается гидролизу и обладает двойственными окислительно-восстановительными свойствами; определить продукты горения магния. Выполнить требования к результатам опытов, оформить отчет, решить задачу.
Теоретическое введение
S-металлы расположены в главных подгруппах I (щелочные металлы (ЩМ)) и II (Ве, Мg и щелочноземельные металлы (ЩЗМ)) групп. Общая электронная формула ns1 и ns2. Во всех соединениях ЩМ проявляют степень окисления +1, Ве, Mg и ЩЗМ +2.
Все s-металлы – сильные восстановители. Они энергично взаимодействуют с кислородом. При этом литий образует оксид Li2O, натрий − пероксид Na2O2, а калий, рубидий и цезий – надпероксиды МО2. Бериллий, магний, ЩЗМ образуют оксиды МО. Пероксиды ЩМ проявляют окислительные и восстановительные свойства, причём окислительные свойства выражены сильнее. Пероксиды являются солями пероксида водорода. Поскольку кислотные свойства Н2О2 выражены очень слабо, пероксиды, растворяясь в воде, подвергаются почти полному гидролизу.
ЩМ энергично взаимодействуют с водой при комнатной температуре, вытесняя из неё водород и образуя гидроксиды. Активность взаимодействия с водой возрастает по мере увеличения порядкового номера элемента. Также взаимодействуют и ЩЗМ. Магний хорошо взаимодействует с водой при нагревании и при комнатной температуре в присутствии хлорида аммония NH4Cl, который удаляет с поверхности магния защитную пленку из Mg(OH)2.
Гидроксиды ЩМ хорошо растворимы в воде, являются сильными основаниями и называются щелочами. Гидроксиды II-А группы менее растворимые и более слабые основания. Основные свойства гидроксидов М(ОН)2 увеличиваются от Ве(ОН)2 (амфотерного) до Ва(ОН)2.
Из ЩМ только литий непосредственно взаимодействует с азотом при комнатной температуре, образуя нитрид лития Li3N. Магний и ЩЗМ реагируют с азотом при нагревании с образованием М3N2.
Выполнение работы
Опыт 1. Взаимодействие щелочных металлов с водой (групповой)
Налить в кристаллизатор воды. Пинцетом достать кусочек металлического натрия из склянки, где он хранится под слоем керосина, и высушить его фильтровальной бумагой. Ножом отрезать кусочек металла с величиной со спичечную головку. Обратить внимание на потускнение металлической поверхности свежего надреза. Пинцетом перенести металл в кристаллизатор с водой. По окончании реакции к полученному раствору прибавить 1-2 капли фенолфталеина.
Не наклоняться над кристаллизатором, так как под конец реакции происходит разбрызгивание металлической окалины, которая может причинить сильные ожоги.
Провести аналогичный опыт с калием.
Требования к результатам опыта:
1. Написать уравнения реакций взаимодействия натрия и калия с водой.
2. Сделать вывод об активности натрия и калия по отношению к воде.
Опыт 2. Свойства пероксида натрия
Взаимодействие с водой
В пробирку внести шпатель пероксида натрия Na2О2, добавить 1-2 мл воды, затем несколько капель фенолфталеина. Что наблюдается?
Окислительные свойства
Налить в пробирку 1-2 мл раствора иодида калия KI, добавить такое же количество разбавленной серной кислоты и насыпать шпатель пероксида натрия. Что происходит?
Восстановительные свойства
Налить в пробирку 1-2 мл раствора перманганата калия KMnO4, добавить шпатель пероксида натрия и перемешать. Отметить изменение окраски раствора.
Требования к результатам опыта:
1. Написать уравнение реакции гидролиза пероксида натрия и сделать вывод, солью какой кислоты является Na2О2.
2. Закончить уравнения окислительно-восстановительных реакций:
Na2О2 + KI + Н2SO4 =;
Na2О2 + KMnO4 + Н2О =,
в каждой реакции указать окислитель и восстановитель.
3. Сделать вывод об окислительно-восстановительных функциях Na2О2.
Опыт 3. Горение магния на воздухе (групповой)
Взять пинцетом кусочек магниевой стружки и внести в пламя спиртовки. После воспламенения сжечь его над фарфоровой чашкой. К собранному в чашке оксиду магния прилить несколько капель воды, хорошо перемешать и добавить 1-2 капли фенолфталеина. Объяснить появление окраски. С какими составными частями воздуха вступает во взаимодействие магний?
Требование к результатам опыта:
Составить уравнения реакций взаимодействия магния с кислородом, азотом и продуктов их взаимодействия с водой.
Опыт 4. Взаимодействие кальция и магния с водой
В три пробирки налить по 3-4 мл воды и в каждую добавить по несколько капель фенолфталеина. В одну пробирку пинцетом внести кусочек кальция, в две другие – по кусочку магния. Наблюдать за протеканием реакций. Одну из пробирок с магнием нагреть, в другую пробирку с магнием добавить раствора хлорида аммония.
Требования к результатам опыта:
1. Написать уравнения реакций взаимодействия:
а) кальция с водой; б) магния с водой; в) магния с водой и NH4Cl.
2. Объяснить влияние нагревания и присутствия хлорида аммония на реакцию взаимодействия магния с водой.
3. Сделать вывод об активности кальция и магния по отношению к воде.
Задачи
№ 16.1. Написать уравнения реакций натрия с водородом, кислородом, азотом, серой. Какую степень окисления приобретают атомы окислителя в каждой из этих реакций?
№ 16.2. Написать уравнения реакций с водой следующих соединений натрия: Na2O2, Na2S, NaH, Na3N.
№ 16.3. Как получают металлический натрий? Составить электронные уравнения процессов, происходящих на электродах при электролизе расплава NaОH.
№ 16.4. Составить уравнения реакций получения гидрида, нитрида и карбида кальция и взаимодействия этих соединений с водой.
№ 16.5. Закончить уравнения реакций: а) Li2O + CO2 =;
б) Na2O2 + Na2SO3 + H2O =; в) K2S + H2O ↔; г) NaCl + K[Sb(OH)6] =
№ 16.6. Составить уравнения реакций, которые нужно провести для осуществления следующих превращений:
Са → СаН2 → Са(ОН)2 → СаСО3 → Са(НСО3)2
№ 16.7. Гидроксид какого из s-металлов проявляет амфотерные свойства? Составить молекулярные и ионные уравнения реакций этого гидроксида:
а) с кислотой; б) со щелочью.
№ 16.8. Составить уравнения реакций: а) бериллия с раствором щелочи;
б) кальция с соляной кислотой; в) магния с концентрированной серной кислотой.
№ 16.9. При сплавлении оксид бериллия взаимодействует с диоксидом кремния и с оксидом натрия. Написать уравнения соответствующих реакций. О каких свойствах ВеО свидетельствуют эти реакции?
№ 16.10. Какая масса гидроксида калия образовалась у катода при электролизе раствора К2SO4, если на аноде выделилось 11,2 л кислорода (н.у.)?
(Ответ: 112 г).
№ 16.11. Вычислить молярную концентрацию водного раствора КОН, полученного при растворении 1,5 г щелочи в 48,5 воды. Плотность раствора 1,027 г/мл. (Ответ: 0,53 моль/л).
№ 16.12. Вычислить энтальпию образования MgO, исходя из уравнения реакции: MgO + C = Mg + CO, ΔH0 = 491,3 кДж. (Δ f H0CO = -110,5 кДж/моль).
(Ответ: -601,8 кДж).
№ 16.13. Вычислить количество теплоты, которое выделится при взаимодействии 8 г гидрида натрия с водой. Стандартные энтальпии образования NaH, NaOH, H2O (ж) принять соответственно равными -56,4; -425,6 и -285,8 кДж/моль. (Ответ: 28,8 кДж).
№ 16.14. Каким объемом 35 %-ного раствора КОН (ρ= 1,34 г/см3) можно заменить 10 л 4 н раствора КОН? (Ответ: 4,78 л).
№ 16.15. Закончить уравнения реакций:
а) Na2O2 + KNО2 + H2SO4 =; б) L3N + H2O =; в) K + O2 =; г) CaCO3 
№ 16.16. Написать уравнения реакций лития с водородом, кислородом, азотом, серой. Какую степень окисления приобретают атомы окислителя в каждой из этих реакций?
№ 16.17. При электролизе водного раствора NaOH на аноде выделилось 2,8 л кислорода (н.у.). Сколько водорода выделится на катоде? (Ответ: 5,6 л).
№ 16.18. Вычислить ΔG0 реакции горения магния в диоксиде углерода. Энергии Гиббса образования MgO, СО2, СО принять соответственно равными (кДж/моль): -569,6; -394,4; -137,1. Возможно ли самопроизвольное протекание этой реакции? (Ответ: -312,6 кДж).
№ 16.19. Можно ли получить кальций восстановлением его оксида алюминием? Ответ обосновать расчетом энергии Гиббса реакции. Энергии Гиббса образования СаO и Al2O3 принять соответственно равными -604,2 и -1582 кДж/моль.
№ 16.20.Закончить уравнения реакций:
а) Be + KOH + H2O =; б) Li2C2 + H2O =; в) Mg + H2O =; г) Na2SO3 + H2O ↔
Лабораторная работа 17
Жёсткость воды
Цель работы: изучить виды жесткости воды и методы ее устранения.
Задание: проделать опыты и определить общую, карбонатную и некарбонатную жесткость воды. Выполнить требования к результатам опытов, оформить отчет, решить задачу.
Теоретическое введение
Жёсткость воды обусловливается присутствием в ней солей кальция и магния. Различают временную (карбонатную) и постоянную (некарбонатную)жёсткость. Временную жёсткость придают воде гидрокарбонаты кальцияи магнияCa(HCO3)2, Mg(HCO3)2, постоянную − сульфаты и хлориды этих металлов CaSO4, MgSO4 и CaCl2, MgCl2 Сумма временной и постоянной жёсткости составляет общую жёсткость воды.
Жёсткость воды выражается числом миллимолей эквивалентов ионовСа2+ и Мg2+, содержащихся в 1 л воды (ммоль/л). Один миллимоль эквивалентов жёсткости отвечает содержанию 20,04 мг/л ионов Са2+или 12,16 мг/л ионов Мg2+.
Для определения общей жёсткости воды используется метод комплексонометрии. В основе этого метода лежит титрование воды в присутствии аммиачного буферного раствора и индикатора хромогена чёрного ЕТ-00 раствором комплексона III (трилона Б) до перехода винно-красной окраски в синюю.
В присутствии ионов Са2+ и Мg2+ индикатор окрашивается в красный цвет, при отсутствии − в синий. При титровании жёсткой воды раствором трилона Б происходит связывание ионов Са2+ и Мg2+, поэтому в конце титрования индикатор изменяет окраску и раствор становится синим.
Определение карбонатной жёсткости воды сводится к определению концентрации гидрокарбонат-ионовНСО3‾ и, тем самым, эквивалентной этим ионам концентрации ионов жёсткости Са2+ и Мg2+. Анализ проводят методом нейтрализации. В основе этого метода лежит титрование воды в присутствии метилоранжа раствором соляной кислоты до перехода жёлтой окраски индикатора в оранжевую.
Анион НСО3‾вводе гидролизуется:
НСО3‾ + Н2О ↔ Н2СО3 + ОН‾,
поэтому вода имеет щелочную реакцию среды и метилоранж в ней окрашен в жёлтый цвет. При титровании раствором HCl такой воды протекает реакция нейтрализации:
ОН‾ + Н+ ↔ Н2О
Ионы Н+ нейтрализуют количество ионов ОН‾, эквивалентное концентрации ионов НСО3‾.
Анализ воды на жёсткость предполагает обычно:
1. Определение общей жёсткости Жо.
2. Определение карбонатной жёсткости Жк.
3. Вычисление некарбонатной жёсткости Жнк = Жо – Жк.
Выполнение работы
Опыт 1. Определение общей жёсткости воды
В коническую колбу вместимостью 300 мл отмерить мерной колбой 100 мл анализируемой воды. Добавить к исследуемой воде 5 мл аммиачного буферного раствора, 5-7 капель индикатора хромогена чёрного и медленно титровать раствором трилона Б, постоянно перемешивая, до перехода винно-красной окраски в синюю.
Повторить титрование ещё раз. Если результаты двух титрований совпадут (ΔV £ 0,1 мл), то по полученным результатам рассчитать общую жёсткость. В противном случае необходимо оттитровать пробу воды ещё раз.
Требование к результату опыта:
1. Вычислить общую жёсткость воды по формуле:
Жо = (сэк . V1 . 1000) / V2 ,
где сэк – молярная концентрация эквивалентов трилона Б, моль/л; V1 – объём раствора трилона Б, пошедшего на титрование, мл; V2 – объём анализируемой воды, мл.
Опыт 2. Определение карбонатной и некарбонатной жёсткости воды
В коническую колбу вместимостью 300 мл отмерить мерной колбой 100 мл воды, добавить к ней несколько капель метилоранжа. Подготовленную пробу оттитровать раствором соляной кислоты до перехода жёлтой окраски индикатора в оранжевую. Чтобы точнее уловить момент изменения окраски, полезно поставить рядом другую колбу, содержащую 100 мл испытуемой воды с 2-3 каплями метилоранжа. Повторить титрование ещё раз. Если результаты двух титрований совпадут (ΔV £ 0,1 мл), то по полученным результатам рассчитать карбонатную жёсткость. В противном случае необходимо оттитровать пробу воды ещё раз.
Требования к результатам опыта:
1. Вычислить карбонатную жёсткость воды по формуле:
Жк = (сэк . V1 . 1000) / V2 ,
где сэк – молярная концентрация эквивалентов HCl, моль/л; V1 – объём раствора HCl, пошедшего на титрование, мл; V2 – объём анализируемой воды, мл.
2. Вычислить некарбонатную жёсткость воды по разности:
Жнк = Жо – Жк
Примеры решения задач
Пример 17.1. Вычислить жесткость воды, зная, что в 500 л ее содержится 202,5 г Ca(HCO3)2.
Решение. Для решения задачи воспользуемся формулой ж =  .
.
Мэк (Ca(HCO3)2) = 162 / 2 = 81 г/моль.
ж =  = 5 ммоль/л.
= 5 ммоль/л.
Пример 17.2. Вычислить карбонатную жесткость воды, зная, что на титрование 100 мл этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 мл 0,08 н раствора НCl.
Решение. Вычисляем нормальность раствора гидрокарбоната кальция. Так как вещества взаимодействуют между собой в эквивалентных количествах, то можно написать
VA ∙ cэк(А) = VB ∙ сэк(B)
6,25 ∙ 0,08 = 100 ∙ сэк (Ca(HCO3)2), отсюда
сэк (Ca(HCO3)2) = 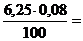 0,005 г/моль.
0,005 г/моль.
Таким образом, в 1 л исследуемой воды содержится
0,005 ∙ 1000 = 5 ммоль гидрокарбоната кальция или 5 ммоль ионов Са2+. Карбонатная жесткость воды равна 5 ммоль/л.
Пример 17.3. Сколько граммов CaSO4 содержится в 1 м3 воды, если жесткость, обусловленная присутствием этой соли, равна 4 ммоль/л?
Решение. Из формулы ж =  находим
находим
 272 г,
272 г,
где 68 г/моль – М эк (CaSO4), найденная по формуле
Мэк (соли) =  ,
,
где М – молярная масса соли, г/моль; n – число ионов металла, участвующих в реакции от каждой молекулы; |c. o.| – абсолютное значение степени окисления иона металла
Мэк (CaSO4) =  = 68 г/моль.
= 68 г/моль.
Пример 17.4. Какую массу соды Na2CO3 надо добавить к 500 л воды, чтобы устранить ее жесткость, равную 5 ммоль/л?
Решение. В 500 л воды содержится 500 ∙ 5 = 2500 ммоль солей, обусловливающих жесткость воды. Для устранения жесткости следует прибавить
2500 ∙ 53 = 132500 мг = 132,5 г соды. (53 г/моль – молярная масса эквивалентов соды Na2CO3).
Задачи
№ 17.1. Какую массу Na3PO4 надо прибавить к 500 л воды, чтобы устранить ее карбонатную жесткость, равную 5 ммоль/л? (Ответ: 136,75 г).
№ 17.2. Вычислить карбонатную жесткость воды, зная, что для реакции с гидрокарбонатом кальция, содержащимся в 200 мл воды, требуется 15 мл 0,08 н раствора НCl. (Ответ: 6 ммоль/л).
№ 17.3. В 1 л воды содержится ионов магния 36,47 мг и ионов кальция
50,1 мг. Чему равна жесткость этой воды? (Ответ: 5,5 ммоль/л).
№ 17.4. Вода, содержащая только сульфат магния, имеет жесткость
7 ммоль/л. Какая масса сульфата магния содержится в 300 л этой воды?
(Ответ: 126 г).
№ 17.5. Вычислить жесткость воды, зная, что в 600 л ее содержится 65,7 г гидрокарбоната магния и 61,2 сульфата кальция. (Ответ: 3 ммоль/л).
№ 17.6. В 220 л воды содержится 11 г сульфата магния. Чему равна жесткость этой воды? (Ответ: 0,83 ммоль/л).
№ 17.7. Жесткость воды, в которой содержится только гидрокарбонат кальция, равна 4 ммоль/л. Какой объем 0,1 н раствора НCl потребуется для реакции с гидрокарбонатом кальция, содержащимся в 75 мл этой воды? (Ответ: 3 мл).
№ 17.8. К 100 л жесткой воды прибавили 12,95 г гидроксида кальция. На сколько понизилась карбонатная жесткость? (Ответ: на 3,5 ммоль/л).
№ 17.9. Вода, содержащая только гидрокарбонат кальция, имеет жесткость
9 ммоль/л. Какая масса гидрокарбонат кальция содержится в 500 л этой воды? (Ответ: 364,5 г).
№ 17.10. Сколько карбоната натрия надо добавить к 5 л воды, чтобы устранить общую жесткость воды, равную 4,60 ммоль/л? (Ответ: 1,22 г).
№ 17.11. В 1 л воды содержится 38 мг ионов Mg2+ и 108 мг ионов Ca2+. Вычислить общую жесткость воды. (Ответ: 8,57 ммоль/л).
№ 17.12. При кипячении 250 мл воды, содержащей гидрокарбонат кальция, выпал осадок массой 3,5 мг. Чему равна жесткость воды?
(Ответ: 0,28 ммоль/л).
№ 17.13. Чему равна временная жесткость воды, в 1 л которой содержится 0,146 г гидрокарбоната магния? (Ответ: 2 ммоль/л).
№ 17.14. Сколько граммов Са(ОН)2 необходимо прибавить к 1000 л воды, чтобы удалить временную жесткость, равную 2,86 ммоль/л? (Ответ: 106 г).
№ 17.15. Чему равна жесткость воды, в 100 л которой содержится 14,632 г гидрокарбоната магния? (Ответ: 2 ммоль/л).
№ 17.16. В 1 м3 воды содержится 140 г сульфата магния. Вычислить жесткость этой воды. (Ответ: 2,33 ммоль/л).
№ 17.17. Какая масса сульфата кальция содержится в 200 л воды, если жесткость, обусловленная этой солью, равна 8 ммоль/л? (Ответ: 108,8 г).
№ 17.18. Какую массу карбоната натрия надо прибавить к 0,1 м3 воды, чтобы устранить жесткость, равную 4 ммоль/л? (Ответ: 21,2 г).
№ 17.19. Чему равна карбонатная жесткость воды, если в 1 л ее содержится 0,292 г гидрокарбоната магния и 0,2025 г гидрокарбоната кальция?
(Ответ: 6,5 ммоль/л).
№ 17.20. Какую массу гидроксида кальция надо прибавить к 275 л воды, чтобы устранить ее карбонатную жесткость, равную 5,5 ммоль/л?
(Ответ: 56 г).
Лабораторная работа 18
Алюминий, олово, свинец
Цель работы: изучить химические свойства алюминия и его соединений, а также соединений олова и свинца.
Задание: получить гидроксиды Al, Sn (II), Pb (II) и убедиться на опытах, что они имеют амфотерный характер; что соединения Sn (II) проявляют свойства восстановителей, а соединения Pb (IV) – окислителей. Выполнить требования к результатам опытов, оформить отчет, решить задачу.
Теоретическое введение
Алюминий, олово, свинец – элементы главных подгрупп III и IV групп. Относятся к р-металлам.
На внешнем энергетическом уровне у атомов алюминия находится три электрона (3s2p1), поэтому в большинстве соединений он проявляет степень окисления +3.
На воздухе алюминий покрывается очень прочной тончайшей оксидной пленкой, которая определяет его высокую коррозионную стойкость:
4А1 + 3О2 = 2А12О3
Стандартный электродный потенциал алюминия равен –1,662 В. Несмотря на столь большое отрицательное его значение, алюминий, вследствие образования на его поверхности защитной оксидной пленки, не вытесняет водород из воды. Однако амальгамированный алюминий, на котором не образуется плотного слоя оксида, энергично взаимодействует с водой с вытеснением водорода.
Разбавленные соляная и серная кислоты легко растворяют алюминий, особенно при нагревании. В концентрированных азотной и серной кислотах, а также в сильно разбавленной азотной кислоте алюминий устойчив, так как эти кислоты пассивируют алюминий, упрочняя защитную оксидную пленку на его поверхности.
При действии на алюминий водных растворов щелочей слой оксида растворяется:
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Алюминий, лишенный защитной пленки, взаимодействует с водой:
 Al + 6H2O = 2Al(OH)3 + 3Н2
Al + 6H2O = 2Al(OH)3 + 3Н2
Образующийся гидроксид алюминия реагирует с избытком щелочи, образуя гидроксоалюминат:
Al(OН)3 + NaOH = Na[Al(OH)4]
Суммарное уравнение реакции имеет вид:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3Н2
Гидроксид алюминия Al(OН)3 получается действием щелочи на раствор соли и, как амфотерный гидроксид, легко растворяется в избытке щелочи и кислотах.
Атомы олова и свинца на внешнем энергетическом уровне имеют по 4 электрона (ns2р2). Поэтому характерные степени окисления олова и свинца +2 и +4. Для олова наиболее устойчивыми являются соединения со степенью окисления +4. Поэтому соединения Sn (II) являются восстановителями. Для свинца, наоборот, наиболее типичны соединения со степенью окисления +2. Вследствие этого соединения Pb (IV) проявляют себя как окислители.
В ряду напряжений олово и свинец расположены непосредственно перед водородом. В разбавленных HCl и H2SO4 олово растворяется очень медленно с образованием Sn2+ и выделением водорода, а свинец в этих кислотах почти не растворяется, так как покрывается нерастворимыми продуктами окисления PbCl2 и PbSO4. В концентрированной HCl эти металлы растворяются с образованием хлорокомплексов:
М + 4HCl (конц.) = Н2[MCl4] + H2↑
 Концентрированная H2SO4 окисляет олово в Sn(SO4)2, а свинец в Pb(HSO4)2; Н2SO4 при этом восстанавливается в SO2. Разбавленной HNO3 олово и свинец окисляются в нитраты М(NO3)2, восстанавливая HNO3 в NO. Концентрированная HNO3 переводит олово в оловянную кислоту H2SnO3, а свинец – в соль Pb(NO3)2, HNO3 восстанавливается до NO2. При нагревании оба металла растворяются в водных растворах щелочей:
Концентрированная H2SO4 окисляет олово в Sn(SO4)2, а свинец в Pb(HSO4)2; Н2SO4 при этом восстанавливается в SO2. Разбавленной HNO3 олово и свинец окисляются в нитраты М(NO3)2, восстанавливая HNO3 в NO. Концентрированная HNO3 переводит олово в оловянную кислоту H2SnO3, а свинец – в соль Pb(NO3)2, HNO3 восстанавливается до NO2. При нагревании оба металла растворяются в водных растворах щелочей:
М + 2NaOH + 2H2O = Na2[M(OH)4] + H2
Олово и свинец образуют нерастворимые в воде оксиды: SnO, PbO и SnO2, PbO2. Этим оксидам соответствуют гидроксиды, обладающие амфотерными свойствами. В гидроксидах олова (II) и свинца (II) преобладают основные свойства, а в гидроксидах олова (IV) и свинца (IV) – кислотные.
Выполнение работы
Опыт 1. Взаимодействие алюминия с кислородом и водой
Две алюминиевые проволоки зачистить наждачной бумагой. В пробирку налить 2-3 мл концентрированного раствора NaОН, нагреть его и опустить туда алюминиевые проволоки на 2-3 секунды. Затем сполоснуть их водой и опустить в раствор соли ртути, налитой в пробирку. Снова сполоснуть проволоки и обсушить фильтровальной бумагой. Одну из проволок опустить в воду, а другую оставить на воздухе. Отметить протекающие изменения с проволоками.
Требования к результатам опыта:
1. Объяснить, с какой целью алюминиевые проволоки обрабатывают растворами NaОН и Hg(NO3)2.
2. Закончить уравнения реакций:
Al + H2O =;
Al + O2 + H2O =
Опыт 2. Получение и свойства гидроксида алюминия
В две пробирки налить по 1-2 мл раствора соли алюминия и в каждую пробирку добавить по каплям раствор щёлочи до образования осадка. В первой пробирке на осадок подействовать разбавленной HCl, во второй – раствором NaOH. Что наблюдается?
Требования к результатам опыта:
1. Написать молекулярные и ионные уравнения реакций получения Al(OH)3 и взаимодействия Al(OH)3 с кислотой и щёлочью.
2. Составить уравнение диссоциации Al(OH)3 по типу кислоты и по типу основания.
3. Сделать вывод о кислотно-основных свойствах гидроксида алюминия.
Опыт 3. Получение и свойства гидроксидов олова (II) и свинца (II)
В одну пробирку налить 2-3 мл раствора соли олова, в другую – такое же количество соли свинца. В обе пробирки по каплям добавить щёлочи до образования осадка.
Для испытания образовавшихся осадков содержимое каждой из пробирок разделить на две части. К одной из них добавить разбавленной HNO3, к другой – концентрированной щёлочи. Размешать растворы до растворения осадков.
Требования к результатам опыта:
1. Написать уравнения реакций получения гидроксидов олова (II) и свинца (II).
2. Составить уравнения реакций взаимодействия Sn(OH)2 и Pb(OH)2 с кислотой и щёлочью.
3. Составить уравнение диссоциации М(ОН)2 по типу кислоты и по типу основания.
4. Сделать вывод о кислотно-основных свойствах гидроксидов олова (II) и свинца (II).
Опыт 4. Восстановительные свойства соединений олова (II)
Восстановление перманганата калия
В пробирку налить 3-4 мл раствора KMnO4, добавить 1-2 мл разбавленной HCl и прилить раствор SnCl2 до обесцвечивания раствора.
Восстановление дихромата калия
В пробирку налить 4-5 мл раствора K2Cr2O7, добавить 2-3 мл разбавленной HCl и прилить по каплям раствор SnCl2 до появления зелёной окраски.
Опыт 5. Окислительные свойства оксида свинца (IV)
В пробирку налить 3-4 мл раствора HNO3, добавить шпатель PbO2 и 1 мл раствора MnSO4. Содержимое осторожно прокипятить, дать отстояться и отметить окраску раствора.
Требования к результатам опытов 4, 5:
1. Закончить уравнения реакций: KMnO4 + SnCl2 + HCl =
K2Cr2O7 + SnCl2 + HCl =
PbO2 + MnSO4 + HNO3 =
2. Сделать вывод об окислительно-восстановительных свойствах соединений олова и свинца.
Задачи
№ 18.1. Составить уравнения реакций, которые нужно провести для осуществления следующих превращений:
Al → Al2(SO4)3 → Al(OH)3 → Na[Al(OH)4] → Al(NO3)3
№ 18.2. Чем можно объяснить восстановительные свойства соединений олова (II) и окислительные свойства соединений свинца (IV)? Закончить уравнения реакций:
а) SnCl2 + HgCl2 =; б) KCrO2 + PbO2 + KOH = K2CrO4 + ….
№ 18.3. Какие оксиды и гидроксиды образует олово? Как изменяются их кислотно-основные свойства в зависимости от степени окисления олова? Закончить уравнения реакций:
а) SnO2 + KOH =; б) SnO + H2SO4 =; в) Sn(OH)2 + NaOH =
№ 18.4. При сжигании 18 г алюминия в кислороде выделилось 558 кДж теплоты. Определить энтальпию образования оксида алюминия.
(Ответ: −1674 кДж).
№ 18.5. Закончить уравнения окислительно-восстановительных реакций:
а) PbO2 + Cr(NO3)3 + NaOH = Na2CrO4 + …; б) SnCl2 + FeCl3 =
№ 18.6. Написать уравнения реакций взаимодействия металлов с кислотами:
а) Sn + H2SO4 (разб.) =; б) Pb + HNO3 (конц.) =; в) Sn + HNO3 (конц.) =
№ 18.7. Закончить в молекулярном и ионном виде уравнения реакций гидролиза солей: а) AlCl3 + H2O ↔; б) SnSO4 + H2O ↔; в) Pb(NO3)2 + H2O ↔
№ 18.8. Какие оксиды и гидроксиды образует свинец? Как изменяются их кислотно-основные и окислительно-восстановительные свойства в зависимости от степени окисления свинца? Закончить уравнения реакций:
а) PbO2 + NaOH =; б) PbO + HNO3 =; в) Pb(OH)2 + KOH =
№ 18.9. Рассчитать ΔG0х.р. и установить возможность самопроизвольного протекания реакции 4Al + 3CO2 =2Al2O3 + 3C. (  кДж/моль;
кДж/моль;  кДж/моль).
кДж/моль).
№ 18.10. Закончить уравнения реакций: а) Al + HCl =;
б) Sn + HNO3 (разб.) =; в) Pb + HNO3 (разб.)=; г) Al + KOH + H2O =
№ 18.11. Вычислить  реакции восстановления оксида свинца углем с образованием СО. (
реакции восстановления оксида свинца углем с образованием СО. (  кДж/моль;
кДж/моль;  кДж/моль).
кДж/моль).
(Ответ: 108,8 кДж).
№ 18.12. Как можно получить α-оловянную кислоту, а затем перевести ее в раствор? Написать соответствующие уравнения реакций.
№ 18.13. При электролизе водного раствора SnCl2 на аноде выделилось 4,48 л хлора (условия нормальные). Найти массу выделившегося на катоде олова. (Ответ: 23,7 г)
№ 18.14. Каким образом можно перевести в раствор металлический свинец? Составить соответствующие уравнения реакций.
№ 18.15. Составить схемы электролиза водного раствора Pb(NO3)2, если:
а) анод свинцовый; б) анод угольный.
№ 18.16. Как можно перевести в раствор металлическое олово? Составить соответствующие уравнения реакций.
№ 18.17. К раствору, содержащему SnSO4 и Pb(NO3)2, прибавили избыток раствора КОН. Составить молекулярные и ионные уравнения реакций.
№ 18.18. Как можно перевести в раствор металлический алюминий? Составить соответствующие уравнения реакций.
№ 18.19. Закончить уравнения реакций:
а) SnCl2 + KMnO4 + H2SO4 = Sn(SO4)2 + …; б) PbO2 + Na3CrO3 + NaOН =
№ 18.20. Закончить уравнения реакций:
а) Al + KMnO4 + H2SO4 =; б) AlCl3 + Na2CO3 + H2O =
Лабораторная работа 19
Дата добавления: 2018-06-27; просмотров: 586; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
